泛素特异性修饰酶2-69对大鼠系膜细胞内饰胶蛋白聚糖表达和泛素化降解的调节
2015-04-22骆伟丽孙建勇赵仲华张志刚吴慧娟
骆伟丽 茅 幸 孙建勇 赵仲华 张志刚,3 吴慧娟,3
·论著·
泛素特异性修饰酶2-69对大鼠系膜细胞内饰胶蛋白聚糖表达和泛素化降解的调节
骆伟丽1,2茅 幸1,3孙建勇4赵仲华1张志刚1,2,3吴慧娟1,2,3
目的研究泛素特异性修饰酶2-69(USP2-69)对系膜细胞(MC)内饰胶蛋白聚糖(DCN)表达和泛素化的调节作用。方法①培养MC细胞,采用Western blot法检测大鼠肾MC内USP2-69的表达;②采用免疫共沉淀、激光共聚焦和免疫荧光法,检测MC内USP2-69是否与DCN结合,并观察两者在MC内的定位;③将pRK5-USP2-69-HA质粒瞬时转染MC后,用Western blot法检测HA、USP2-69和DCN的蛋白表达,用免疫共沉淀法检测DCN的泛素化水平;④采用USP2-69 siRNA处理MC,用PCR检测USP2-69和DCN的mRNA表达,用time-course Western blot法检测DCN的半衰期, Western blot法检测DCN的下游效应分子(TGF-β1和Col Ⅳ)的蛋白表达。结果① USP2-69在MC、肝细胞(BRL-3A)和足细胞(GEC)内均有表达,其在MC内的基础蛋白表达水平显著高于BRL-3A和GEC[MCs:(0.27±0.05),BRL-3A:(0.035±0.009),GEC:(0.012±0.004),P<0.01]。② MC总蛋白经DCN抗体免疫沉淀后,可检测到USP2-69的表达;经USP2-69抗体免疫沉淀后,可检测到DCN表达;且在MC胞质内,代表USP2-69蛋白的荧光与代表DCN蛋白的荧光存在共定位。③ 转染pRK5-USP2-69-HA质粒的MC内可检测到代表外源性USP2-69表达的HA蛋白,USP2-69和DCN蛋白表达的升高,同时DCN的泛素化水平明显降低。④ 经USP2-69 RNA干扰的MC内DCN的mRNA水平没有明显改变,但其半衰期明显缩短(3 h),且TGF-β1和Col Ⅳ的蛋白表达均明显升高。结论大鼠肾MC内USP2-69可与DCN相结合,及两者在胞质内共定位,USP2-69能够降低MC内DCN的泛素化水平及提高DCN蛋白总量并促进其功能。
饰胶蛋白聚糖; 泛素特异性修饰酶2-69; 系膜细胞
饰胶蛋白聚糖(DCN)是一种可由肾小球系膜细胞(MCs)分泌、富含亮氨酸的蛋白聚糖,在调控细胞外基质合成、组成和细胞生长等方面都发挥重要作用[1]。DCN的过表达可抑制体外培养MC的生长及其TGF-β1和Col Ⅳ的蛋白表达,提示DCN是防治肾小球肾炎及阻止肾小球硬化的潜在靶点[2]。本课题组前期已证实MC内DCN通过泛素-蛋白酶体途径(UPP)降解[3]。UPP是调节蛋白质降解和功能的一个重要系统,其对多种细胞的生理活动有重要作用。同时,UPP是一个可逆的过程,即细胞内还同时存在一些特异性的去泛素化酶,后者能阻碍靶蛋白的降解而对其形成负反馈调节[4]。泛素特异性修饰酶2-69(USP2-69)是一个在肾组织内呈现高表达的去泛素化酶。本课题组前期发现,USP2-69与系膜增生性肾炎的疾病进展相关[5],但USP2-69是否与DCN密切相关,目前还未见报道。
本研究采用免疫共沉淀、激光共聚焦和基因转染等技术,观察MC内USP2-69和DCN的结合及定位,以及USP2-69对DCN的泛素化、细胞内DCN蛋白水平和DCN功能的影响,以期为治疗系膜增生性肾小球肾炎寻找新的作用靶点提供理论依据。
1 方法
1.1 抗体和试剂 鼠抗DCN抗体购自R&D 公司,鼠抗ub抗体购自 Santa Cruz Biotechnology 公司,鼠抗HA-TAG抗体购自 Cell Signaling Technology公司,兔抗Col Ⅳ、鼠抗TGF-β1和 兔抗USP2-69购自 Abcam 公司,兔抗USP2 抗体(可检测USP2-69和USP2-45)购自 Protein Tech Group,鼠抗β-actin单克隆抗体购自 Sigma-Aldrich公司,辣根过氧化物酶标记的羊抗鼠IgG和羊抗兔IgG购自Jackson公司。 Cycloheximide 购自 Beyotime公司,Protein-A Sepharose CL-4B 购自 Amersham Biosciences Limited。其他试剂购自上海生工公司。
1.2 细胞培养 大鼠MC是本实验室自雄性SD大鼠的肾皮质分离获得;大鼠肾足细胞(GEC)由陈广平博士(Department of Cell Biology, Emory University School of Medicine, Atlanta, 美国)惠赠;大鼠肝脏细胞(BRL-3A)由本系张锦生教授惠赠(购自上海细胞所细胞库),实验用细胞为6~15代。细胞贴壁生长,采用含10%小牛血清的DMEM培养基,37℃、5%CO2、95%空气饱和湿度培养箱培养,适时传代。
1.3 细胞免疫荧光和激光共聚焦 以每孔1×105个细胞的密度接种于放有18 mm×18 mm盖玻片的3.5 cm2培养皿中,甲醇和冰醋酸以3∶1的比例混合后4℃预冷,固定细胞15 min, PBS室温清洗细胞5 min×3次;加入抗USP2抗体、抗USP2-69抗体和抗DCN抗体和二抗工作液,缓冲甘油封片,荧光显微镜或激光共聚焦显微镜下观察MC内USP2-69和DCN的蛋白表达及定位,并拍照。
1.4 质粒转染 转染前1 d,按照1×106·mL-1的密度接种MC至6 cm2培养皿中,更换无抗生素培养基培养12~24 h,使细胞达到90%~95%融合。在Eppendorf管中制备溶液A(0.5 mL无血清培养基Opti-MEM中加入8 mg pRK5-USP2-69kD-HA真核表达质粒DNA)和溶液B(0.5 mL无血清培养基Opti-MEM中加入20 mL LipofectamineTM2000),室温放置5 min;将溶液A和B轻柔混合,室温放置20 min,形成转染复合物;同时用PBS洗涤细胞2次,无血清培养基Opti-MEM洗涤细胞2~3次,加入3 mL无血清培养基Opti-MEM;将质粒DNA-LipofectamineTM2000转染复合物加入培养皿中,轻柔混合均匀;6 h后弃转染复合物,改用含10%胎牛血清的DMEM完全培养基继续培养至48 h后回收细胞并提取蛋白。
1.5 RNA干扰 转染前1 d,按照5×105·mL-1的密度接种MC至10 cm2培养皿中,更换无抗生素培养基培养12~24 h,使细胞达到50%~60%融合。在Eppendorf管中制备溶液C(1.5 mL无血清培养基Opti-MEM中加入30 mL USP2-69 siRNA)和溶液D(1.5 mL无血清培养基Opti-MEM中加入30 mL LipofectamineTM2000),室温放置5 min;将溶液C和D轻柔混合,室温放置20 min,形成转染复合物;同时用PBS洗涤细胞2次,无血清培养基Opti-MEM洗涤细胞2~3次,加入7 mL无血清培养基Opti-MEM;将USP2-69 siRNA -LipofectamineTM2000转染复合物加入培养皿中,轻柔混合均匀;6 h后弃转染复合物,改用含10%胎牛血清的DMEM培养基继续培养至72 h。 USP2-69-siRNA引物, sense: 5′-AGCCGUUCUGAGUACCUAATT-3′, anti-sense: 5′-UUAGGUACUCAGAACGGCUGG-3′ (由Takara公司设计并合成)。
1.6 总RNA提取和RT-PCR 总RNA提取按照Trizol试剂盒说明书进行。逆转录反应为25 μL反应体系,包含2 μg的总RNA,1 μL M-MLV (200 U·μL-1) 逆转录酶和 3 μL Oligo (dT)18 (100 ·μL-1)。PCR条件为95℃变性12 min,后95℃变性45 s,以56℃(DCN)、60℃(USP2-69)或58℃(β-actin)退火30 s,72℃延伸40 s,30个循环,最后72℃延伸10 min。取PCR产物5 μL,进行1%琼脂糖凝胶电泳。PCR引物如下:DCN:5′-TGGCAGTCTGGCTAATGT-3′ 和5′-ACTCACGGCAGTGTAG-GA-3′;USP2-69:5′-CAGA-CCCGTGGCAATGAAA-3′和5′-GCTGTTCGATTTCTTCTGGC-3′;β-actin:5′-AGGATGCAG-AAGGAGATTACTGC-3′和 5′-AAAACGCAGCTCAGTAACAG-TGC-3′。DCN、USP2-69和β-actin的PCR产物大小分别为199、146和220 bp。
1.7 Western blot和Time-course Western blot 细胞刮勺轻柔刮下贴壁细胞后4℃离心(4 000 r·min-1×10 min),弃上清后加入细胞裂解液(pH 7.4) ,含有50 mmol·L-1Tris-HCl, 150 mmol·L-1NaCl, 1 mmol·L-1EDTA, 1% Triton X-100, 0.1% SDS, 10% glycerol, 0.2 mg·mL-1NaN3, 1 μg·mL-1pepstatin A, 1 μg·mL-1aprotinin, 1 μg·mL-1leupeptin, 1 mmol·L-1phenylmethylsulfonyl fluoride,裂解细胞提取蛋白。所获蛋白经SDS-PAGE胶(8%~12%)电泳后转移至PVDF膜,经10%脱脂奶粉封闭后依次加入一抗和二抗,再由ECL化学发光法进行检测,以β-actin为内参进行分析。为检测经USP2-69 RNA干扰后MC内DCN半衰期的改变,采用Time-course Western blot法,采用10 μg·L-1蛋白合成抑制剂 (CHX)处理MC后,分别于0、6、12、24和48 h终止培养并提取细胞总蛋白,其余步骤同Western blot。
1.8 免疫共沉淀 100 mg Protein A SepharoseTMCL-4B加1倍体积的TNT buffer,4℃浸泡过夜。取MC裂解产物2 mg细胞总蛋白用预冷的NET buffer (50 mmol·L-1Tris-HCl pH 7.4, 150 mmol·L-1NaCl, 0.1% NP-40, 1 mmol·L-1EDTA, 0.25% gelatin, 0.02% sodium azide, 1 mmol·L-1PMSF, 1% aprotinin)加至0.5 mL,分别加入1 mg抗DCN抗体、抗USP2-69抗体、抗HA抗体或抗Ub抗体,4℃孵育过夜;加入80 mL Protein A SepharoseTMCL-4B,4℃翻转过夜;与Protein A SepharoseTMCL-4B结合的免疫复合物,用TNT buffer室温洗3次,NET buffer室温洗1次,PBS室温洗1次;加入5′SDS凝胶上样缓冲液,从Protein A SepharoseTMCL-4B上洗脱免疫复合物。其余步骤同Western blot,使用抗USP2-69、抗HA抗体、抗Ub抗体或抗DCN抗体检测。

2 结果
2.1 USP2-69在MC中的表达 Western blot 结果表明,与大鼠GEC和BRL-3A相比,USP2-69在大鼠MC中表达最高[MCs:(0.27±0.05),BRL-3A:(0.035±0.009),GEC:(0.012±0.004),P<0.01];而USP2的另一亚型USP2-45在BRL-3A中表达最高, MC次之,在GEC中表达最低[BRL-3A:(0.17±0.16),MCs:(0.053±0.046),GEC:(0.005±0.006),P< 0.01](图1)。

图1 肾系膜细胞、肝细胞和肾足细胞内USP2-69与USP2-45的蛋白表达
Fig 1 The protein expression of USP2-69 and USP2-45 in MCs, BRL-3A and GEC
2.2 MC内USP2-69与DCN的结合和定位 免疫共沉淀结果显示,经DCN抗体免疫沉淀后的蛋白中,可检测出USP2-69的特异性条带(图2A),其位置与未经免疫沉淀的MC总蛋白阳性对照泳道上检测出的USP2-69条带位置相同(图2A);经USP2-69抗体免疫沉淀后的蛋白中,可检测出DCN的特异性条带(图2B),其位置与MC总蛋白阳性对照泳道上检测出的DCN条带位置相同(图2B);用非特异性IgG免疫沉淀的阴性对照泳道上均未检测出条带(图2A、B)。提示MC中DCN可与内源性USP2-69结合。

图2 免疫共沉淀法检测肾系膜细胞内DCN与USP2-69蛋白的结合
Fig 2 The physical interaction between DCN and USP2-69 in MC was examined by co-immunoprecipitation
Notes The interaction between DCN and endogenous/exogenous USP2-69 in MC. A:IP: DCN,IB: USP2-69;B:IP: USP2-69,IB: DCN;C: IP: DCN,IB: HA;D: IP: HA,IB: DCN
转染USP2-69-HA质粒的MC(MCs/USP2-69)蛋白经DCN抗体免疫沉淀后,可检测出代表外源性USP2-69的HA条带(图2C),其位置与MCs/USP2-69总蛋白阳性对照泳道上检测出的HA条带位置相同(图2C);经HA抗体免疫沉淀后的蛋白中,可检测出DCN的特异性条带(图2D),其位置与MCs/USP2-69总蛋白阳性对照泳道上检测出的DCN条带位置相同(图2D);用非特异性IgG免疫沉淀的阴性对照泳道上均未检测出条带(图2C、D)。提示MC中DCN可与外源性USP2-69结合。
激光共聚焦结果显示,细胞内USP2-69蛋白的红色荧光(胞质内表达[6])与代表DCN蛋白的绿色荧光在胞质内存在共定位(图3A~C)。由于该USP2抗体同时能检测到在核内表达的另一亚型USP2-45,故细胞核也显示红色荧光[6]。使用针对USP2-69抗体进行免疫荧光后的结果显示,胞浆内表达的USP2-69(绿色荧光)与呈现红色荧光的DCN蛋白存在共定位(图3 D~F)。
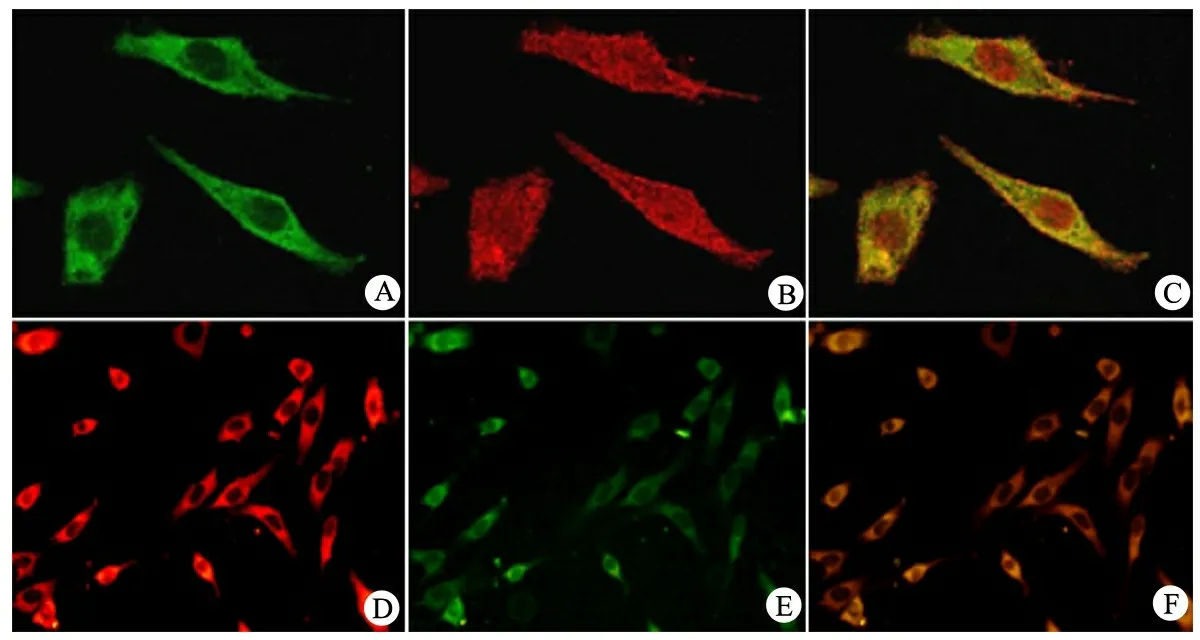
图3 肾系膜细胞内DCN与USP2-69的定位
Fig 3 The localization of DCN and USP2-69 in MC
Notes Upper panel: the localization of DCN (A), USP2 (B) and merge (C) in MC by using confocal microscopy. Lower panel: the localization of DCN (D), USP2-69 (E) and merge (F) in MC by using immunofluorescence
2.3 USP2-69对MC内DCN表达的影响 Western blot结果显示,与未转染(MCs)和空载转染(MCs/pPK5)相比,经pRK5-USP2-69-HA质粒转染的MC内,可检测到代表外源性USP2-69 表达的HA蛋白及USP2-69总蛋白表达的上调[MCs/USP2-69-HA:(0.98±0.08), MCs:(0.47±0.04),MCs/pRK5:(0.36±0.06),P<0.01];同时DCN表达上调[MCs/USP2-69-HA:(0.93±0.08),MCs:(0.60±0.07),MCs/pRK5:(0.60±0.02),P< 0.01] (图4A)。
进一步观察USP2-69对DCN mRNA水平的影响,发现MC经USP2-69RNA干扰后,DCN mRNA表达水平无变化(图4B),提示USP2-69对DCN蛋白表达的调节在转录后。
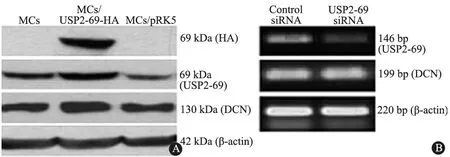
图4 肾系膜细胞转染后蛋白表达和RNA干扰后mRNA表达
Fig 4 The protein expression after transfection and mRNA expression after RNA interference
Notes A: The protein expression of HA, USP2-69 and DCN in MC after transfection with pRK5-USP2-69-HA plasmid; B: The mRNA expression of USP2-69 and DCN in MC after USP2-69 RNA interference
2.4 USP2-69对MC内DCN泛素化降解过程及稳定性的影响 免疫共沉淀结果显示(图5A),与未转染和阴性对照转染比较,pRK5-USP2-69-HA质粒转染的MC内DCN的泛素化水平(DCN-Ub)明显降低[MCs/USP2-69-HA:(22.9±1.5),MCs:(36.1±1.4),MCs/pRK5:(39.7±1.2),P<0.01]。Time-course Western blot结果显示(图5B),与CHX联合siRNA对照处理相比, 经CHX联合USP2-69 siRNA处理的MC内DCN的半衰期明显缩短,约为3 h(图5C)。
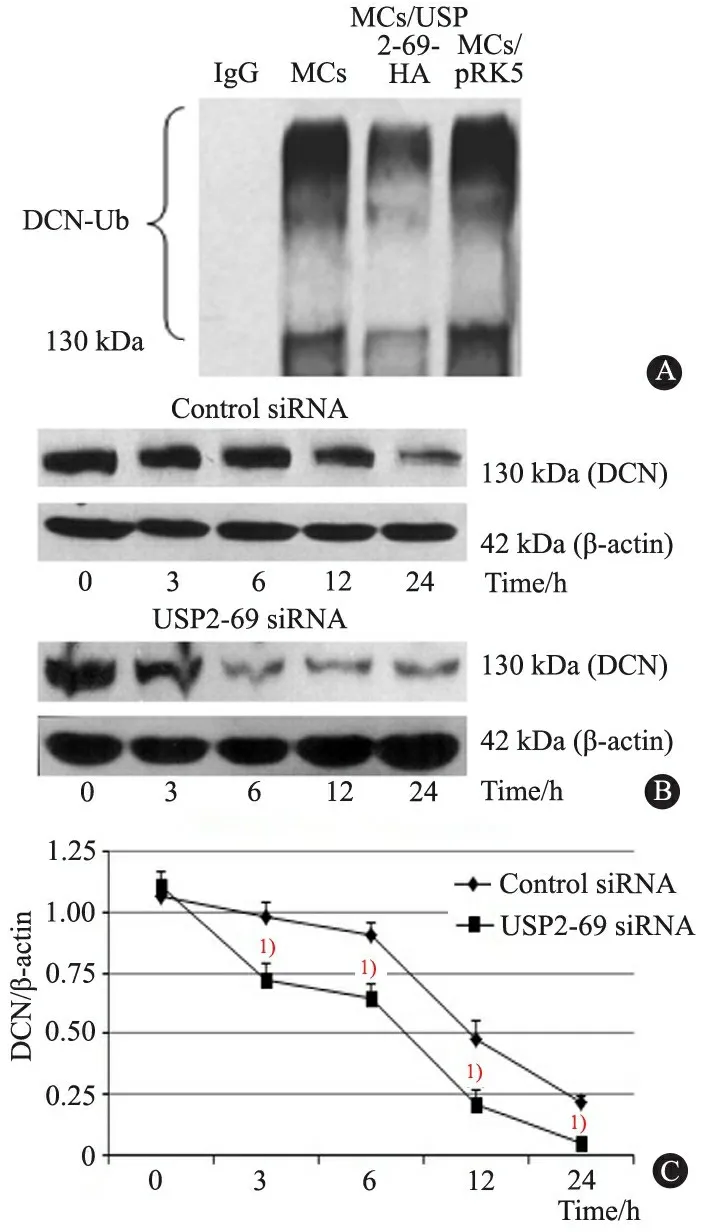
图5 经质粒转染后泛素化DCN和RNA干扰后DCN半衰期的变化
Fig 5The ubiquitinated DCN after trans-ferred and the half-life of DCN after RNA interference
Notes A: The ubiquitinated DCN in MC after transferred with pRK5-USP2-69-HA plasmid; B:The protein level of DCN in MC after USP2-69 RNA interference ; C: The half-life of DCN in MC after USP2-69 RNA interference
2.5 USP2-69对MC内TGF-β1 和 Col Ⅳ蛋
白表达的影响 Western blot结果显示,与siRNA对照处理相比,USP2-69 siRNA处理后伴随着MC内USP2-69蛋白表达降低[(10.4±0.9)vs(16.4±1.2),P < 0.05],DCN蛋白表达降低[(9.6±1.0)vs(19.5±1.9),P< 0.01],而TGF-β1[(16.73±1.42)vs(4.73±0.64),P<0.01]和Col Ⅳ[(14.4±1.1)vs(5.4±0.8),P< 0.01]蛋白表达明显升高(图6)。
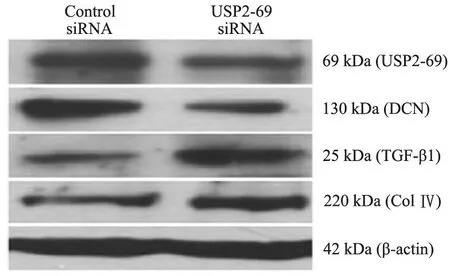
图6 MC经USP2-69 RNA干扰后USP2-69, DCN, TGF-β1 和 Col Ⅳ的蛋白表达
Fig 6 The protein expressions of USP2-69, DCN, TGF-β1 and Col Ⅳ in MC after USP2-69 RNA interference
3 讨论
USP2定位于11号染色体长臂(11q23.3),因mRNA的选择性拼接而生成2种分子量的亚型,即 USP2-45 和USP2-69,均具有共同的水解核心,但其在N-末端或C-末端存在差异[6]。在对肾脏的相关研究中,目前有关USP2的研究报道还很少,Florian等[7]通过检测多种组织USP2亚型的表达后,发现肾组织中USP2-69表达较高。本研究结果表明,正常MC中USP2-69的基础表达水平高于GEC和BRL-3A,且其定位于细胞质,而USP2-45定位于细胞核,提示两者在MC中发挥的功能不尽相同。
去泛素化酶识别靶蛋白具有一定的特异性,可反向调节靶蛋白的泛素化降解。去泛素化酶通过催化水解泛素分子C-末端的多肽链连接(α或ε连接),将底物蛋白上的多聚泛素链水解分离,起到去泛素化作用,阻碍靶蛋白的降解而形成负反馈调节[8]。在对USP2-69发挥去泛素化酶功能的研究方面,目前报道了6种能被其识别的靶蛋白:FAS、Mdm2、MdmX、Cyclin D1、Cyclin A1 和 Aurora-A[9~14]。USP2-69能特异性地使这些靶蛋白去泛素化,从而稳定靶蛋白并促进靶蛋白的生物学功能。本研究发现大鼠肾MC内USP2-69不仅与DCN相互结合及胞质内共定位,还能通过使DCN去泛素化,从而增加DCN的蛋白表达并延长其半衰期,结果提示USP2-69是新发现的DCN的特异性去泛素化酶之一。
本课题组前期实验结果表明,当肾小球肾炎时或经体外炎症因子刺激后,USP2-69的蛋白表达可上调,并与肾炎的病理类型相关,提示MC中USP2-69表达上调可能与肾炎发病机制有关[5]。因此本研究探索了USP2-69是否通过其对肾炎拮抗因子DCN的去泛素化从而影响DCN的功能,结果发现USP2-69 siRNA处理MC后,伴随着USP2-69和DCN的蛋白表达降低,DCN的下游效应分子(TGF-β1 和 Col Ⅳ)的蛋白表达升高。上述结果表明,USP2-69可通过使DCN去泛素化以影响DCN下游生物学活性,从而增强DCN在系膜增生性肾炎中拮抗肾炎和肾小球硬化发展的作用。
综上所述,大鼠MC内USP2-69可与DCN相互结合,及两者在胞质内共定位,USP2-69可通过其去泛素化酶作用调节DCN的泛素化降解和细胞内蛋白含量,从而影响DCN的生物学功能。因此,USP2-69是一个在防治肾小球肾炎和肾小球硬化中有潜在价值的重要调节因子。
致谢 感谢加拿大McGill大学Simon Wing教授惠赠本课题组pRK5-USP2-69-HA真核表达质粒。
[1]Iozzo RV. The biology of the small leucine-rich proteoglycans. Functional network of interactive proteins. J Biol Chem, 1999, 274(27): 18843-18846
[2]Sun J, Sun Y, Wu H, et al. Transgene therapy for rat anti-Thy1.1 glomerulonephritis via mesangial cell vector with a polyethylenimine/decorin nanocomplex . Nanoscale Res Lett, 2012, 7(1): 451
[3]Wu H, Jiang W, Zhang Y, et al. Regulation of intracellular decorin via proteasome degradation in rat mesangial cells . J Cel Biochem, 2010, 111(4): 1010-1019
[4]Liu CH, Goldberg AL, Qiu XB. New insights into the role of the ubiquitin-proteasome pathway in the regulation of apoptosis. Chang Gung Med J, 2007, 30(6): 469-479
[5]Wang S, Wu H, Liu Y, et al. Expression of USP2-69 in mesangial cells . Pathol Int, 2010, 60(3): 184-192.
[6]Lin H, Yin L, Reid J, et al. Divergent N-terminal sequences of a deubiquitinating enzyme modulate substrate specificity . J Biol Chem, 2001, 276(23): 20357-20363
[7]Haimerl F, Erhardt A, Sass G, et al. Down-regulation of the de-ubiquitinating enzyme ubiquitin-specific protease 2 contributes to tumor necrosis factor-alpha-induced hepatocyte survival. J Biol Chem, 2009, 284: 495-504
[8]Nijman SM, Luna-Vargas MP, Velds A, et al. A genomic and functional inventory of deubiquitinating enzymes. Cell, 2005, 123(5): 773-786
[9]Stevenson LF, Sparks A, Allende-Vega N, et al. The deubiquitinating enzyme USP2a regulates the p53 pathway by targeting Mdm2. EMBO J, 2007, 26(4): 976-986
[10]Kim J, Kim W, Liu Z, et al. The ubiquitin-specific protease USP2a enhances tumor progression by targeting cyclin A1 in bladder cancer. Cell Cycle, 2012, 11(6): 1123-1130
[11]Graner E, Tang D, Rossi S, et al. The isopeptidase USP2a regulates the stability of fatty acid synthase in prostate cancer . Cancer Cell, 2004, 5(3): 253-261
[12]Shan J, Zhao W, Gu W. Suppression of cancer cell growth by promoting cyclin D1 degradation. Mol Cell, 2009, 36(3): 469-476
[13]Allende-Vega N, Sparks A, Lane DP, et al. MdmX is a substrate for the deubiquitinating enzyme USP2a. Oncogene, 2010, 29(3): 432-441
[14]Shi Y, Solomon L, Pereda-Lopez A, et al. Ubiquitin-specific cysteine protease 2a (USP2a) regulates the stability of aurora-A. J Biol Chem, 2011, 286(45): 38960-38968
(本文编辑:丁俊杰)
Effect of USP2-69 on regulating the expression and ubiquitous degradation of intracellular decorin in mesangial cells in rats
LUOWei-li1,2,MAOXing1,3,SUNJian-yong4,ZHAOZhong-hua1,ZHANGZhi-gang1,2,3,WUHui-juan1,2,3
(1DepartmentofPathology; 2ShanghaiInstituteforKidneysandDialysis,ZhongshanHospital,FudanUniversity;3KeyLaboratoryofMolecularMedicine,ChineseMinistryofEducation,SchoolofBasicMedicalSciences;4InstituteofHealthSciences,ShanghaiInstitutesforBiologicalSciences,ChineseAcademyofSciences,Shanghai200032,China)
WU Hui-juan,E-mail:hjwu@shmu.edu.cn
ObjectiveTo investigate the effects of ubiquitin-specific processing protease 2-69 (USP2-69) on regulating the expression and ubiquitous degradation of decorin (DCN) in mesangial cells (MC). MethodsWestern blot was used to examine the protein expression of USP2-69 in rat MC. Co-IP, confocal and immunofluorescence were used to analyze the interaction between USP2-69 and DCN, and their location in MC. After pRK5-USP2-69-HA eukaryon expression plasmid was transfected into MC, Western blot was used to examine protein expression of HA, USP2-69 and DCN. Co-IP was used to analyze the ubiquitination of DCN. After USP2-69 was knocked down by USP2-69 RNA interference, PCR was used to analyze the mRNA expression of USP2-69 and DCN, time-course Western blot was used to analyze the half-life of DCN and Western blot was used to examine the protein levels of TGF-β1 and Col Ⅳ, two downstream effectors of DCN.Results① USP2-69 was expressed in MC, BRL-3A and GEC, the basal protein expression was higher in MC than in hepatocytes and podocytes[MCs:(0.27±0.05)vsBRL-3A:(0.035±0.009), GEC:(0.012±0.004),P<0.01]. ② After the total protein of MC was immunoprecipitated by anti-DCN antibody, USP2-69 could be detected. Conversely, DCN could be detected after the total protein of MC was immunoprecipitated by anti-USP2-69 antibody. Moreover, there was a co-localization between fluorescence of USP2-69 and DCN in cytoplasm of MC. ③ Protein expressions of HA which represented extrinsic USP2-69, elevated protein level of USP2-69 and DCN, and an obvious decrease of ubiquitinated DCN was detected in MCs transfected with pRK5-USP2-69-HA plasmid. ④ RNA interference of USP2-69 in MC didn′t change the mRNA level of DCN, but markedly shortened the half-life of DCN from 6 h to 3 h and increased the protein expression of TGF-β1 and Col Ⅳ.ConclusionIn cultured rat MC, a physical interaction and a co-localization in cytoplasm existed between USP2-69 and DCN. USP2-69 could decrease the ubiquitinated form of DCN and increase its protein expression and biological function.
Decorin; Ubiquitin-specific processing protease 2-69; Mesangial cells
国家自然科学基金:30900683
1 复旦大学基础医学院病理系 上海,200032;2 复旦大学附属中山医院上海市肾病与透析研究所 上海,200032;3 复旦大学基础医学院教育部分子医学重点实验室 上海,200032;4 中科院上海生命科学研究所,健康科学研究所 上海,200032
吴慧娟,E-mail:hjwu@shmu.edu.cn
10.3969/j.issn.1673-5501.2015.04.012
2015-04-30
2015-06-01)
