重庆单中心手足口病分子流行病学特征分析
2015-04-22王琼肖许红梅
王琼肖 许红梅
·论著·
重庆单中心手足口病分子流行病学特征分析
王琼肖 许红梅
目的 了解2014年重庆地区手足口病的流行特点和分子生物学特征。方法收集2014年重庆医科大学附属儿童医院门诊传染病报卡的手足口病病例和住院的手足口病病例,描述性分析其流行病学特征;对住院并采集了粪便标本的手足口病病例,以RT-PCR方法行肠道病毒DNA扩增和鉴定并测序分型,构建系统进化树行分子流行病学分析。结果19 207例手足口病患儿进入流行病学特征分析,男∶女为1.5∶1,以散居及幼托为主(97.9%),发病中位年龄2.1岁(1 d至17岁),5岁以下患儿占94.2%;呈现4~6月和9~12月2个流行高峰,分别占全年发病的36.9%和52.8%。364例住院且行病原学检测阳性的手足口病病例进入病原学和分子流行病学分析,其中239例为重症病例,EV71感染占64.4%;单纯EV71 195例(53.6%)、单纯CA16 18例(4.9%)、单纯CA6 23例(6.3%)、单纯CA10 6例(1.6%)、混合感染45例(12.4%)、其他肠道病毒77例(21.1%);EV71在1~6月检出率高,CA6在9~12月检出率高,EV71/CA6混合感染占9.3%。病毒序列分析显示2014年重庆地区分离到的EV71属于C4a亚型,CA16为B1b亚型,CA6与日本及西班牙等地的代表菌株同源性较高,CA10与中国其他地区流行株同源性较高。结论2014年重庆地区手足口病流行呈双峰模式,发病人群以5岁以下散居及幼托儿童为主。手足口病流行的病毒株为EV71 C4a亚型和CA16 B1b亚型。
手足口病; 流行病学; 病原学特征; 肠道病毒71型; 柯萨奇病毒
自2009年以来连续6年手足口病位居全国丙类传染病发病及死亡例数的首位[1,2],已成为危害我国儿童生命健康的重要公共卫生问题。EV71和 CA16为手足口病普遍流行的菌株,两者在不同时期交替流行[3],2008年以来,在芬兰[4]、法国[5]、日本[6]、西班牙[7]、新加坡[8]和印度[9]等地相继报道了与CA6、CA10感染相关的手足口病,且逐渐成为主要病原。重庆市位于长江流域上游,气候温和,人口密度大,传染病发病率高,近年手足口病的流行呈逐年增加趋势[10],但其流行病学及病原学特征目前尚不明确。本文回顾性分析重庆医科大学附属儿童医院(我院)2014年诊断的全部手足口病病例的流行特点,并对病原学鉴定结果呈阳性的住院病例进行病毒分子流行病学分析。
1 方法
1.1 诊断标准 依据国家卫计委《手足口病诊疗指南(2010年版)》[11],临床诊断主要以典型的疱疹、皮疹及发热等临床表现为依据;重症病例以出现中枢神经、呼吸和循环等系统严重并发症为标准。
1.2 纳入标准 ①我院门诊填报传染病报告卡的手足口病病例;②感染科(我院唯一接受手足口病住院患儿的科室)出院诊断为手足口病且留取粪便有病原学鉴定结果的病例。
1.3 数据截取 从传染病报告卡和住院病历中共同提取手足口病患儿的性别,年龄,生活方式(散居、幼托、学生),发病时间,住院病例从我院感染科实验室提取病原学鉴定结果。
1.4 病原学鉴定及分型 采集患儿粪便标本置于-70℃冰箱保存行肠道病毒鉴定。采用RT-PCR法以肠道病毒通用型引物(EV)对病毒5′ UTR端进行检测,阳性考虑肠道病毒感染;阳性标本按照病毒核酸提取试剂盒(德国QIAGEN公司)说明书操作进行肠道病毒核酸提取,采用RT-PCR法分别用EV71、CA16、CA6和CA10特异性引物[10]扩增病毒VP1片段行病原学分型,阳性扩增产物送至上海生物工程公司测序分型。
1.5 统计学分析 人口学特征及病例资料分析采用描述性分析,以手足口病严重程度分为普通和重症;以手足口病流行时间分为1~3月、~6月、~9月和~12月; 以手足口病患儿年龄分为:~6月龄、~1岁、~2岁、~3岁、~4岁、~5岁和>5岁。上述数据分析采用Microsoft Office Excel 2010及SPSS 17.0 软件。基因进化分析采用MEGA 5.0软件计算核苷酸和氨基酸同源性和构建系统进化树。
2 结果
2.1 一般情况 2014年1月1日至12月31日符合本文纳入标准的手足口病病例19 207例进入分析。男∶女比例为1.5∶1(11 403/7 804)。患病人群散居及幼托18 804例(97.9%),学生403例(2.1%) 。发病中位年龄2.1岁(1 d至17岁)。5岁以下18 099例(94.2%),~2岁发病最多(6 769例,35.2%),~6月龄发病最少(254例,1.3%)。
图1所示,2014年重庆地区手足口病发病存在2个高峰,9~12月发病总例数为10 147例(52.8%),4~7月为7 082例(36.9%)。重症病例633例(3.3%),发病亦存在2个高峰,其发病高峰时间与总病例分布一致。4~7月重症病例占总病例数的4.3%(307/7 082);9~12月重症病例占总病例数的2.6%(265/10 147)。
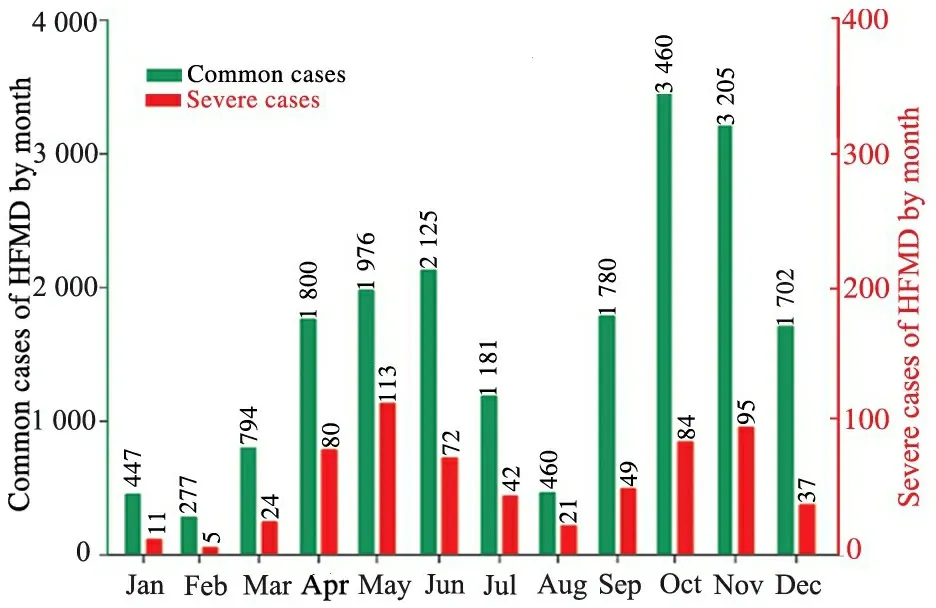
图1 2014年重庆地区普通和重症手足口病例的分布
Fig 1 The distributions of common and severe HFMD by month in Chongqing in 2014
Notes HFMD: hand-foot-mouth disease
2.2 病原学检测总体情况 19 027例手足口病病例中,1 122例(5.9%)为住院病例,其中432例有病原学鉴定结果,表1显示共检出肠道病毒364例(84.3%),其中单纯EV71 195例(53.6%)、单纯CA16 18例(4.9%)、单纯CA6 23例(6.3%)、单纯CA10 6例(1.6%)、混合感染45例(12.4%)、其他肠道病毒77例(21.2%)。45例混合感染中,EV71和CA16同时感染5例(11.1%)、EV71和CA6同时感染34例(75.6%)、EV71和CA10同时感染6例(13.3%)。各病原中混合感染所占比例分别为:EV71 18.8%(45/240)、CA16 21.7%(5/23)、CA6 59.6%(34/57)、CA10 50.0%(6/12)。
2.3 手足口病分子流行病学特点 表1显示,① EV71在1~3和~6月所占比例最高;CA6在~9和~12月比例最高;EV71/CA16和EV71/CA6混合感染在~9和~12月所占比例最大,其中以EV71/CA6混合感染为主。②重症病例EV71感染占64.4%,而普通病例中EV71、其他肠道病毒分别占32.8%和32.0%。③EV71在各年龄患儿均有感染,但随着年龄增长阳性率呈升高趋势,而EV71/CA6混合感染和其他肠道病毒在~6月龄、~1岁和~2岁年龄组比例较高。
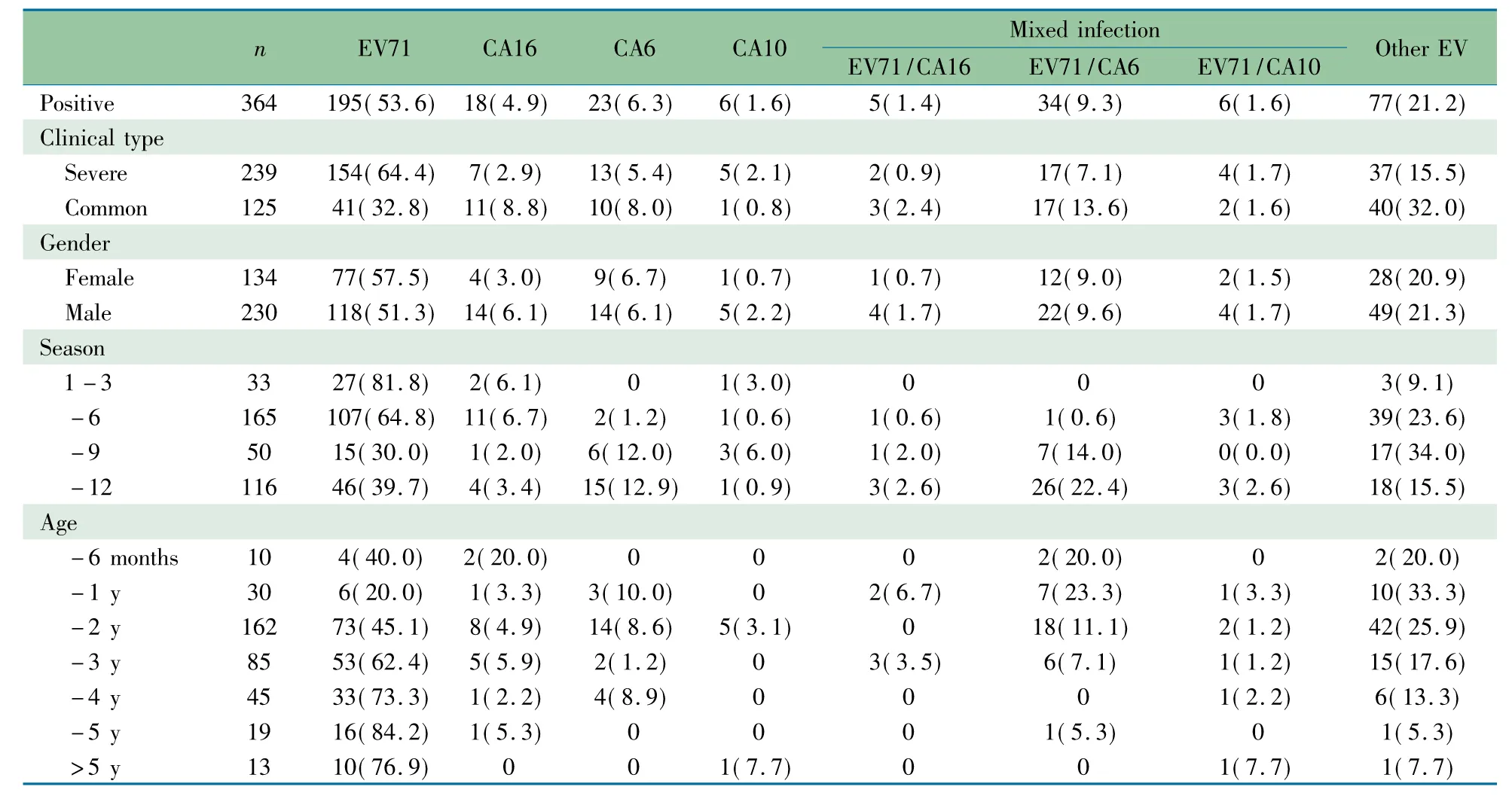
表1 2014年重庆地区手足口病病原学分析[n(%)]Tab 1 The etiology of HFMD in Chongqing in 2014[n(%)]
2.4 病毒基因特征分析
2.4.1 EV71序列基因进化分析 从240例EV71分离株中选取43株(41例重症病例和2例普通病例)行VP1全长段扩增,其核苷酸同源性为93.1%~100%,氨基酸同源性96.8%~100%。将其与GenBank中33株标准序列构建进化树进行分析,结果显示2014年重庆地区EV71病毒株与2010至2013年中国山东(JQ522920)、河南(HM776024、KC493671)、福建(JQ042703)、广东(KC689998)、湖北(JQ419499)、江西(KC007540)、甘肃(GQ855294)以及重庆地区(KM048188、KM048143、KM048140、KM048163等)的C4a亚型标准株同源性高,其核苷酸及氨基酸同源性分别为93.4%~98.4%和97.2%~100%,提示2014年重庆地区的EV71病毒株属于C4a亚型(图2)。重症病例和普通病例在进化树上分布未见明显特征性差异。
2.4.2 CA16序列基因进化分析 对21株CA16分离株(9例重症病例和12例普通病例)进行VP1全长段扩增,其核苷酸同源性为90.5%~100%,氨基酸同源性为98.8%~100.0%。将其与23例CA16标准序列构建基因进化树,结果提示所有CA16病毒株与B1b亚型标准序列位于同一簇,提示2014年重庆地区流行的CA16病毒株属于B1b亚型(图3)。重症病例和普通病例在进化树上分布未见明显特征性差异。
2.4.3 CA6序列基因进化分析 对48株CA6分离株(27例重症病例和21例普通病例)行VP1全长段扩增,其核苷酸同源性为91.3%~100%,氨基酸同源性为93.1%~100%。将其与基因库中25株CA6标准株构建基因进化树显示,CA6与2009至2013年来自日本(AB649288、AB678778)、西班牙(JX845228、JX845232、KC431252),中国台湾(JN582001、JQ946054、JQ946051)、深圳(KC866957)、上海(KF647879)、重庆(KM048082、KM048062、KM048046、KM048063、KM048072)的代表株同源性高,其核苷酸同源性为90.2%~100%,氨基酸同源性为93.1%~100%(图4)。重症病例和普通病例在进化树上分布未见明显特征性差异。
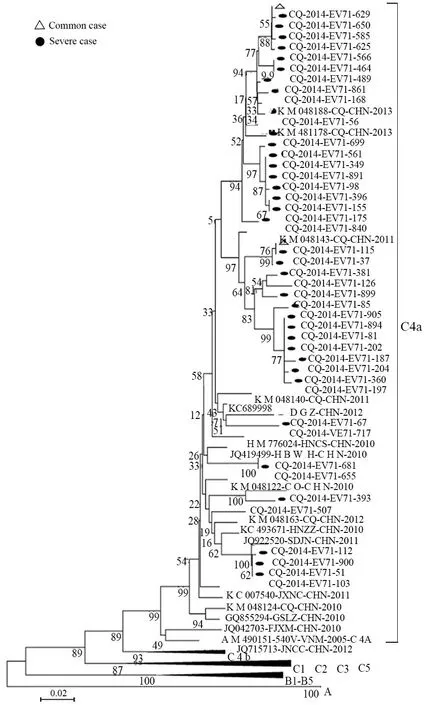
图2 2014年重庆地区EV71进化树Fig 2 Phylogenetic trees of EV71 in Chongqing in 2014
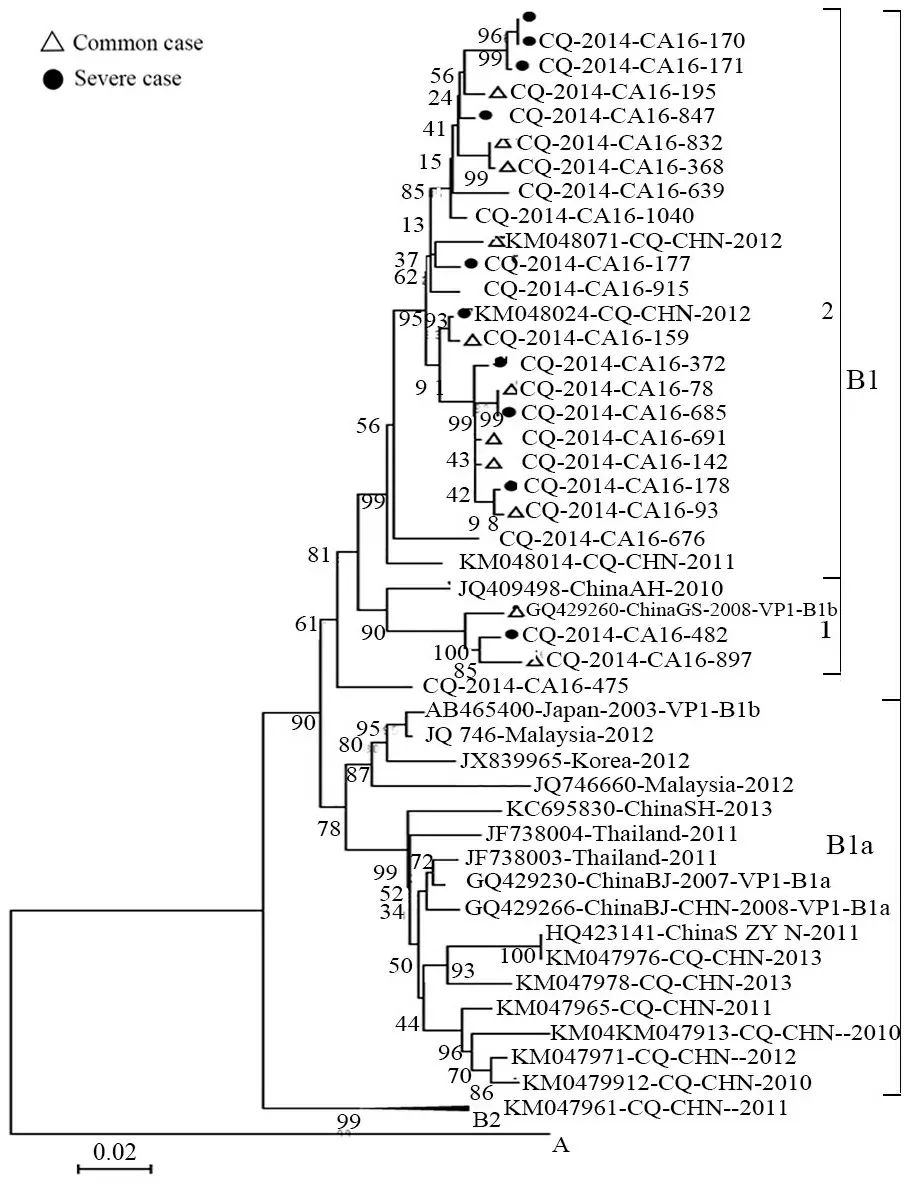
图3 2014年重庆地区CA16进化树
Fig 3 Phylogenetic tree of CA16 in Chongqing in 2014
2.4.4 CA10序列基因进化分析 对4株CA10分离株(3例重症病例和1例普通病例)进行VP1全长段扩增,结果显示其核苷酸同源性为97.1%~99.4%,氨基酸同源性为98.7%~99.6%。对其与GenBank中23株CA10病毒株构建进化树分析,CA10病毒株可以分为5个分支,其中第3分支为中国大陆早期CA10的分离株,其余1、2、4分支分别为来自美国、芬兰及日本的分离株,而2014年重庆地区的CA10分离株与2008至2014年深圳(KP005987、JX473455)、河南(KJ784512、KJ784512)、河北(KF246661)、云南(LC031457、LC031474)和重庆(KM048121、KM048117、KM048110、KM048104)等地的病毒株位于第5分支,其核苷酸和氨基酸同源性分别为96.3%~99.1%和98.7%~100%。重症病例和普通病例在进化树上分布未见明显特征性差异。

图4 2014年重庆地区CA6进化树
Fig 4 Phylogenetic tree of CA6 in Chongqing in 2014
3 讨论
2014年我院共诊治了19 207例手足口病患儿,明显高于我院2010至2013年的每年诊治的人数[10](分别依次为7 399、6 237、10 241、10 964例)。男童病例明显高于女童,与其他研究结果一致[10,12]。患病人群主要为5岁以下散居及幼托儿童,其中<6月龄患儿病例相对较少,与既往研究结果一致[10,12,13],可能与<6月龄患儿体内存在母传抗体对病毒有一定的抵抗力,6月龄后其体内抗体逐渐减少,另外,幼托儿童间相互接触机会多,故感染可能性也相对较大[14],因此该年龄段儿童为手足口病预防与监控的重点对象。
本文结果显示,2014年重庆地区住院病例的主要病原为EV71,其次为其他肠道病毒。重症病例中EV71为主要病原,而普通病例中EV71及其他肠道病毒为主要病原,符合既往研究中EV71易引起重症病例的特点[1]。与重庆地区前期研究相比较[10],在重症病例与普通病例中,CA6和其他肠道病毒有逐渐取代CA16成为主要病原的趋势,广东[15]、深圳[16]和江苏[17]等地区也发现相似的变化趋势,故应逐渐重视CA6和其他肠道病毒的监控,并且明确在未分型肠道病毒中究竟以何种病毒感染为主。本研究还发现EV71和CA16、EV71和CA6、EV71和CA10的混合感染,各病原中混合感染所占比例相对较大,高于既往研究报道[17],Yip等[18]研究发现混合感染可能导致病毒RNA重组,对此应高度重视。
手足口病具有明显的季节分布特征,既往许多研究表明其在全年流行中呈单峰或双峰模式。在日本、中国台湾手足口病发病呈夏季单峰,而在芬兰其发病呈秋季单峰;新加坡、中国香港等地区则呈现春末夏初的流行高峰和秋冬季的次高峰,可能与不同地域的气候条件有关,如环境温度、湿度及气压等影响病毒繁殖与传播[19]。2014年重庆地区手足口病流行呈4~7月和9~12月双峰模式。与重庆地区2010至2013年研究相比较[10],2014年秋冬季的流行强度明显高于往年,分析其病原谱,2014年度9~12月流行高峰其他肠道病毒及混合感染比例较高,推测其可能与2014年秋冬季流行强度增高有关。本研究还发现4~7月流行高峰重症病例比例高于9~12月(307/7 082vs265/9 517),既往文献及本研究均提示EV71为重症病例的主要病原[1],结合病原谱时间分布推测其可能与这2个高峰期EV71的流行强度不同有关。
对2014年重庆地区分离的EV71病毒株进行进化树分析发现彼此间同源性高,其与2010至2012年中国C4a标准株同源性强,提示重庆地区EV71属于C4a亚型,这符合EV71亚型在中国的流行现状[20]。
自1999年来,中国大陆流行的CA16病毒株主要为B1a和B1b亚型[21],本研究中20株CA16病毒株均属于B1b亚型,2010至2013年重庆地区CA6为B1a和B1b共同流行[10],提示重庆地区CA16逐渐向B1b亚型转变。CA16在B1b分支上可分为2个亚支,其中CA16-475、897、482与2008年甘肃地区GQ429460病毒株位于同一分支;而其余18株CA16病毒株与2010年安徽地区分离到的JQ409498以及2011至2012年重庆地区分离到的KM048040、KM048017、KM048024、KM048014病毒株位于同一簇。提示重庆地区CA16存在2个不同的传播链。
2014年重庆地区的CA6病毒株可分为2个独立分支,其中CA6-453与2013年深圳的KC866957病毒株及2011至2012年重庆的KM048082、KM048062、KM048046分离株位于同一分支,而其余CA6病毒株与2013年上海的KF647879和2012至2013年重庆的KM048063、KM048072病毒株处于同一分支,提示2014年重庆地区CA6存在2个不同的传播链。本文CA6病毒株与近年来日本、西班牙、中国台湾等地的CA6分离株同源性强,提示其来源于共同的原始株。本研究4株CA10分离株与深圳、河南、河北、云南等地的病毒株同源性强,提示重庆地区的CA10可能来源于国内同期的流行株。
手足口病的病原构成上,其他肠道病毒及混合感染比例增高,故应开始重视对其监控,并对手足口病病原谱行进一步分型以明确其具体流行亚型。另外,随着病原谱结构改变,手足口病发病高峰也出现后移现象,这之间是否存在内在关联,还有待进一步研究。
[1]Wong SS, Yip CC, Lau SK, et al. Human enterovirus 71 and hand, foot and mouth disease . Epidemiology and infection, 2010, 138(08): 1071-1089
[2]中华人民共和国国家卫生和计划生育委员会(http://www.nhfpc.gov.cn/)
[3]Hyeon JY, Hwang S, Kim H, et al. Accuracy of Diagnostic Methods and Surveillance Sensitivity for Human Enterovirus, South Korea, 1999-2011. Emerg in fect dis, 2013, 19(8): 1268-1275
[4]Blomqvist S, Klemola P, Kaijalainen S, et al. Co-circulation of coxsackieviruses A6 and A10 in hand, foot and mouth disease outbreak in Finland. J of Virol, 2010, 48(1): 49-54
[5]Mirand A, Henquell C, Archimbaud C, et al. Outbreak of hand, foot and mouth disease/herpangina associated with coxsackievirus A6 and A10 infections in 2010, France: a large citywide, prospective observational study. Clin Microbiol and Infect, 2012, 18(5): E110-E118
[6]Yamashita T, Ito M, Taniguchi A, et al. Prevalence of coxsackievirus A5, A6, and A10 in patients with herpangina in Aichi Prefecture, 2005. Jpn J Infect Dis, 2005, 58(6): 390-391
[7]Bracho MA, González-CF, Valero A, et al. Enterovirus co-infections and onychomadesis after hand, foot, and mouth disease, Spain, 2008. Emerg Infect Dis, 2011, 17(12): 2223-2231
[8]Wu Y, Yeo A, Phoon MC, et al. The largest outbreak of hand; foot and mouth disease in Singapore in 2008: the role of enterovirus 71 and coxsackievirus A strains. Int J Infecti Dis, 2010, 14(12): e1076-e1081
[9]Gopalkrishna V, Patil PR, Patil GP, et al. Circulation of multiple enterovirus serotypes causing hand, foot and mouth disease in India. J Med Microbiol, 2012, 61(3): 420-425
[10]赖芳芳. 2010-2013年重庆地区手足口病流行病学与住院病例病原学特征分析. 重庆:重庆医科大学,2014
[11]Ministry of Health of the People′s Republic of China(卫生部). National guidelines for control and prevention for HFMD (2010).Int J Respir(国际呼吸杂志), 2010, 30(24): 1473-1475
[12]Wang Y, Sun L, Xiao W, et al. Epidemiology and clinical characteristics of hand foot, and mouth disease in a Shenzhen sentinel hospital from 2009 to 2011. BMC infect dis, 2013, 13(1): 539
[13]Huang X, Wei H, Wu S, et al. Epidemiological and Etiological Characteristics of Hand, Foot, and Mouth Disease in Henan, China, 2008-2013. Sci Rep, 2015, 5
[14]Zou X, Zhang X, Wang B, et al. Etiologic and epidemiologic analysis of hand, foot, and mouth disease in Guangzhou city: a review of 4,753 cases . Braz J Infect Dis, 2012, 16(5): 457-465
[15]Lu J, Zeng H, Zheng H, et al. Hand, foot and mouth disease in Guangdong, China, in 2013: new trends in the continuing epidemic. Clin Microbiol and Infect, 2014, 20(7): O442-O445
[16]He YQ, Chen L, Xu WB, et al. Emergence, circulation, and spatiotemporal phylogenetic analysis of coxsackievirus a6-and coxsackievirus a10-associated hand, foot, and mouth disease infections from 2008 to 2012 in Shenzhen, China. J Clin Microbiol, 2013, 51(11): 3560-3566
[17]Zhang C, Zhu R, Yang Y, et al. Phylogenetic analysis of the major causative agents of hand, foot and mouth disease in Suzhou city, Jiangsu province, China, in 2012-2013. Emerg Microbes Infect, 2015, 4(2): e12
[18]Yip CC, Lau SK, Zhou B, et al. Emergence of enterovirus 71 "double-recombinant" strains belonging to a novel genotype D originating from southern China: first evidence for combination of intratypic and intertypic recombination events in EV71. Arch of virol, 2010, 155(9): 1413-1424
[19]Feng H, Duan G, Zhang R, et al. Time series analysis of hand-foot-mouth disease hospitalization in Zhengzhou: establishment of forecasting models using climate variables as predictors. PloS One, 2014, 9(1): e87916
[20]Zhang Y, Xu WB. Molecular epidemiology of enteroviruses associated with hand, foot, and mouth disease in the Mainland of China.Biomed Environ Sci, 2013, 26(11): 875-876
[21]Chen X, Tan X, Li J, et al. Molecular Epidemiology of CoxsackievirusA16: Intratype and Prevalent Intertype Recombination Identified. Plos One, 2013, 8(12): e82861
(本文编辑:李卫国,张崇凡)
Single-centre molecular epidemiology analysis of hand, foot, and mouth disease of inpatients in Chongqing
WANGQiong-xiao,XUHong-mei
(DepartmentofInfectiousDiseases,Children'sHospitalofChongqingMedicalUniversity,MinistryofEducationKeyLaboratoryofChildDevelopmentandDisorders,KeyLaboratoryofPediatricsinChongqing,ChongqingInternationalScienceandTechnologyCooperationCenterforChildDevelopmentandDisorders,Chongqing400014,China)
XU Hong-mei,E-mail:xuhongm0095@sina.com
ObjectiveTo analyze the epidemiological and biological characteristics of hand-foot-mouth disease (HFMD) in Chongqing in 2014.MethodsA descriptive analysis of HFMD outpatients reported by infectious cards and HFMD inpatients from Children's Hospital of Chongqing Medical University was conducted to describe its epidemiological characteristics in 2014. Stool samples collected from HFMD inpatients were sequenced after RT-PCR to detect and analyze the phylogenetic trees. ResultsA total of 19 207 HFMD cases were recruited into the study with the ratio of male to female of 1.5∶1 and with the median age of 2.1 years ranging from 1 d to 17 years old. The majority of the cases (97.9%) lived scatteredly and were preschool aged. The cases younger than 5 years accounted for 94.2%. There were two distinct peaks of HFMD in the whole year with the first peak from April to July and the second peak from September to December, accounting for 36.9% and 52.8%, respectively. Totally 364 HFMD inpatients with the positive pathogenic detection were enrolled into the pathogenic and molecular epidemiological analysis. Of them, 239 cases were severe with EV71 infection accounting for 64.4%, including 195 cases (53.6%) with only EV71 infection, 18 cases (4.9%) with only CA16 infection, 23 cases (6.3%) with only CA6 infection, 6 cases (1.6%) with only CA10 infection, 45 cases (12.4%) with mixed infection and 77 cases (21.1%) with other enteric viruses infection. There was high detection rate of EV71 from January to June and high detection rate of CA6 from September to December. Mixed infection with EV71 and CA6 accounted for 9.3%. Viral sequence analysis showed that EV71 isolated from Chongqing district in 2014 belonged to C4a subtype and CA16 belonged to B1b subtype. CA6 had high homology with the strains isolated from the patients in Japan and Spain, and CA10 had high homology with the strains isolated from the patients in China.ConclusionThere were two distinct peaks of HFMD in the whole year in Chongqing in 2014. The majority of cases were sporadic kindergarten children. The epidemic strains were EV71 C4a and CA16 B1b subtypes.
Hand-foot-mouth disease; Epidemiology; Etiological characteristics; Enterovirus 71; Coxsackievirus
“十二五” 国家科技重大专项:2012ZX10004212-003
重庆医科大学附属儿童医院感染科,儿童发育疾病研究教育部重点实验室,儿科学重庆市重点实验室,重庆市儿童发育重大疾病诊治与预防国际科技合作基地 重庆,410014
许红梅,E-mail:xuhongm0095@sina.com
10.3969/j.issn.1673-5501.2015.04.007
2015-06-11
2015-07-10)
