扶正散结汤拆方配伍中药抑制Lewis肺癌生长和对肿瘤细胞周期的影响
2015-03-26窦永起陈慧彬陈超
窦永起 陈慧彬 陈超
细胞周期调控异常与肿瘤的发生和发展的关系密切,中医药在治疗肺癌的过程中显著提高了治疗的有效率和患者的临床获益率、疾病稳定率,显著延长肿瘤进展时间[1]。自拟扶正散结汤是临床经验方,经多年临床实践证明,在稳定肺癌病灶、延缓肿瘤复发转移及延长患者生存期等方面均有一定疗效。为探讨其作用机制,本研究采用小鼠lewis肺癌移植瘤模型,观察其拆方配伍中药对肿瘤生长、组织病理、细胞周期和凋亡的影响。
1 材料和方法
1.1 实验动物
SPF级C57BL/6小鼠90只,雄性6~8周龄,体质重18~22 g,初进动物时间:2013年7月26日,由中国人民解放军军事医学科学院实验动物中心提供,动物合格证号:SCXK(军)2012-0004。其中10只用于移植瘤细胞传代,70只建立小鼠皮下移植瘤动物模型,另外10只小鼠作为空白组,用于一般情况观察、对比及排除小鼠非正常死亡情况。
1.2 瘤株
Lewis Lung Cancer瘤株由军事医学科学院六所馈赠。
1.3 试剂及仪器
顺氯氨铂,齐鲁制药公司生产(批号:2030111DB),核糖核酸酶(RNase A)(批号:SLBD3952V)由Sigma公司生产;流式细胞仪(Cytomics FC 500,Beckman Coulter)。
1.4 分组及小鼠Lewis肺癌移植瘤模型制备
SPF级C57BL/6小鼠90只,其中10只用于移植瘤细胞传代,其余80只随机分为:空白组、模型组、顺氯氨铂组、益气扶正组(简称扶正组)、化痰散结组(简称化痰组)、活血化瘀组(简称活血组)、清热解毒组(简称解毒组)、中药联合组(简称联用组),每组10只。按照文献方法制备小鼠Lewis移植瘤模型[2]。复苏Lewis肺癌瘤株,在无菌条件下接种于2只C57BL/6小鼠右腋窝皮下,10天后按无菌操作程序,脱颈处死小鼠,取生长良好肿瘤组织,用生理盐水洗净剪碎后加生理盐水用匀浆器研磨,台盼蓝染色计算活细胞数>95%,调整肿瘤细胞悬液浓度为1×107/mL瘤细胞继续皮下接种4只小鼠,每只接种0.l mL,如此传代3次。除空白组外,其余组小鼠按同样方法接种传代完成后的肺癌移植瘤细胞。
1.5 药品及制备
将扶正散结汤按配伍拆分为益气扶正(简称扶正,由生黄芪25 g、女贞子15 g组成),化痰散结(简称化痰,由半夏15 g、天南星10 g组成),活血化瘀(简称活血,由莪术15 g、郁金15 g组成),清热解毒(简称解毒,由白花蛇舌草15 g、半枝莲15 g组成),四法联用(简称联用,由生黄芪25 g、女贞子15 g、半夏 15 g、天南星 10 g、莪术 15 g、郁金15 g、白花蛇舌草15 g、半枝莲15 g组成)5个组分,以上药物均由解放军总医院中药房提供,经鉴定后,传统方法水煎、过滤、60℃浓缩,参照文献[3]计算各中药组给药量,分别配制成含生药浓度为0.8 g/mL、0.4 g/mL、0.6 g/mL、0.6 g/mL、2.45 g/mL 的药液,置4℃保存备用。
1.6 给药
于接种后的第2天开始,各中药组分别给予相应中药煎剂0.2 mL/d,空白组、模型组、顺氯氨铂组给予等体积的蒸馏水,连续灌胃14天;顺氯氨铂组在接种的第2天开始予以腹腔注射顺氯氨铂2 mg/(kg·d),1次/2天,共7次,其余各组同时腹腔注射生理盐水10 mL/kg。
1.7 观察项目
一般情况观察:每日观察各组小鼠体态、毛色、进食、活动等情况。
抑瘤率:于给药后第14天脱颈处死小鼠,剥取瘤块,天平称重,计算抑瘤率:抑瘤率=(1-实验组平均瘤重/模型组平均瘤重)×100%
病理HE染色:取各组移植瘤用10%甲醛固定,常规石蜡包埋,应用组织切片苏木素—伊红染色法,光镜下观察。观察肿瘤细胞的分布、生长状态、核固缩、核碎裂和坏死,以及瘤组织内微血管分布情况。
流式细胞术检测瘤组织细胞周期:将小鼠瘤体剥离称重后,每组取小块瘤组织,并分别浸泡在含有PBS的平皿中,用眼科剪将瘤组织剪碎、匀浆,制成瘤细胞悬液,100目不锈钢网过滤,PBS洗2次,每次1000 r/min离心5分钟,75%乙醇固定,置于4℃冰箱内过夜。次日离心,PBS洗1次调整细胞浓度为1×107/mL后离心,小心弃上清液,用含有终浓度为1 mg/mL RNaseA酶加100μL后混匀,之后加PI染液0.4 mL避光染色30分钟,上流式细胞仪检测细胞周期及凋亡率的变化[4],结果以细胞周期各时相细胞百分比表示。
1.8 统计学方法
采用SPSS 13.0统计软件进行统计学处理。瘤重数据符合正态性检验及方差齐情况,以均数±标准差±s)表示,采用单因素方差分析;抑瘤率数据符合正态性检验但方差不齐,采用Kruskal-Wallis法秩和检验,平均等级间的两两比较;细胞周期及凋亡率数据均采用单因素方差分析,以均数±标准差±s)表示,两组之间采用均数两两比较(Dunnett法)。以P<0.05为差异有统计学意义。
2 结果
2.1 各组Lewis肺癌小鼠一般情况观察
接种后第六天,小鼠右前肢腋下可触及黄豆大小瘤块,造模后第7天,小鼠瘤体生长明显加快。与空白组相比,造模后小鼠逐渐出现反应迟钝、动作迟缓、毛发无光泽,模型组小鼠出现拱背、喜静、蜷缩抱团的现象,顺氯氨铂组小鼠出现体温降低、体重增长缓慢,各中药组大部分小鼠行动较灵活,精神状态一般,饮食尚可,体重增长较模型组及顺氯氨铂组快。除空白组和顺氯氨铂组外,其余组小鼠出现少量死亡,多由于肿瘤增长较快压迫肺组织导致呼吸困难,以及后期出现消瘦、不进食饮水等肿瘤恶病质现象,个别小鼠因皮下肿瘤溃烂出血后,被同笼小鼠撕咬所致。
2.2 扶正散结拆方对Lewis肺癌移植瘤的瘤重及抑瘤率的影响
尽管各组有死亡,但其生存率各组无统计学差异。各组瘤重经单因素方差分析比较,差异有统计学意义(F=10.98,P<0.05)。两两比较经Dunnett法,与模型相比,其余各组瘤重均显著降低,各中药组以联用组抑瘤作用最为明显,其次为扶正组和解毒组;各中药组瘤重及抑瘤率独立比较差异也具有统计学意义(P<0.05),其中联用组抑瘤率最高,为63.63%,化痰组和活血组与联用组相比,差异具有统计学意义(P<0.05)。见表1。
表1 扶正散结汤拆方各组对小鼠Lewis肺癌的抑制作用±s)

表1 扶正散结汤拆方各组对小鼠Lewis肺癌的抑制作用±s)
注:与模型组比较,a P<0.05,b P<0.01;与顺氯氨铂组比较c P<0.05,d P <0.01;与联合组比较,e P <0.05,f P <0.01。
组别 瘤重(g) 抑瘤率(%)空白组(n=10) — —63.63模型组(n=9) 3.10±0.76 —顺氯氨铂组(n=10) 0.92±0.34b 70.39扶正组(n=8) 1.16±0.48b 62.45化痰组(n=9) 2.06±0.51adf 33.43df活血组(n=9) 1.99±1.07adf 35.88de解毒组(n=8) 1.67±0.77bd 46.15c联用组(n=9) 1.13±0.62b
2.3 扶正散结拆方对肿瘤组织病理学变化的影响
光镜下观察,肿瘤细胞形态多样,核不对称分裂明显。模型组肿瘤组织中细胞生长旺盛,数量丰富排列紧密,形状不规则,呈片状分布,肿瘤实质和间质分界不清,病理性核分裂相多见,细胞坏死较少;顺氯氨铂组及各中药组细胞数目较模型组稀疏,呈散在、条索状分布,均可见不同程度的片状坏死区及核固缩、核破碎溶解的现象。见图1。
2.4 扶正散结拆方对Lewis肺癌移植瘤细胞周期及凋亡率的影响
细胞周期及凋亡率的比较采用单因素方差分析。G0/G1期比例各组间差异有统计学意义(F=14.13,P <0.05),两两比较经 Dunnett法,各治疗组均较模型组增高;凋亡率各组间差异有统计学意义(F=19.41,P <0.01),两两比较经 Dunnett法,各治疗组均较模型组显著增加。除扶正组及活血组外,其余各组肿瘤细胞在G2/M期的比例明显减少(P<0.05);化痰组及解毒组在G0/G1期比例高于顺氯氨铂组及联用组,其余拆方组尽管未显示显著性差异,但趋势清晰;扶正散结各拆方组凋亡率独立比较具有统计学差异(P<0.01),以联用组凋亡率最高,其次为解毒组、化痰组、活血组、扶正组。见表2。
3 讨论
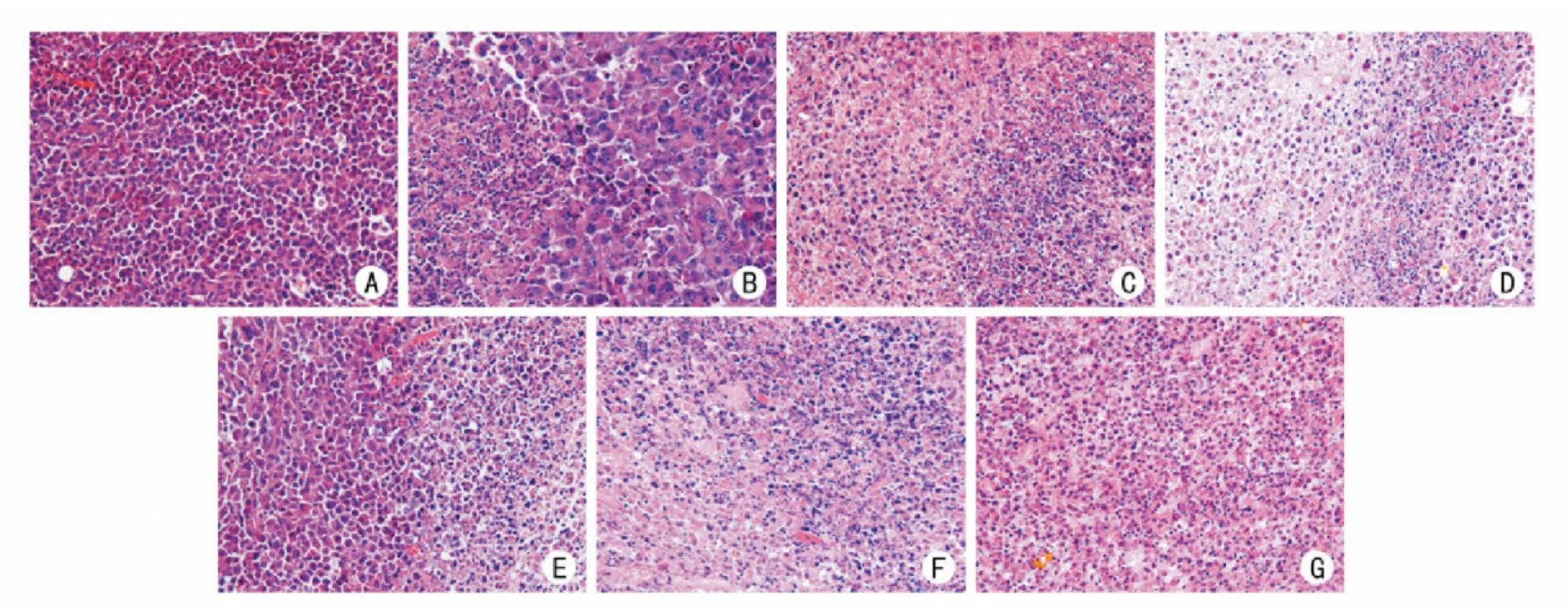
图1 扶正散结拆方各组对肿瘤组织学的影响(HE,×400)
表2 扶正散结汤拆方各组对小鼠Lewis肺癌细胞周期的影响 ± s,%)

表2 扶正散结汤拆方各组对小鼠Lewis肺癌细胞周期的影响 ± s,%)
注:与模型组比较,a P <0.05,b P <0.01;与顺氯氨铂组比较c P <0.05,d P<0.01;与联合组比较,e P <0.05,f P <0.01。
凋亡率模型组(n=9) 22.05±6.19 11.86±4.92 66.08±10.44 9.40±1.87组别 G0/G1 S G2/M顺氯氨铂组(n=10) 39.37±2.97b 26.71±4.96a 33.92±7.21b 20.03±1.72b扶正组(n=8) 32.47±4.26a 13.49±2.85c 54.04±5.61d 13.63±0.89bdf化痰组(n=9) 50.44±2.07bce 5.45±3.28de 44.11±3.68b 17.89±0.39b活血组(n=9) 31.82±7.19a 8.95±8.54d 59.23±4.84de 14.10±2.86bdf解毒组(n=8) 51.48±6.06bce 7.86±4.79d 40.66±2.38b 19.06±0.92b联用组(n=9) 37.32±2.45b 19.22±2.14 43.46±3.18b 19.57±0.76bd
研究表明,细胞周期调控紊乱是细胞增殖失控从而导致癌变的重要原因[5]。细胞周期不同时相(G1、S、G2、M)与细胞周期的关键调控点密切相关,由于细胞的周期长短主要决定于G1期时间长短,所以最重要的调控点是G1/S调控点,细胞在该点分析细胞内、外的各种复杂信号以及DNA损伤情况,将信号传递、整合、汇集到细胞核,以决定细胞周期的长短、细胞处于静止的G0期或诱发其凋亡。因此,影响和调控肿瘤的细胞周期在肿瘤的治疗中具有重要意义。
对肿瘤细胞周期影响的观察结果表明,拆方各组均可作用于细胞周期中的G1/S调控点,使肿瘤细胞停滞于G0~G1期,而不进入S期进行DNA复制,以化痰组及解毒组作用最优;但在抑制荷瘤小鼠的肿瘤细胞生长及促进凋亡方面,联合组效果最佳,说明联合应用可以发挥其它组分,如扶正及活血组分,促进肿瘤细胞坏死、诱导肿瘤细胞凋亡及其它机制如增强机体免疫力、抑制肿瘤血管生成等方面的作用,这体现了中药复方配伍的重要价值,也提示运用现代分子生物学等新技术,对中药复方配伍的作用靶点及途径进行深入研究,对于提高中医药抗肿瘤的理论认识,及提高临床配伍运用的合理性和有效性,具有非常重要的价值。
[1] 刘硕.中医药参与治疗晚期(ⅢB、Ⅳ期)NSCLC回顾性临床研究[D].北京:中国中医科学院,2009.
[2] 钟婷.黄茂扶正汤抗肿瘤与免疫调节作用的初步研究[D].长沙:中南大学湘雅医院,2010.
[3] 陈奇.中药药理研究方法学[M].北京:人民卫生出版社,2011:1262.
[4] 娄金丽,邱全瑛,何秀娟,等.威麦宁对小鼠Lewis肺癌细胞周期的影响[J].北京中医药大学学报,2004,(2):41-44.
[5] Marx J.How cells Cycle Toward Cancer[J].Science,1994,(263):319-321.
