乳酸水平及早期乳酸清除率在评估脓毒症预后中的应用价值分析*
2015-04-19利君张智明刘伟剑黄飞平
利君 张智明 刘伟剑 黄飞平
脓毒症指的是受到感染因素影响,导致的全身炎症反应综合征。如患者伴有组织灌注不良、器官功能障碍或者低血压等情况,则被称作严重脓毒症,具有高发病率、高死亡率以及医疗费用高的特点,已逐渐成为目前临床医学领域中的研究难点和热点。严重脓毒症和感染性休克为导致危重疾病患者死亡的重要原因,其主要特征为由于高心排出量和低外周血管阻力导致出现组织灌注不足。血乳酸能够将组织缺氧、灌注不足情况准确反映出来,近年来,其在判断疾病程度和预后方面发挥着十分重要的作用[1]。且有研究表明,对乳酸进行连续监测,特别是对乳酸清除率进行监测,能够更好的对疾病预后进行评估[2]。笔者对乳酸水平及早期乳酸清除率在评估脓毒症预后中的应用价值进行探讨,现报告如下。
1 资料与方法
1.1 一般资料 选取本院2010年5月-2013年5月收治的62例脓毒症患者作为研究对象,其中,男34例,女28例,年龄16~82岁,平均(57.2±15.4)岁;感染来源:24例肺部,14例腹腔,10例皮肤软组织,8例血源性,4例盆腔,2例颅脑,所有患者均有明确感染证据。根据存亡情况将其分为生存组43例和死亡组19例,比较两组患者的血乳酸与乳酸清除率水平;将6 h乳酸清除率10%作为界限,一组为≥10%,另一组为<10%,对比两组患者的死亡率和APACHEⅡ评分。
1.2 诊断和排除标准 诊断标准:所有患者均符合美国胸科医师学会和危重医学学会共识会议的诊断标准,严重脓毒症患者主要伴有组织灌注不良、器官功能障碍、低血压等,还包括少尿、器官功能障碍、急性意识状态改变等[3]。排除标准:口服高剂量硝普钠降压、二甲双胍的患者;恶性肿瘤晚期、住ICU期间伴有癫痫发作的患者;伴有严重肝肾功能损害的患者,血清肌酐(SCr)超过500 μmol/L,总胆红素(TBil)超过240 μmol/L;住ICU时间少于24 h的患者;受到人为因素或者仪器误差导致出现乳酸升高的患者。
1.3 方法 抽取患者入院24 h内的生理参数与生化指标最差值,对APACHEⅡ进行计算。患者入院后,根据国际脓毒症治疗指南,对患者早期给予抗生素、液体复苏、控制感染源、营养支持以及血管活性药物等治疗。在入院时、入院后6 h,采集患者的动脉血,使用罗氏Cobas b 221血气分析仪对血乳酸水平进行检测;6 h乳酸清除率=(患者入院时动脉血乳酸水平-患者入院6 h后的动脉血乳酸水平)/入院时患者的动脉血乳酸水平×100%。
1.4 统计学处理 使用SPSS 17.0软件进行数据的统计与分析,计量资料采用t检验,计数资料采用 字2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的血乳酸水平与乳酸清除率比较 死亡组患者入院时和入院后6 h的血乳酸水平明显高于生存组,6 h乳酸清除率明显低于生存组,两组比较差异均有统计学意义(P<0.05),见表 1。
表1 两组患者的血乳酸水平与乳酸清除率比较(±s)
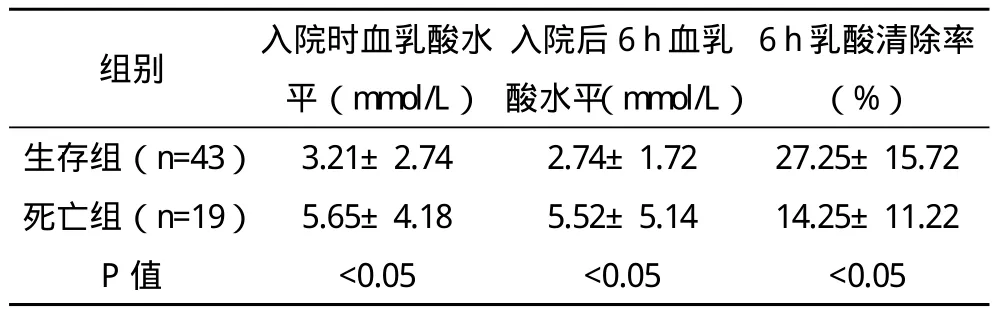
表1 两组患者的血乳酸水平与乳酸清除率比较(±s)
6 h乳酸清除率(%)生存组(n=43)3.21±2.74 2.74±1.72 27.25±15.72死亡组(n=19)5.65±4.18 5.52±5.14 14.25±11.22 P值 <0.05 <0.05 <0.05组别 入院时血乳酸水平(mmol/L)入院后6 h血乳酸水平(mmol/L)
2.2 两组患者的APACHEⅡ评分比较 生存组APACHEⅡ评分为(20.11±3.61)分,死亡组APACHEⅡ评分为(205.04±4.56)分,高乳酸清除率组患者的APACHEⅡ评分较低乳酸清除率组患者的APACHEⅡ评分低,两组比较差异有统计学意义(P<0.05)。
2.3 乳酸水平、乳酸清除率和APACHEⅡ的相关性分析 严重脓毒症患者的血乳酸水平和APACHEⅡ之间为正相关(r=0.382,P<0.01);6 h乳酸清除率和APACHEⅡ之间为负相关(r=-0.457,P<0.01)。
2.4 不同乳酸清除率患者的死亡率比较 62例患者住院过程中,共有48例患者的6 h乳酸清除率≥10%,经治疗后,7例患者死亡,死亡率为14.5%;14例患者的6 h乳酸清除率<10%,经治疗后,12例患者死亡,死亡率为85.7%;6 h乳酸清除率<10%患者的死亡率明显高于6 h乳酸清除率≥10%的患者,两组比较差异有统计学意义(P<0.01)。
3 讨论
乳酸为体内葡萄糖代谢的一种产物,正常情况下,产量较少,但在危重患者处于低氧状态下,乳酸量会显著增多,严重者导致发生乳酸性酸中毒。如危重患者疾病能够被有效控制,低氧状态能够快速得到纠正,那么则能够显著降低体内乳酸量。血乳酸为全身灌注和氧代谢的主要指标,如血乳酸水平高,那么表明,在低灌注情况下,机体无氧代谢增加。一般情况下,人体动脉血乳酸水平低于2.0 mmol/L[4]。如组织灌注量不断减少,组织出现缺氧,糖的有氧代谢三羧酸循环受到阻碍,且糖酵解途径激活后,丙酮酸经无氧代谢后,逐渐形成乳酸,如乳酸量较多,且经组织释放到血液内,进而提高血乳酸水平。如患者肝功能正常,但血乳酸水平比较高,则表明组织缺氧情况比较严重。对危重患者来说,乳酸水平升高,主要由于休克导致。心源性、失血性休克患者,低氧、组织低氧压会增多乳酸生成;如肝脏灌注降低,那么会减少乳酸代谢量,并提高乳酸水平[5]。
严重脓毒症患者的主要临床表现为全身性感染、组织灌注不良、器官功能不全、低血压等,血乳酸升高受到多种因素影响,如微血管破坏、全身低灌注会导致出现细胞线粒体氧利用损害、局部低灌注等情况。治疗脓毒症患者的最佳时间为最初几个小时,如维持血流动力学稳定,能够有效降低器官功能不全发生率,并提高患者生存质量。因此,选择最合适的监测指标,并详细分析,对于严重脓毒症、感染性休克患者进行早期诊断、治疗以及预后是十分重要的[6]。
有研究表明,对血流动力学监测后,指标无变化,但已经存在组织低灌注和缺氧情况,血乳酸水平明显升高,那么在严重感染患者的预测方面,血乳酸水平升高具有较高的价值[7]。本组研究结果表明,死亡组患者的入院时动脉血乳酸水平和入院后6 h动脉血乳酸水平较生存组高,血乳酸水平持续升高和APACHEⅡ之间存在密切关系[8]。有研究表明,全身炎症反应综合征、脓毒症、严重脓毒症以及脓毒症休克疾病的死亡率分别为7%、16%、20%以及46%,由此表明,要准确评估脓毒症患者的严重程度,进而及早采取有效措施治疗,提高患者生存率[9]。
正常人体内的血乳酸浓度(1.0±0.5) mmol/L,如血乳酸水平>2.0 mmol/L,则表明可能有高乳酸血症,如>5.0 mmol/L,则表明易伴有代谢性酸中毒[10]。乳酸量生成过多,主要受到以下几个因素影响:(1)组织氧供不足:危重患者全身组织或者局部组织出现灌注不良的情况,则易导致出现氧供需不平衡的情况;如患者在休克状态下,会存在全身组织灌注不足、局部组织灌注低等情况;心肺功能不全的患者氧供明显降低,不能有效达到机体代谢需求,进而导致发生高乳酸血症;(2)受到隐匿性组织灌注不足因素影响:部分疾病虽然未出现组织低灌注情况,如高血压患者虽然未发生心脏损伤,但心理出现病理变化,并伴有隐匿性组织灌注不足的情况;如出现癫痫发作或者剧烈运动,受到肌肉组织强烈收缩影响,氧供不能有效满足氧耗需求量,最终导致出现缺氧、乳酸量过多的情况;(3)应激因素导致发生儿茶酚胺血症:在危重病应激状态下,会提高血儿茶酚胺浓度,后者和肌细胞膜受体结合后,能够激活细胞膜cAMP;一方面能够激活糖原磷酸化酶,将糖原进行分解,分解为6-磷酸葡萄糖;另一方面,将细胞膜上Na+-K+-ATP酶,将ATP水解成ADP,提高细胞内的NADH/NAD+比值,最终导致发生高乳酸血症;(4)受到组织中毒性缺氧因素影响:部分毒物、药物给氧化还原酶产生抑制,不能使组织充分利用氧,进而导致发生用氧障碍性缺氧情况。如硝普钠应用过量导致发生的组织中毒性缺氧,硝普钠一旦进入到人体,则会立即发生分解,每分子硝普钠释放出五分子氰化物;后者和氧化型细胞色素氧化酶内的Fe3+互相结合后,使其丧失传递电子功能,中断生物氧化过程,将丙酮酸转化为乳酸,进而导致出现高乳酸血症[11]。
血乳酸升高的最主要危险为酸中毒威胁,不是乳酸根离子,和碳酸相比,乳酸为一种较强的代谢酸,处于基础状态下,肝脏摄取转化乳酸量为1290 mmol/(L·d)。如肝所摄取的转化乳酸能力完全受到损害,那么H+会以50 mmol/L(L·h)的速度蓄积于体内,在该种速度下,体内碳酸氢易被中和[12]。如乳酸生成量较多,那么酸中毒过程会发展较快,使体内代谢发生严重紊乱。有动物实验研究表明,高乳酸血症会给蛙心房肌收缩力带来损害,降低大鼠运动耐力,降低氧化磷酸化与抑制心肌组织糖利用,可能为导致发生心律失常、心肌损伤的一个重要机制。但休克导致发生的乳酸性酸中毒,可以采取应用缓冲剂纠正酸中毒的情况,不能实质性的使临床结果发生变化。
大量研究结果表明,血乳酸水平受到危重病严重程度、预后等因素影响,如患者的血乳酸水平越高,那么患者的病情就越重,进而疾病预后质量就越差[13]。但由于患者机体状态不同,所受到的应激强度也不同,因此,如只对某一时刻的血乳酸浓度进行监测,仅仅能够对组织氧供和氧耗之间的平衡关系进行判断,不能将机体状态和疾病发展情况准确反映出来,特别是不能将治疗措施给氧耗、氧供的动态影像准确进行反映。
APACHEⅡ系统为一种具有权威性、广泛性的危重病病情评分系统。血乳酸水平和APACHEⅡ之间存在较好相关性,通过对乳酸水平和乳酸清除率进行检测,并与APACHEⅡ相结合,能够早期诊断脓毒症,并评价各个脏器功能和预后[14]。本组研究中,对血乳酸水平与6 h乳酸清除率和APACHEⅡ之间的关系进行评价,结果表明,严重脓毒症患者的血乳酸水平和APACHEⅡ之间为正相关(r=0.382,P<0.01);6 h乳酸清除率和APACHEⅡ之间为负相关(r=-0.457,P<0.01)。
此外,还有研究表明,通过对学乳酸水平变化情况进行连续性监测,特别对乳酸清除率进行检测,能够准确评估疾病预后情况[15]。如早期乳酸清除率降低,那么表明预后不良[16]。6 h乳酸清除率≥10%为最合适的阈值指标,本组研究结果表明,6 h乳酸清除率<10%患者的死亡率为85.7%,明显高于6h乳酸清除率≥10%的患者的14.5%。
但要注意,如患者乳酸水平轻度升高,那么早期乳酸清除率并不能准确确定患者预后,高清除率患者生存率无显著变化,可能受到以下因素影响:(1)患者血乳酸量产生过多,导致有氧糖酵解,进而不能使乳酸清除率将组织器官灌注水平变化情况真实反映出来;(2)患者血乳酸含量多,易在低副升高水平发生波动,且在受到患者基础病、药物等因素影响后,乳酸聚积,短期内能够在肝肾内代谢清除,进而会提高清除率。对此,可通过采取液体复苏、改善脏器功能以及控制血糖等措施,最终提高患者预后质量[17-18]。
综上所述,乳酸水平和早期乳酸清除率对脓毒症患者预后的评估效果较好。
[1]罗琼湘,李焕夷,利君.脓毒症早期检测血乳酸清除率的临床意义[J].岭南急诊医学杂志,2014,19(4):271-273.
[2]胡碧江,陈建南,陈文腾,等.动脉血乳酸及早期乳酸清除率在老年脓毒症治疗中预后判断的应用[J].中国老年学杂志,2013,33(10):2280-2282.
[3]李晓晶,陈旭岩.血乳酸水平和SOFA评分对急诊严重脓毒症患者的评估作用[J].中国急救医学,2013,33(3):196-199.
[4]安莹波.早期动脉血乳酸水平和乳酸清除率对评估严重脓毒症患者预后的临床价值[J].微循环学杂志,2013,23(3):50-51.
[5]李少洪,卜会驹,钟坚,等.联合乳酸、降钙素原和D-二聚体评估脓毒症患者预后的临床研究[J].临床和实验医学杂志,2013,12(12):940-942.
[6]高菲,柴艳芬.脓毒症患者降钙素原及动脉乳酸与碱剩余变化的临床意义[J].临床荟萃,2013,28(2):151-154.
[7]李晶菁,陈瑜.乳酸水平及早期乳酸清除率对严重脓毒症预后的评估[J].交通医学,2013,27(6):648-649.
[8]乐健伟,朱建华.早期乳酸清除率评估术后脓毒症休克患者预后的临床价值[J].浙江医学,2012,34(2):140-141.
[9]陈芳,寿松涛.动态监测动脉血乳酸水平对脓毒症患者危险分层的临床意义分析[J].中国全科医学,2012,15(5):580-583.
[10]徐勋宏.早期乳酸清除率对重症感染患者预后的评估研究[J].中国呼吸与危重监护杂志,2012,11(6):596-598.
[11]缪红军,葛许华,张琴,等.乳酸和早期乳酸清除率预测严重脓毒症患儿预后的临床价值[J].实用儿科临床杂志,2012,27(18):1406-1407.
[12]崔广清,冒秀宏,孙卫和.动脉乳酸清除率对严重脓毒症患者预后的评估[J].徐州医学院学报,2011,31(12):806-808.
[13]柴艳芬,寿松涛,贾洁.脓毒症患者静脉血乳酸清除率的预后价值[J].天津医科大学学报,2011,17(2):293-293.
[14]张翊,石磊,曾燕彩等.监测乳酸清除率对早期脓毒性休克患儿的临床意义[J].岭南急诊医学杂志,2011,16(4):277-278.
[15]成怡冰,金志鹏,王群思.早期血乳酸清除率对严重脓毒症与脓毒性休克患儿的预后评估[J].中国实用医刊,2010,37(20):21-22.
[16]徐向东,吴健锋,管向东,等.早期乳酸清除率评估外科严重脓毒症预后的临床价值研究[J].中国实用外科杂志,2007,27(12):969-970.
[17]高伟波,朱继红.乳酸性酸中毒与危重症[J].疑难病杂志,2011,10(2):161-166.
[18]俞娅芬,陈德昌,宋秀琴.早期诊断严重脓毒症脓毒性休克研究进展[J].中国急救医学,2007,27(2):154-156.
