几种单头螨线粒体基因组提取方法的比较*
2015-04-19湛孝东李朝品席贻龙
湛孝东 李朝品 席贻龙
螨类是一种体型微小的节肢动物,在分类上属于蛛形纲(Arachnida)、蜱螨亚纲(Acari)的寄螨目(Parasitiformes)和真螨目(Acariformes)[1]。螨体大小一般都在0.5 mm左右,有些小到0.1 mm,大多数种类小于1 mm。其种类和分布都及其广泛,现在研究较多的是农业螨类和医学螨类,前者如叶螨,后者如尘螨等[2]。尘螨的分泌物和死亡螨体的崩解物是一种重要的过敏原,可引起过敏性皮炎、过敏性哮喘等疾病[3-5]。因目前大多数螨类都存在抗药性的问题,所以药物防制较为困难,目前在螨类的防制上遗传防制是目前研究的热点[6-7]。而研究螨类的分子进化时常需要提取单头螨类的线粒体基因组,因螨类个体微小,单头螨DNA的提取极其困难[8],笔者比较了文献介绍的几种常用的提取方法,用PCR扩增单头螨的线粒体COⅠ基因,结果报道如下。
1 材料与方法
1.1 材料与试剂 Chelex-100 (Sigma,C7901)、平衡酚(pH 6.7~7.8)、氯仿 -异戊醇(24∶1)、无水乙醇、醋酸钠、1×TE液缓冲液、蛋白酶K(>600 U/mL,Thermo)、匀浆缓冲液、研磨缓冲液(STE)、10×Buffer(Mg2+Free)、MgCl2(25 mmol/L)、dNTP Mixture(20 mmol/mL)、Taq 酶(5 U/μL)、DNA marker均购自上海生工。COⅠ引物(正向:5’-GTTTTGGGATATCTCTCATAC-3’, 反 向:5’-GAGCAACAACATAATAAGTATC-3’)由上海生工合成。
1.2 主要仪器 PCR仪(ABI2720)、高速冷冻离心机(Beckman)、水平电泳仪(Bio-Rad)、凝胶电泳成像分析系统(SYNGENE)。
1.3 总DNA提取方法
1.3.1 Chelex-100抽提法 取活螨体(腐食酪螨Tyrophagus putrescentiae)用灭菌双蒸水清洗净后置于洁净滤纸上干燥,然后用灭菌针挑取单头螨置于含有0.5 mL 双蒸水的1.5 mL离心管中,用灭菌研磨棒充分研磨后加双蒸水0.5 mL,旋涡混匀,置-20 ℃冰箱冷冻10 min,12 000 r/min离心5 min,弃上清。重复洗涤2~3次;沉淀中加入150 μL预先悬浮好的5%的Chelex-100溶液。56 ℃水浴2 h,旋涡混匀10 s。置100 ℃加热10 min,取出后漩涡混匀10 s,10 000 r/min离心5 min,上清液即可作为PCR反应的模板[9]。
1.3.2 酚氯仿抽提法 取单头螨体样本放入含0.6 mL匀浆缓冲液的1.5 mL离心管中,用玻璃研磨棒充分研磨。37 ℃水浴1~3 h,直至匀浆缓冲液变清澈为止。在匀浆缓冲液中加入相同体积的平衡酚,缓慢上下颠倒10次,然后6000 r/min离心10 min,保留上清液。重复上述步骤直到酚相与水相的界面处白色蛋白质层消失,保留上清液,再加入等体积的氯仿:异戊醇溶液,缓慢上下颠倒10次,再8000 r/min离心10 min,保留上清液,再加入2×体积的-20 ℃无水乙醇沉淀DNA。4 ℃冰箱内放置10 min后,12 000 r/min离心10 min,弃上清液。在沉淀中加入1 mL 70%的冷乙醇洗涤DNA,10 000 r/min离心5 min,弃上清。自然干燥后加灭菌双蒸水溶解作为PCR反应的模板[10]。
1.3.3 蛋白酶K法 取单头螨体样品放入0.2 mL离心管中,加入30 μL的STE研磨缓冲液,用烧溶后的枪头将螨体充分研磨后,用30 μL STE研磨缓冲液清洗枪头,加入蛋白酶K(200 μg/mL),研磨液56 ℃消化1~2 h,消化后的产物95 ℃ 保温45 s,2000~3000 r/min离心30 s,上清液作为做PCR反应的模板[11]。
1.4 PCR反 应 PCR反 应 体 系(27 μL):10×Buffer(Mg2+Free) 2.5 μL,mg2+2.0 μL,dNTP Mixture 0.2 μL,正反引物(10 pmo1)各0.5 μL,Taq酶0.5 μL,加双蒸水至27 μL。PCR扩增条件如下:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 30 s,运行35 个循环。72 ℃后延伸10 min。
1.5 PCR反应产物检测 每个样本取5 μL PCR产物进行1.0%琼脂糖凝胶电泳(90 V,40 min),结果用凝胶电泳成像分析系统拍照。
2 结果
COⅠ基因PCR扩增产物经琼脂糖凝胶电泳检测结果显示:酚氯仿法未能从单头螨中提取到有效DNA,而蛋白酶K法和Chelex-100法则获得电泳条带(图1),分子量约为380 bp,与文献报道结果的一致,表明成功扩增出了目标条带。说明蛋白酶K法和Chelex-100法可抽提到适于PCR反应的DNA模板量。蛋白酶K法的条带较Chelex-100法清晰明亮,说明蛋白酶K法提取效果优于Chelex-100法。但Chelex-100法可获得约150 μL的模板,而蛋白酶K法只能获得约20 μL模板。
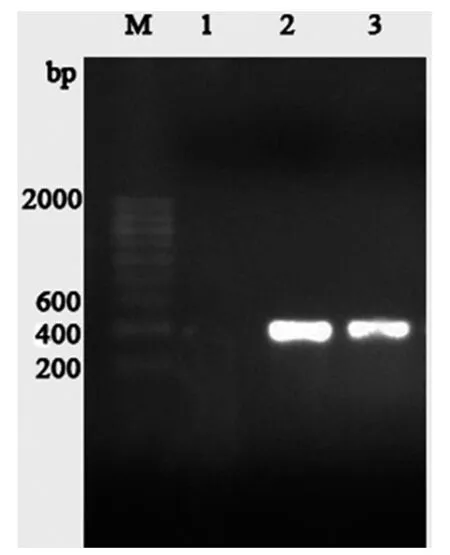
图1 不同提取方法COⅠPCR产物电泳结果M:DNA Marker;1:酚氯仿法;2:蛋白酶K法;3:Chelex-100法
3 讨论
本研究选取的腐食酪螨是我国常见的储藏物螨类之一。该螨常孳生在储藏粮食、饲料和中药材中,不仅可造成储藏物数量损失,也能导致储藏物品质下降,对人类健康和环境造成严重威胁。该螨个体小、繁殖量大、生活史周期短,分布广泛。随着储粮保护剂和熏蒸剂的大量、持续使用,耐药性和抗药水平不断提高,增加了其防制难度。因而,研究腐食酪螨的系统发育可为该螨的防制提供分子水平的依据。
线粒体是真核生物细胞中由双层高度特化的单位膜围成的细胞器,其主要功能是通过氧化磷酸化作用合成ATP,为细胞各种生理活动提供能量。线粒体的一个显著特点是具有自身的DNA和遗传体系。自20世纪60年代线粒体基因组发现以来,由于其分子量相对较小、呈母系遗传、突变率高及在细胞中拷贝多等特点[12],受到了进化生物学家们的格外青睐,被广泛用于种群遗传学、谱系地理学、分子进化、种系发生和比较及进化基因组学等多方面的研究[13],极大地加深了人们对物种进化现象、过程及机制的理解。近年来,随着技术的日趋成熟以及新一代测序技术的兴起,越来越多的后生动物的线粒体基因组的测序工作得以完成[14]。线粒体基因组不仅比单个线粒体基因包含更多的序列信息,而且具有一系列基因组水平的特征,如基因排序、RNA基因的二级结构以及复制和转录的控制模式等[15]。因此,线粒体基因组作为GenBank数据库中数量最多的“全”基因组序列,为系统发育框架下解析后生动物基因组的进化机制提供了很好的材料。
目前线粒体基因已广泛用于真螨总目螨类的系统发育研究中,常见的mtDNA 基因有rrnS,rrnL 和cox1 基因等,为理解真螨总目螨类各类群之间的系统发生关系提供新证据。例如,基于线粒体cox1 基因和核18S rDNA 基因序列对真螨总目螨类进行首次全面系统发育分析,结果表明真螨总目为一单系群,且真螨总目下分为疥螨目(Sarcoptiformes)和绒螨目(Trombidiformes),其中疥螨目由内气门亚目(Endeostigmata)和甲螨亚目(Oribatida)+无气门亚目(Astigmata)组成[15]。另一方面,仅依据单个或少数几个分子标记,以及不同的单个基因间得出的结论存在差异等均可能降低其结果的可靠性。目前,基于线粒体基因组序列进行的系统发育研究主要集中在节肢动物高级分类阶元如纲、总目、目之间[16],但有关真螨总目螨类的研究较少。Domes等[17]基于线粒体基因组13个蛋白质编码基因对已测的26种节肢动物进行系统发生关系分析,其中真螨总目涉及种类很少,仅2个亚目4个种类,即前气门亚目和甲螨亚目。因此,获得更多真螨总目螨类的线粒体基因组序列显得颇为迫切。事实上,在进行系统发育研究时,线粒体基因组序列表现的一些特征如碱基组成异质性和位点间速率变异等,很难正确构建系统发育树,导致系统偏差。因此,线粒体部分基因或全序列可作为真螨总目螨类系统发育研究中有效的分子标记。
真核生物95%的DNA存在于细胞核中,其它约5%为细胞器DNA,存在于线粒体、叶绿体DNA等中[18]。从真核生物中分离提取DNA原则是保证DNA一级结构的完整性,排除其它杂质的污染。因此,在实验过程中为了保证所分离DNA纯度和完整性,要尽量减少操作步骤,缩短提取过程,从而可以避免机械剪切力对溶液中DNA的破坏和DNAase对DNA的降解[19-20]。分离提取DNA的基本过程是将细胞破碎,从而使得DNA与蛋白质分离,然后再纯化、浓缩DNA[21-22]。提取成功与否破碎细胞这一步非常重要,此步骤直接影响到下面的提取步骤和DNA的提取质量,匀浆必须非常充分,否则抽提效率降低,甚至导致抽提失败。本实验采用灭菌的玻璃研磨棒和烧溶枪头对螨体进行捣碎、匀浆,取得了非常好的效果。
因螨类个体微小,所以单头螨的DNA提取尤其困难,实验中发现最关键的步骤是充分研磨,本研究利用购买的特殊玻璃研磨棒(适用于1.5 mL离心管)或烧溶的枪头(适用于0.2 mL离心管)可以充分贴壁研磨螨体,并在研磨后将玻棒上粘连的组织冲洗至试管中,减少的螨体的损失,保证了DNA的量。此外在抽提过程中加入冰冻环节,可增加DNA的析出率,提高了抽提效率。
Chelex-100是一种由苯乙烯和苯二乙烯组成的一种金属离子螯合剂,可高选择性地去除样品和缓冲液中的金属离子,避免煮沸过程中模板DNA的降解。被广泛应用于医学微量血痕DNA以及微生物DNA提取[23-24]。与经典的酚氯仿抽提法相比,Chelex-100法未用苯酚除蛋白质,也未用乙醇沉淀DNA,所以DNA中仍混有少许蛋白质,但PCR反应对模板纯度的要求较低,其结果是稳定可靠的,其特异性和敏感性可与酚氯仿法相媲美[25]。Chelex-100法与传统的酚氯仿抽提法比较,省去了复杂的抽提纯化过程,节省了时间。此外本法单头螨即可获得可用于PCR反应的模板量,而酚氯仿抽提法在抽提纯化过程中DNA损失量较大,无法从微量样品中得到目的DNA。再者,Chelex-100试剂无毒,而酚和氯仿对人体有一定的毒性[26]。
蛋白酶K法直接用蛋白酶K消化被充分研磨的极微量样品,从而得到适合于PCR反应的DNA模板。因所需的样品量极微小,所得的PCR产物经进一步纯化后可以达到较高的纯度,适用于RAPD、RFLP、序列测定、克隆等试验。该方法除具备Chelex-100法的优点外,成本较Chelex-100法低廉,而且提取效率高,但是所获得的模板量较Chelex-100法少。综合Chelex-100法和蛋白酶K法各自的优缺点,当需要大量模板时可使用Chelex-100法,而只需要获得少量模板可采用蛋白酶K经济、快捷。
本实验采用活体的螨类标本,而对于不同保存方法和不同保存时间的螨类标本,上述3种方法的取提效果还有待进一步的研究。
[1]李朝品,武前文.房舍和储藏物粉螨[M].合肥:中国科技大学出版社,1996:267-271.
[2]休斯 A M.贮藏食物与房舍的螨类[M].忻介六,沈兆鹏,译.北京:农业出版社,1983:194-215.
[3]黄斌,王朋朋,吴淑庄,等.血清尘螨特异性IgE检测在小儿哮喘防治中的应用研究[J].中国医学创新,2014,11(7):25-26.
[4]陈国华,刘婧,付承,等.粉尘螨滴剂治疗尘螨过敏性支气管哮喘疗效观察[J].中外医学研究,2014,12(23):105-107.
[5] Bains P,Dogra A.Skin prick test in patients with chronic allergic skin disorders[J].Indian J Dermatol,2015,60(2):159-164.
[6] Palopoli M F,Minot S,Pei D,et al.Complete mitochondrial genomes of the human follicle mites Demodex brevis and D.folliculorum:novel gene arrangement,truncated tRNA genes,and ancient divergence between species[J].BMC Genomics,2014,16(15):1124.
[7] Halász J,Kodad O,Hegedűs A.Identification of a recently active Prunus-specific non-autonomous Mutator element with considerable genome shaping force[J].Plant J,2014,79(2):220-231.
[8]吴太葆.基于形态特征和 COI 基因的粉螨重要类群系统发育研究(蜱螨亚纲:粉螨亚目)[D].南昌:南昌大学,2007.
[9]邹志文,张素卿,辛天蓉,等.一种简易的昆虫基因组DNA提取方法[J].南昌大学学报(理科版),2011,35(6):564-567.
[10]田英芳,黄刚,郑哲民,等.一种简易的昆虫基因组DNA提取方法[J].陕西师范大学学报(自然科学版),1999,27(4):82-84.
[11]温硕洋,何晓芳.一种适用于昆虫痕量DNA 模板制备的方法[J].昆虫知识,2003,40(3):276-279.
[12] Gissi C,Iannelli F,Pesole G.Evolution of the mitochondrial genome of Metazoa as exemplified by comparison of congeneric species[J].Heredity,2008,101(4):301-320.
[13] Wang I J.Recognizing the temporal distinctions between landscape genetics and phylogeography[J].Mol Ecol,2010,19(13):2605-2608.
[14] Nabholz B,Jarvis E D,Ellegren H.Obtaining mtDNA genomes from next generation transcriptome sequencing:a case study on the basal Passerida (Aves:Passeriformes) phylogeny[J].Mol Phylogenet Evol.,2010,57(1):466-470.
[15] Masta S E.Mitoehondrial rRNA secondary structures and genome arangements distinguish chelicerates:comparisons with a harvestman(Arachnida:Opiliones:Phalangium opilio)[J].Gene,2010,449(1-2):9-21.
[16] Dabert M,Witalinski W,Kazmierski A,et al.Molecular phylogeny of acariform mites (Acari,Arachnida):strong conflict between phylogenetic signal and long-branch attraction artifacts[J].Mol Phylogenet Evol,2010,56(1):222-241.
[17] Domes K,Maraun M,Scheu S,et al.The complete mitochondrial genome of the sexual oribatid mite Steganacarus magnus:genome rearrangements and loss of tRNAs[J].BMC Genomics,2008,9(32):532.
[18] Zhao Y,Cao Z,Cheng J,et al.Population identification of Sarcoptes hominis and Sarcoptes canis in China using DNA sequences[J].Parasitol Res,2015,114(3):1001-1010.
[19]安瑞生,谭声江,陈晓峰.小型昆虫DNA提取时匀浆方法的改进[J].昆虫知识,2002,39(4):311-312.
[20] Amer S,El Wahab T A,Metwaly Ael N,et al.Preliminary molecular characterizations of Sarcoptes scaibiei (Acari:Sarcoptidae) from farm animals in Egypt[J].PLoS One,2014,11:9(4):e94 705.
[21]萨姆布鲁克J,弗里奇E E,曼尼阿蒂斯T.分子克隆实验指南[M].金冬雁,黎孟枫,译.北京:科学出版社,1992:464-469.
[22] Heethoff M,Laumann M,Weigmann G,et al.Integrative taxonomy:Combining morphological,molecular and chemical data for species delineation in the parthenogenetic Trhypochthonius tectorum complex(Acari,Oribatida,Trhypochthoniidae) [J].Front Zool,2011,8(1):2.
[23]月琴,朱伟,刘志萍,等.用Chelex-100快速提取微量血痕中的DNA[J].复旦学报(医学版),2003,30(4):379-380.
[24]周双清,黄小龙,黄东益,等.Chelex-100快速提取放线菌DNA作为PCR扩增模板[J].生物技术通报,2010,15(2):123-125.
[25] Jinks D C,Minter M,Tarver D A,et al.Molecular genetic diagnosis of sickle cell disease using dried blood specimens on blotters used for new born screening[J].Human Genetics,1989,81(154):363.
[26] Philips A J,Simon C.Simple,effect,and nondestructive DNA extraction protocol for arthropods[J].Entomological Society of America,1995,88(3):281-283.
