烟草茄尼醇含量的遗传分析
2015-04-18向德虎赵韬智杜咏梅张忠锋黄文昌王爱华付秋娟宫亚楠刘艳华
向德虎,赵韬智,杜咏梅,张忠锋,闫 宁,黄文昌,王爱华,付秋娟,宫亚楠,刘艳华*
(1.中国农业科学院烟草研究所,烟草遗传改良与生物技术重点开放实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.东北农业大学生命科学院,哈尔滨 150030;4.湖北省烟草科学研究院,武汉 430030)
烟草茄尼醇含量的遗传分析
向德虎1,2,赵韬智3,杜咏梅1,张忠锋1,闫 宁1,黄文昌4,王爱华1,付秋娟1,宫亚楠1,刘艳华1*
(1.中国农业科学院烟草研究所,烟草遗传改良与生物技术重点开放实验室,青岛 266101;2.中国农业科学院研究生院,北京 100081;3.东北农业大学生命科学院,哈尔滨 150030;4.湖北省烟草科学研究院,武汉 430030)
为探索与烟叶中茄尼醇含量相关基因的遗传模式,以低茄尼醇含量烟草种质Maryland609为母本、高茄尼醇含量烟草种质K326为父本配制杂交组合,建立P1、P2、F1、F2的4个世代遗传分析群体,利用UPLC(超高效液相色谱)进行茄尼醇的定量检测,通过“主基因+多基因”混合遗传模型多世代联合分析对与茄尼醇含量相关的基因进行遗传分析。结果表明,Maryland609×K326组合的茄尼醇含量受2对等显性主基因+加性显性多基因(E6)控制,2对主基因的加性效应和显性效应值相等,均为负值,多基因的显性效应大于加性效应;主基因的遗传率分别为33.61%和53.15%,多基因遗传率分别为30.01%和13.64%,环境变异在33.21%~36.28%。因此,主基因和多基因共同决定了烟叶茄尼醇的含量,以主基因遗传为主,同时受到环境的影响。
烟草;茄尼醇;主基因+多基因;遗传效应
烟草(Nicotiana tabacum)为茄科(Solanaceae)烟属植物,起源于美洲、大洋洲及南太平洋,是一种在世界范围内广泛种植的经济作物[1-2]。烟草不仅仅是一种重要的经济作物,还因其含有茄尼醇、芸香苷、甾醇、绿原酸等有益活性成分而具有十分重要的医药价值,在食品和药物资源开发方面具有巨大的潜在用途。茄尼醇(Solanesol)是一种四倍半烯萜醇,因其是合成CoQ10和维生素K2等畅销药品的主要中间体,而具有十分重要的医药价值[3-4]。由于茄尼醇具有较长的碳链结构,目前还不能通过工业大量合成,只能依赖于植物组织中提取[5]。而烟叶中茄尼醇含量最高,使得烟叶成为提取茄尼醇的主要原料[6-7]。随着我国茄尼醇提取技术与工艺的不断突破,原材料中茄尼醇含量成为茄尼醇获得量的主要限制因素。因此,高茄尼醇含量烟叶对茄尼醇在医药中的开发和利用具有重要的应用价值。但高茄尼醇含量烟叶主流烟气焦油、一氧化碳、苯并芘等有害物质的释放量也高[8]。Schlotzhauer等[9]研究表明,烟草中茄尼醇热解对烟气稠环芳烃的贡献高达30%。所以对烟草中茄尼醇含量进行遗传分析,可为不同茄尼醇含量烟草资源的创制和利用提供最直接的实践指导。
盖钧镒[10-11]等基于传统数量遗传学提出了“主基因+多基因”混合遗传模型,可对植物的数量性状进行遗传分析,该方法目前在棉花、玉米、大豆、小麦、花生、水稻[12-17]等作物研究中被广泛应用。近年来该方法在烟草产量、品质、抗病性等方面的研究报道[18-22]也在持续增加。目前对烟草中
茄尼醇的研究主要集中在茄尼醇的提取纯化[23-25]、环境因素对烟叶茄尼醇含量的影响[26]以及茄尼醇合成途径中关键酶基因的克隆[27-28]等方面,而对与烟叶茄尼醇含量相关基因的遗传研究较少。本研究通过高、低茄尼醇含量烟草种质配制杂交组合,建立P1、P2、F1、F2的4个世代群体,在烟叶工艺成熟期测定其茄尼醇含量,并利用“主基因+多基因”混合遗传模型进行分析,确定其遗传模型,估算遗传率,为高、低含量茄尼醇烟草种质的创新与利用提供理论基础和技术支持。
1 材料与方法
1.1 试验材料
前期通过对160份烟草种质资源茄尼醇含量的测定,筛选出低茄尼醇含量种质Maryland609和高茄尼醇含量种质K326,配制杂交组合:获得F1,F1自交,获得F2分离群体,构成进行遗传分析的P1、P2、F1、F2四个世代群体。
1.2 试验设计
试验在中国农业科学院烟草研究所山东青岛即墨农场和湖北恩施农场进行。2012年在中国农业科学院烟草研究所温室播种P1和P2,并进行杂交,获得F1的种子;2013年在中国农业科学院烟草研究所即墨农场种植F1,自交得到F2代种子;2014年在湖北恩施农场分别种植P1、P2、F1世代群体各50株,F2世代群体200株,2015年在湖北恩施农场种植F2世代群体200株。各个群体植株的田间排列为P1、P2、F1和F2,行距1.2 m,株距0.5m。P1、P2、F1种植2行,每行25株,F2种植8行,每行25株。各供试材料按当地栽培管理措施进行管理。
1.3 茄尼醇含量测定
取样和制样:打顶后工艺成熟期取中部叶,每株取2片烟叶,按单株进行挂牌编号,P1、P2、F1各取30株,2014年F2取177株,2015年F2取150株。将鲜烟叶样品带回实验室,去主脉,放入DHG-9240A电热恒温鼓风干燥箱105 ℃杀青10 min,然后在60 ℃条件下烘干。
利用UPLC(超高效液相色谱)进行茄尼醇的定量分析检测。
茄尼醇检测方法参照文献[29],进一步优化提取条件后,超高效液相色谱检测。称取过40目筛烟草粉末样品0.1 g(精确至0.0001 g)于20 mL带有聚四氟乙烯密封盖的离心玻璃管中,加入1.0 mL 0.1 mol/L的氢氧化钠乙醇溶液作为皂化剂,再加入5.0 mL正己烷作为萃取剂;盖上密封盖,震荡摇匀,放入恒温超声提取器(超声频率45 kHz,温度40~50 ℃)中提取30 min;取出,冷却至室温后旋开密封盖,加入8 mL去离子水,盖紧密封盖,充分震荡后,3000 r/min离心10 min;移取上层正己烷茄尼醇提取液,用流动相稀释10倍,用0.22 µm有机滤膜过滤至液相安瓿瓶中,用液相色谱进行检测(色谱条件为,色谱柱:BEH C18 1.7µm 2.1*100 mm;流动相:甲醇;流速:0.5 mL/min;柱温:35 ℃;检测波长:210 nm)。
1.4 数据分析
采用章元明等[10]的植物“主基因+多基因”混合遗传模型对本试验P1、P2、F1、F2四个世代的茄尼醇含量进行多世代联合分析。利用极大似然(ML, max-like lihood)法和IECM(Iterated expectation and conditional maximization)对各世代各相关成分的分布参数进行估计,获得所有遗传模型的分布参数估计值,根据AIC(Akaike′s information criterion)值选取备选模型,再进行适合性检验[均匀性检验统计量)和Kolmogorov-Smirnov检验(nW2统计量和Dn统计量)]。然后结合AIC准则(最小值)和适合性检测筛选最优模型,最后利用最小二乘法估算各基因的效应值,并分析相应的遗传效应[10-11]。
通过P1、P2以及F1的无偏估计可估计误差方差σ2,结合分离世代群体估算出主基因和多基因的遗传方差(),进而得出主基因和多基因的遗传率()。主基因与多基因的遗传方差和遗传率的计算公式[10]如下:

另外,利用浙江大学朱军教授提供的软件(QTModel)进行异常数据检测,利用Excel2010进行频次分布图的制作,利用SAS9.2软件进行正态分布检验以及群体间差异性检验。
2 结 果
2.1 烟草茄尼醇含量检测值的表型数据分析
各个世代茄尼醇检测值的频次分布见表1。Maryland609和K326茄尼醇含量的平均值分别为1.402%和1.909%,通过SAS9.2分析,P1和P2两个世代茄尼醇含量的差异达到显著水平(p<0.05)。F1世代茄尼醇含量的平均值为1.632%,介于两亲本之间,略低于两亲本的平均值。分离世代群体F2的标准差、变异系数和极差值均比不分离世代群体(P1、P2、F1)大,说明分离世代群体内部离散程度比较大,适于进一步的遗传分析。
2.2 烟草茄尼醇含量测得值的频次分布
将两年F2世代茄尼醇检测值进行分组,统计其分布频数(图1)可以看出,后代F2的分布既不呈简单的单基因控制的3∶1的规律,也不呈两个基因控制的9∶3∶3∶1的规律,而是呈现有主峰的偏态分布,因此认为与茄尼醇含量相关的遗传既有主效基因的作用,也有微效多基因的作用。
2.3 烟草茄尼醇含量的遗传模型
采用植物数量性状“主基因+多基因”混合遗传模型的多世代联合分析方法对烟草组合Maryland609×K326的4个世代茄尼醇含量进行分析获得5类共24种模型的极大似然值MLV(maxlike lihood-values)和AIC值,分别为1对主基因(A),2对主基因(B),多基因(C),1对主基因+多基因(D)和2对主基因+多基因(E)。由表2可以看出,在2014年,E4模型(2对等加性主基因+加性显性多基因混合遗传模型)、E5模型(2对完全显性主基因+加性显性多基因模型)和E6模型(2对等显性主基因+加性显性多基因模型)的AIC值相对较小,分别是203.0297、203.876和201.4873,初步筛选E4、E5、E6作为备选模型。在2015年,E2模型(2对完全显性主基因+加性显性多基因模型)和E6模型(2对加性显性主基因+加性显性多基因模型)的AIC值相对较小,分别为389.1459和383.2935,初步筛选E2、E6作为备选模型。两年的备选模型都包括E6模型,且E6模型的AIC值最小。

表1 世代茄尼醇含量的频次分布Table 1 Frequency distribution of solanesol content of generations

图1 分离世代(F2)群体茄尼醇含量频次分布Fig. 1 Frequency distribution of solanesol content of F2 generations
进一步对这3个备选模型分别进行均匀性和Kolmogorov-Smirnov检验,获得其相关的统计量(和Dn)及p值,统计备选模型中达到显著水平的统计量个数,个数最少的模型为最优模型。由表3可以看出,2014年的3个备选模型和2015年的2个备选模型均只在P1世代的检验中达到了显著水平(p < 0.05),然后进行极大似然比检验,得到分离世代各个基因型的后验概率,进行方差分析。由表4可知,在2014年,E4模型与E5、E6模型之间均存在极显著差异,E5模型的AIC值大于E6模型,依据AIC最虽小原则选择E6模型为最优遗传模型;在2015年,E2和E6模型之间存在极显著差异,E2模型的AIC值大于E6模型,同理选择E6模型为最优遗传模型。两年的数据初步确定烟草中茄尼醇含量的遗传是由2对等显性主基因+加性-显性多基因控制。
2.4 遗传参数估计
根据选定的茄尼醇含量最适遗传模型相关参数的极大似然估计值,可估算该模型相应的遗传参数。由表5可知,2年试验结果遗传参数da=db,且均为负向效应,说明2对主基因的加性效应相等,2对主基因同时存在时,可有效降低烟叶茄尼醇的含量,表明对主效基因进行累加选择可以降低茄尼醇的含量;2对主基因的显性效应ha=hb,即显性效应相等,均为负效应;2对主基因显性度的绝对值|ha/da|、|hb/db|都等于1,说明2对主基因的加性效应和显性效应相等,也均为负效应。多基因的显性效应值[h]大于加性效应值[d],且均为正向效应,具有正向超显性作用。说明在高茄尼醇种质创新过程中,对多基因遗传效应的应用应注重杂种优势的利用,同时也可对多基因进行累加选择以提高烟叶茄尼醇含量。

表 2 各遗传模型的MLV和AIC值Table 2 MLV and AIC values of each genetic model

表4 备选模型方差分析Table 4 the ANOVA of alternative models
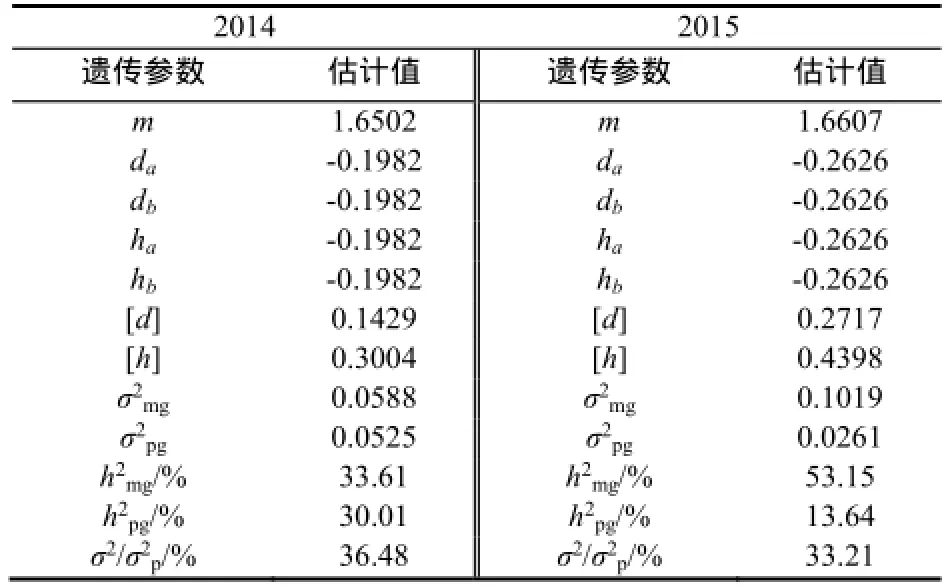
表5 茄尼醇含量E6模型遗传参数估计值Table 5 Estimate values of genetic parameters in E6 model
二阶遗传参数主基因遗传率分别为33.61%和53.15%,多基因遗传率分别为30.01%和13.64%,主基因+多基因的遗传率分别是63.62%和66.79%,环境变异在33.21%~36.28%,因此,烟草茄尼醇含量主要由遗传效应控制,同时受环境因素影响也比较大。
3 讨 论
“主基因+多基因”混合遗传模型在盖钧镒等[11]的研究下不断发展,多世代联合分析已从4世代联合分析发展到6世代联合分析,由于该遗传模型适用于植物数量性状的遗传分析而被广泛应用。方先文等[14]、李广军等[16]、李余生等[15]先后利用“主基因+多基因”混合遗传模型多世代联合分析的方法对小麦籽粒支链淀粉和总淀粉含量、大豆豆卷叶螟抗性、水稻稻曲病抗性进行了遗传分析,明确基因的遗传规律,为小麦品质育种、水稻和大豆的抗病育种做出了重要贡献。“主基因+多基因”混合遗传模型多世代联合分析的方法在烟草中的运用相对较晚,自2009年以来,主要应用于烟草抗病、农艺性状以及代谢产物的遗传分析。陈小翠等[30]利用该遗传模型对P1、P2、F1、F2等4世代群体进行了CMV抗性的遗传分析,结果表明,在烟草的成株期,2个不同环境下均表现为2对主基因+多基因(E2)控制,主基因的遗传率为36.57%。王日新等[31]利用“主基因+多基因”混合遗传模型分析了3个组合4个世代株高的遗传规律。目前,该方法也已经被应用于烟草代谢产物含量的遗传分析,蔡长春等[32-33]先后利用HD群体和P1、P2、F1、F2的4世代群体对烟碱含量和白肋烟烟碱转化性状进行了遗传分析。本研究利用4个世代联合分析的方法研究了烟草代谢产物茄尼醇含量的遗传规律,明确了在烟草中部叶成熟期茄尼醇含量的遗传模型(E-6),结果表明,与茄尼醇含量相关的基因既存在多基因效应,也存在主基因效应,同时具有加性和显性效应,与David[34]的研究结果不尽一致。
本研究利用F2世代研究了与茄尼醇含量相关基因的遗传规律,并设计了2年重复试验,结果均表明,烟草茄尼醇含量的遗传受2对等显性主基因+加性显性多基因所控制(E6)。主基因的加性、显性效应均为负效应,且效应值相等。多基因的加性、显性效应均为正效应,且加性效应小于显性效应。主基因+多基因的遗传效应大于环境效应,其中主基因的遗传率大于多基因的遗传率。但2年试验结果主基因的遗传率和多基因的遗传率存在差异,这可能与外界环境对茄尼醇含量的影响有关。因此,在后代选择中,应首先考虑主基因效应,同时注重环境的影响。
4 结 论
本研究通过“主基因+多基因”混合遗传模型多世代联合分析的方法初步确定了烟草中茄尼醇含量的遗传模型,并对其遗传参数进行了估计。初步认为烟草中茄尼醇含量的遗传符合2对等显性主基因+加性-显性多基因混合遗传模型(E6);主基因+多基因遗传效应大于环境效应,说明烟草叶片茄尼醇的含量主要受遗传效应控制,同时也受环境的影响。2对主基因的加性效应和显性效应均为负值,说明烟草茄尼醇含量存在加性负效应和显性负效应,对主效基因的累加选择可有效降低茄尼醇的含量。多基因间存在正向加性、显性效应,环境条件也对茄尼醇含量的遗传造成部分影响。因此,在高茄尼醇种质的创制中应注重对多基因显性效应的应用。
[1] 冯微微. 解密烟草[J]. 抗癌之窗,2014(11):16-19.
[2] 蒋予恩. 中国烟草品种资源[M]. 北京:中国农业出版社,1997.
[3] 陈爱国,申国明,梁晓芳,等. 茄尼醇的研究进展与展望[J]. 中国烟草科学,2007,28(6):44-45.
[4] 徐铮奎. 高纯度茄尼醇炙手可热[N]. 医药经济报,医药经济报,2009-05-07(12).
[5] 林富荣,周永生,陈新志. 茄尼醇的表征[J]. 江苏化工,2008,36(4):27.
[6] 唐德松. 烟草中茄尼醇的提取与分离研究[D]. 杭州∶浙江大学,2007:8.
[7] TANG S S, Hemming F W, Morton R A. The Intracellular Distribution of Solanesol and Plastoquinone in Green Leaves of the Tobacco Plant[J]. Biochem[J]. 1963, 88(52)∶ 52-53.
[8] 杜咏梅,张怀宝,张忠锋,等. 我国烤烟茄尼醇含量及其与烟草和烟气主要化学成分的相关性[J]. 中国烟草科学,2014,35(6):54-58.
[9] Schlotzhauer W S, Severson R F, Chortyk O T, et al. Pyrolytic fomation of polynuclear aromatic hydrocarbons from Petroleum ether extractable constituents flue-curedtobacco leaf[J]. Journal of Agricultural and food chemistry, 1976, 24(5)∶ 992-997.
[10] 王建康,盖钧镒. 利用杂种F2世代鉴定数量性状主基因-多基因混合遗传模型并估计其遗传效应[J]. 遗传学报,1997,24(5):432-439.
[11] 盖钧镒,章元明,王建康. QTL混合遗传模型扩展至2对主基因+多基因时的多世代联合分析[J]. 作物学报,2000,26(4):385-391.
[12] ZHANG Xin, LI Chengqi, WANG Xiyuan. Genetic Analysis of Cryotolerance in Cotton During the Overwintering Period Using Mixed Model of Major Gene and Polygene[J]. Journal of Integrative Agriculture, 2012, 11(4)∶ 537-543.
[13] 汤继华,彦民,付志远,等. 一种新型玉米温敏核雄性不育系的发现、鉴定及遗传分析[J]. 中国农业科学,2007,40(5):889-894.
[14] 方先文,姜东,戴廷波,等. 小麦籽粒总淀粉及支链淀粉含量的遗传分析[J]. 作物学报,2003,29(6):925-929.
[15] 李余生,朱镇,张亚东,等. 水稻稻曲病抗性的主基因+多基因混合遗传模型分析[J]. 作物学报,2008,34(10):1728-1733.
[16] 李广军,程利国,张国政,等. 大豆对豆卷叶螟抗性的主基因+多基因混合遗传[J]. 大豆科学,2008,27(1):33-36.
[17] 陈四龙,李玉荣,程增书,等. 花生含油量杂种优势表现及主基因+多基因遗传效应分析[J]. 中国农业科学,2009,42(9):3048-3057.
[18] 张兴伟,王志德,牟建民,等. 烤烟叶绿素含量遗传分析[J]. 中国烟草学报,2011,17(3):48-52.
[19] 郝贤伟,徐秀红,许家来,等. 烤烟耐烤性遗传分析[J]. 中国农业科学,2012,45(23):4939-4946.
[20] 张兴伟,王志德,刘艳华,等. 烤烟几个植物学性状的遗传分析[J]. 中国烟草科学,2012,33(5):1-8.
[21] 张兴伟,王志德,孙玉合,等. 烤烟叶数、叶面积的遗传分析[J]. 植物遗传资源学报,2012,13(3):467-472.
[22] 牟建英,钱玉梅,张兴伟,等. 烟草白粉病抗性基因的遗传分析[J]. 植物遗传资源学报,2013,14(4):668-672.
[23] 朱松,陈尚卫,张海波,等. 超临界流体技术在废次烟叶中提取纯化茄尼醇的应用[J]. 中国烟草学报,2008,14(5):22-26.
[24] 王琼. 萃取和结晶与柱层析结合提取高浓度茄尼醇[D]. 南京:南京师范大学,2007:8-14.
[25] 柳先平,陈军辉,李磊,等. 高效液相色谱-质谱法测定不同产地不同部位烟叶中茄尼醇[J]. 岩矿测试,2007,26(2):105-108.
[26] 夏联利. 环境因子对烟草生长和茄尼醇代谢的影响[D]. 郑州:郑州大学,2013:30-58.
[27] 段娜娜,岳彩鹏,苗红梅,等. 烟草法呢基焦磷酸合酶基因的克隆及序列分析[J]. 烟草科技,2010(1):56-59.
[28] 白琦,余佳,粟梅,等. 茄尼醇抗氧化和酪氨酸酶抑制作用研究[J]. 生物医学工程学杂志,2014,31(4):833-836.
[29] 潘葳,刘文静,翁伯琦,等. 烟叶及提取物中茄尼醇的高效液相色谱标准化测定方法研究[J]. 中国烟草科学,2013,34(4):60-61.
[30] 陈小翠,代帅帅,张兴伟,等. 烤烟CMV抗性的主基因+多基因混合遗传模型分析[J]. 植物遗传资源学报,2014,15(6):1278-1186.
[31] 王日新,任民,张兴伟,等. 普通烟草栽培种内株高性状主基因加多基因遗传分析[J]. 中国烟草科学,2009,30(2):15-20.
[32] 蔡长春,张俊杰,黄文昌,等. 利用DH群体分析白肋烟烟碱含量的遗传规律[J]. 中国烟草学报,2009,15(4):56-59.
[33] 蔡长春,冯吉,程玲,等. 白肋烟烟碱转化性状的主基因+多基因遗传分析[J]. 中国农学通报,2013,29(34):61-65.
[34] David D L, Nielsen M T. Tobacco-production,chemistry and technology[M]. Beijing∶ Chemical Industry Press, 2003.
Genetic Analysis on Solanesol Content of Tobacco
XIANG Dehu1,2, ZHAO Taozhi3, DU Yongmei1, ZHANG Zhongfeng1, YAN Ning1, HUANG Wenchang4,WANG Aihua1, FU Qiujuan1, GONG Yanan1, LIU Yanhua1*
(1. Key Laboratory of Tobacco Genetic Improvement and Biotechnology, Tobacco Research Institute of Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081,China; 3. Northeast Agricultural University College of Life Science, Harbin 150030, China; 4. Tobacco Research Institute of Hubei Province, Wuhan 430030, China)
∶ To explore the genetic model of solanesol content of tobacco leaf, a cross was made with the low solanesol Maryland609 as maternal parent and the high solanesol K326 as paternal parent and populations of four generations (P1, P2, F1, F2) were obtained. Determination of solanesol content of the four populations was done with UPLC. Genetic analysis of solanesol content in tobacco was carried out using the joint segregation analysis method with a mixed genetic model of major gene plus polygene. The results showed that solanesol content of tobacco leaf appeared to be a quantitative trait and the inheritance fit to a mixed genetic model of two major genes with equal additive effects plus polygenes with additive-dominant effects (E6 model).The results from two years showed that the additive effects and dominant effects of two major genes were equal and the quantitative value was negative. Dominant effects of polygenes were greater than additive effects. Heritabilities of the major genes were estimated to be 33.61% and 53.15%, respectively. Heritabilities of the polygenes were estimated to be 30.01% and 13.64%, respectively. The value of environmental variation was between 33.21%-36.28%. The results indicated that solanesol content of tobacco leaf was mainly controlled by major genes and poly genes, in which the major genes were dominant, and was effected by environmental factors at the same time.
tobacco; solanesol; major-gene plus polygenes; genetic effects
S572.03
1007-5119(2015)06-0001-07
10.13496/j.issn.1007-5119.2015.06.001
公益性行业(农业)科研专项“烟草增香减害关键技术研究与示范”(201203091)
向德虎,男,在读硕士,主要研究方向为烟草种质资源。E-mail:1559525145@qq.com。*通信作者,E-mail:liuyanhua@caas.cn
2015-02-05
2015-11-06
