preS/S 区基因变异与隐匿性HBV 感染的关系▲
2015-04-16景媛媛
景媛媛 段 勇 郭 燕
(陕西省西安市中心血站检验科,西安市 710061,E-mail:jingyuanyuantg@163.com)
隐匿性HBV 感染(occult hepatitis B virus infection,OBI)指患者HBV 标志物HBsAg 及HBeAg 阴性或抗-HBs与抗-HBc 阳性,血清中可检测到低水平HBV-DNA 或肝组织检测出HBsAg 或HBcAg。传统的慢性HBV 感染是通过检测血清中HBsAg 确定诊断。目前越来越多研究表明,无论是急性自限性肝炎,还是成功进行抗HBV 治疗后慢性乙型肝炎患者,HBsAg 清除后部分患者肝组织中仍可检出HBV DNA,肝脏损害依然存在(多为慢性严重肝损伤),仍可发展为肝硬化或肝癌[1-4]。早在20 年前就有人发现血清中含抗-HBs 的供血者能传播HBV 感染,特别是仅抗-HBc 阳性的传播可能性更大[5]。因此隐匿性HBV的感染机制是近年来此类疾病的研究热点。有研究表明在HBV Pre-s/s 区域的任何突变均可改变HBsAg 的抗原性和抑制抗-HBs 的产生[6]。在s 区域的124 ~147 氨基酸序列包含了“α”决定子和一个应答抗-HBs 的显性B 细胞抗原簇[7]。单个氨基酸在这个区域的替换可间接破坏抗-HBs的循环产生,导致在接种疫苗或隐匿性HBV 感染后发生变异性感染[8-9]。有人发现氨基酸第129 位天门冬氨酸和第145 位丙氨酸置换可导致血循环中HBsAg 阴性;s 蛋白第122 与123 位之间、123 与124 位之间,分别有2 ~3 个氨基酸插入,也可导致HBsAg 不能检出[10-12]。本文通过对HBsAg 阴性患者及HBsAg 阳性患者的血清进行DNA 提取及分析,探讨了HBV preS/S 区基因变异与OBI及肝脏损伤的关系,现报告如下。
1 资料与方法
1.1 临床资料 选择我单位2014 年1 ~12 月116 例HBsAg 阴性患者(为乙型肝炎康复患者)及102 例HBsAg阳性患者。HBsAg 阴性患者中男67 例,女49 例,年龄23 ~69(43.2±5.1)岁;HBsAg 阳性患者中男66例,女36 例,年龄20 ~71(41.9±4.3)岁。根据美国创伤外科协会(American Association of the Surgery of Trauma,AAST)分级标准[8]对两组患者肝损伤程度进行分级,在一级以上均定义为肝损伤,一级至三级定义为慢性肝损伤,三级以上(不包括三级)为严重肝损伤。HBsAg 阳性患者伴严重肝损伤共73 例,HBsAg 阴性患者伴严重肝损伤38 例,其中后者肝损伤多为慢性严重肝损伤。两组患者的性别、年龄等数据比较,差异无统计学意义(P >0.05),具有可比性。所有患者均在知情情况下参与此次研究,并已签署知情同意书。
1.2 主要仪器及试剂 HBV-DNA 荧光定量检测试剂盒(德国凯杰公司,批号:51306);LightCycler480 荧光定量PCR 仪[罗氏诊断产品(上海)有限公司]。
1.3 HBV-DNA 提取与定量检测 两组患者均于清晨空腹肘静脉采集血液3 ml,3 000 r/min 离心10 min 后取上清液至于-20℃待检。使用HBV-DNA 荧光定量检测试剂盒进行DNA 的提取:取样本血清置入试管,使用一步法在血清中加入核算释放剂后全部转入扩增,50℃反应2 min,于94℃保温5 min 后再按94℃15 s、57℃30 s进行45 个循环;使用LightCycler480 荧光定量PCR 仪进行定量检测,敏感性设定为500 IU/ML。
1.4 PCR 扩增HBV 核酸检测 对116 例HBsAg 阴性患者的DNA 进行PCR 扩增HBV 核酸检测,依照文献[13]的方法进行引物的设计,分别针对preS/S 区、pre-core/core区及X 基因区的巢式PCR 反应体系对OBI进行检测。使用MBI Frematas Taq 在PCR 仪上进行扩增,具体方法如下:第一轮总体系10 μl,双蒸水5.0 μl,缓冲液1.0 μl,镁离子1.0 μl,Dntp 0.8 μl,两侧引物各0.05 μl,Taq 酶0.2 μl,DNA 模板1 μl。循环条件为预变性94℃、5 min,变性94℃、30 s,退火56℃、30 s,延伸72℃、30 s,进行30 个循环;第二轮其他条件不变,循环增加至40 个。DNA 样本以出现两个或两个以上片段的特异性扩增产物为OBI 基因组阳性。
1.5 HBV preS/S 区全长基因进行测序分析 查照HBV 参考序列,使用Primer Premier5 进行分析后设计一条正向引物(P1,5'-TTCTTGGGAACAAGAGCTAC-3'),两条反向引物(R1,5'-GCAAAGCCCAAAAGACCCAGAAT-3';R2,5'-TGACAATACTTTCCAATCAAT-3')。两 对 引 物 扩增片段分别为1410 bp 和1383 bp。扩增产物在理论上已经包含了HBV preS/S 区基因。使用PCR 仪进行扩增,将产物过琼脂糖凝胶电泳后进行纯化回收,进行检序,无法直接检序的在产物末端加A 尾后连接T 载体,检测结果使用SciEd7 软件进行分析。分别比较OBI 患者与HBsAg 阳性患者、伴有严重肝损伤的OBI 患者与HBsAg 阳性患者的preS/S 区基因序列突变或缺失情况。
1.6 统计学分析 采用SPSS 19.0 软件进行统计分析,计量资料以表示,组间对比采用t 检验,计数资料采用χ2检验,以P <0.05 为差异具有统计学意义。
2 结 果
2.1 PCR 扩增HBV 核酸检测结果 对116 例HBsAg阴性患者的DNA 进行PCR 扩增HBV 核酸检测,出现preS/S 区、pre-core/core 区、X 基因区的例数分别为49、64、27,HBV DNA 阳性者70 例,最终OBI 检出率(即HBV-DNA 阳性率)为60.34%(70/116),其中男性48例,女性22 例,伴有严重肝损伤患者38 例。
2.2 preS/S 区全长基因进行测序分析结果
2.2.1 OBI 患者与HBsAg 阳性患者的preS/S 区基因序列比较:OBI 患者M1I、Q2K、Q129N/R/P、S210R 及G185R的突变频率均明显高于HBsAg 阳性患者(P <0.05),OBI患者的preS 缺失率也高于HBsAg 阳性患者(P <0.05)。见表1。

表1 OBI 患者与HBsAg 阳性患者preS/S 区基因序列突变或缺失比较(n,%)
2.2.2 伴有严重肝损伤的OBI 患者与HBsAg 阳性患者的preS/S 区基因序列比较:两者Q129N/R/P 突变频率及preS 缺失率比较,差异无统计学意义(P >0.05),伴有严重肝损伤的OBI 患者M1I、Q2K、S210R 及G185R 突变频率均明显高于HBsAg 阳性患者(P <0.05)。见表2。
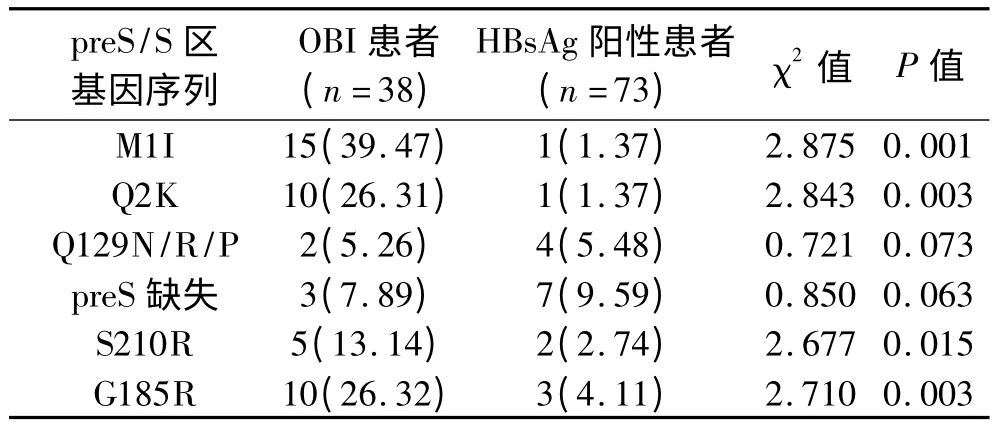
表2 伴有严重肝损伤的OBI 患者与HBsAg阳性患者的preS/S 区基因序列突变或缺失比较(n,%)
3 讨 论
OBI 的发生是病毒和机体相互作用的结果,其可能有多种发病机制:(1)HBV 低水平复制,抗原表达量低;(2)HBV 基因变异;(3)HBV 整合到宿主染色体中;(4)外周血单核细胞感染HBV;(5)宿主免疫应答异常;(6)受其他病毒感染的干扰;(7)试剂的灵敏度和质量问题。OBI 普遍存在,其意义有下面几个方面:(1)输血、血液透析以及脏器移植传播HBV 的潜在危险。(2)隐源性肝病的病因。(3)OBI 病情恶化已有诸多报道,但发生频率尚不清楚。(4)在肝细胞癌病人中常常发现OBI 的存在,认为与原发性肝癌发生有关,尤其是合并丙肝病毒感染时。(5)当丙肝病毒感染合并OBI时,将会影响其自然病程或增加疾病的严重程度。(6)乙肝疫苗接种无应答的原因之一。此外HBV 隐匿性感染者是HBV 母婴传播途径的重要传染源[14-16]。
本研究对大量临床实例的血液DNA 样本进行监测,探讨了HBV preS/S 区基因变异与OBI 及肝脏损伤的关系,结果显示OBI 患者M1I、Q2K、Q129N/R/P、S210R 及G185R 的突变频率均明显高于HBsAg 阳性患者(P <0.05),OBI 患者的preS 缺失发生率亦高于HBsAg阳性患者(P <0.05);提示OBI 患者与HBsAg 阳性患者在基因层面上的发病机制有着较大的不同,M1I、Q2K、Q129N/R/P、S210R 及G185R 的突变及preS 缺失对OBI 的诊断有一定的指导帮助。伴有严重肝损伤的OBI患者Q129N/R/P 突变率及preS 缺失率与HBsAg 阳性伴严重肝损伤的患者比较,差异无统计学意义(P >0.05),但M1I、Q2K、S210R 及G185R 突变频率均明显高于均明显高于HBsAg 阳性伴严重肝损伤的患者(P <0.05),提示以上preS/S 区基因序列的突变对评价OBI 患者的肝损伤有一定的指导作用,但当患者存在肝损伤时Q129N/R/P变异及preS 缺失对OBI 的诊断作用可能受到影响。
综上所述,OBI 与HBsAg 阳性患者之间导致慢性严重肝损伤的病毒学因素不同,M1I、Q2K、S210R 及G185R 等突变对于OBI 患者而言可能是评价其是否可能发展为慢性严重肝损伤的重要指标,同时从另一方面说明了对HBsAg 阴性人群进行HBV-DNA 检测的必要性。
[1] 王林川,于 燕,徐 莉.乙型肝炎病毒核酸抗原相关的检测及临床意义[J].国外医学(医学地理分册),2011,32(4):261-263,273.
[2] 徐 俊,郭 楠.乙型肝炎病毒表面抗原检测的准确性分析[J].疑难病杂志,2010,9(5):365-367.
[3] Lampertico P,Maini M,Papatheodoridis G.Optimal management of hepatitis B virus infection-EASL Special Conference[J].J Hepatol,2015,63(5):1 238-1 253.
[4] 白丽萍,张颖慧,杨雪艳,等.血HBsAg 阴性而抗HBc 阳性体检人群中的隐匿性乙肝感染[J].医药前沿,2013,3(7):33-34.
[5] 贾晓坤,杨鹏华,李双霞,等.隐匿性乙肝病毒表面抗原Y100C 位点替换的表达及其作用研究[J].现代生物医学进展,2013,13(19):3 645-3 647.
[6] Spreafico M,Berzuini A,Foglieni B,et al.Poor efficacy of nucleic acid testing in identifying occult HBV infection and consequences for safety of blood supply in Italy[J].J Hepatol,2015,63(5):1 068-1 076.
[7] 叶贤林,杜 鹏,冯 旭,等.深圳市18 ~25 岁抗-HBc 阳性合格献血者隐匿性乙肝病毒感染的血清学和分子生物学特性分析[J].中国输血杂志,2014,27(11):1 112-1 116.
[8] Lee IK,Lee SA,Kim H,et al.Induction of endoplasmic reticulum-derived oxidative stress by an occult infection related S surface antigen variant[J].World J Gastroenterol,2015,21(22):6 872-6 883.
[9] 郭兆富,陈天鹏,尹以靖,等.NAT 技术在德宏地区献血标本输血传染病筛检中的应用[J].临床输血与检验,2013,15(3):247-248.
[10]倪宏英,欧山海,谢金镇,等.不同核酸检测方法对献血者隐匿性乙肝病毒感染的研究[J].中国输血杂志,2011,24(12):1 044-1 047.
[11]Srivastava A,Mathias A,Yachha SK,et al.Occult hepatitis B infection in children with chronic liver disease[J].Eur J Gastroenterol Hepatol,2015,27(4):375-377.
[12]郑 洁,曾爱中.隐匿性乙肝与肝细胞肝癌关系的研究进展[J].重庆医科大学学报,2015,40(3):321-324.
[13]Hui CK,Sun J,Au WY,et al.Occult hepatitis B virus infection in hematopoietic stem cell donors in a hepatitis B virus endemic area[J].J Hepatol,2005,42(6):813-819.
[14]苏峰太,黄 璐.持续性血液透析患者中HBV DNA 检出率及相关因素分析[J].医学与哲学(B),2015,36(1):43-44,54.
[15]宋玉伟.HBsAg 阳性母亲所生儿童预防接种乙肝疫苗和乙肝免疫球蛋白后仍有较高的隐匿性乙肝病毒感染的发生率[J].实用器官移植电子杂志,2013,1(3):188.
[16]卢紫燕,单芙香,汪武新,等.深圳市人群乙肝表面抗体水平及乙肝母婴阻断效果监测分析[J].实用预防医学,2013,20(1):47-49.
