芬维A胺对人肝癌细胞株HepG2增殖与细胞凋亡的影响
2015-04-15石胜利戴小华马娅梅周海华
石胜利,戴小华,马娅梅,周海华
(中山小榄人民医院消化内科,广东 中山 528415)
芬维A胺对人肝癌细胞株HepG2增殖与细胞凋亡的影响
石胜利,戴小华,马娅梅,周海华
(中山小榄人民医院消化内科,广东 中山 528415)
目的探讨分子靶向药物芬维A胺(Fenretinide)在体外对人肝癌细胞株HepG2的细胞增殖与细胞周期的影响。方法体外培养人肝癌HepG2细胞,实验组在培养液中加入不同浓度的芬维A胺(2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L),对照组培养液中不加芬维A胺,分别孵育48 h后,采用MTT法检测芬维A胺对HepG2细胞增殖的影响,流式细胞仪分析细胞周期和凋亡率。结果芬维A胺能明显抑制HepG2细胞增殖,呈时间和剂量依赖性;芬维A胺处理HepG2细胞72 h,可使G0~G1期细胞比例升高,G2~M、S期比例明显下降,凋亡率明显上升(P<0.05)。结论芬维A胺对体外人肝癌HepG2细胞具有明显的抑制作用,主要表现为抑制增殖和促进凋亡。
芬维A胺;人肝癌细胞株HepG2;细胞增殖;凋亡
我国的原发性肝癌患者多数伴有严重肝硬化和肝功能失代偿,而且相当部分的肝癌为多中心发生,临床诊断时已多属进展期,多数已失去手术机会。全身化疗仍是治疗这类肝癌的主要手段之一,但肝癌对常规化疗药物不敏感,预后极差[1],因此迫切需要寻找新的治疗方法。随着对肿瘤发病机制细胞分子水平的深入研究,肿瘤分子靶向治疗成为近年来抗癌药物研究的热点,被认为是提高肝癌治疗效果的希望所在[2]。芬维A胺可有效用于多种肿瘤的预防,其相对于传统化疗药物具有特异性强、副作用少和具有协同作用等特点,能作用于多个信号传导通路和不同靶点来实现调节细胞周期、诱导肿瘤细胞凋亡和抑制新生血管形成等靶向抗癌活性,可长期服用,是一种具有良好临床应用前景的靶向抗癌药物[3]。本实验观察了芬维A胺在体外对人肝癌细胞株HepG2的抑制作用,以期为临床分子靶向药物治疗肝癌提供可靠的实验依据。
1 材料与方法
1.1 细胞与试剂 芬维A胺购自湖北赛博药业有限公司,将芬维A胺溶于二甲基亚砜(DMSO)原液并稀释成10mmol/L储存液,-20℃避光储存备用,DMSO终浓度<0.5%。四甲基偶氮唑盐(MTT)购自Sigma公司,用磷酸盐缓冲液(PBS)配制成浓度为5 mg/ml。碘化丙锭(PI)试剂盒购自Sigma公司。Annexin V-EGFP试剂盒和人肝癌细胞株HepG2购自南京凯基生物科技发展有限公司。
1.2 细胞培养 肝癌细胞置于37℃、含5% CO2的培养箱中,在含10%胎牛血清及青霉素G (100 unit/ml)和链霉素(1μg/ml)的DMEM细胞培养基中生长。贴壁生长的细胞以0.25%的胰蛋白酶消化,每2~3 d传代一次。
1.3 MTT法测定芬维A胺对HepG2细胞的抑制率 取对数生长期HepG2细胞,消化制成单细胞悬液后,以1×105/ml密度接种于96孔板,实验组和阴性对照组每孔加细胞悬液100 μL,空白孔不加细胞,培养24 h后加入药物。使药物组每孔芬维A胺终浓度分别为2.5 μmol/L、5 μmol/L、10 μmol/L、20 μmol/L,阴性对照组与空白调零组只加培养基,每组设6个平行对照孔。置于37℃、含5%CO2的培养箱中培养48 h,72 h后弃上清,每孔加MTT(1 mg/ml)100 μl,继续培养4 h,吸去原培养液,加入DMSO 150 μl/孔,振荡10min,用酶标仪测定吸光度(A),测定波长540 nm,参考波长620 nm,计算抑制率。抑制率(%)=(1-实验组吸光度值/对照组吸光度值)×100。
1.4 流式细胞仪检测细胞周期分布及凋亡 取对数生长期HepG2细胞消化成单细胞悬液后接种于培养瓶,每瓶加培养液8ml。根据MTT实验结果选择的剂量加药后,于37℃、5%CO2饱和湿度条件下培养24 h后加入药物,实验分为芬维A胺(10 μmol/L)组和对照组。加药72 h后分别收集细胞,进行细胞周期及凋亡率检测:(1)细胞周期检测:细胞用75%酒精固定24 h,PBS冲洗后PI染色,避光室温反应30min,流式细胞术检测细胞周期;(2)凋亡率检测:调整细胞浓度为4×105/ml,加入Annexin V-EGFP 5 μl和5 μl PI,避光室温反应15min后检测。
1.5 统计学方法 应用SPSS13.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 芬维A胺对HepG2细胞增殖的抑制作用 MTT法测定结果显示,芬维A胺对HepG2细胞增殖有抑制作用,呈现浓度和时间依赖关系。2.5 μmol/L、5µmol/L、10µmol/L和20 μmol/L均为有效药物浓度。随用药时间的延长,抑制率明显上升(P<0.05);随用药浓度的提高,抑制率逐渐升高,但10µmol/L与20µmol/L浓度作用48 h后,其抑制率即可达到50%以上,见表1。
表1 芬维A胺作用于HepG2细胞的抑制率(±s)
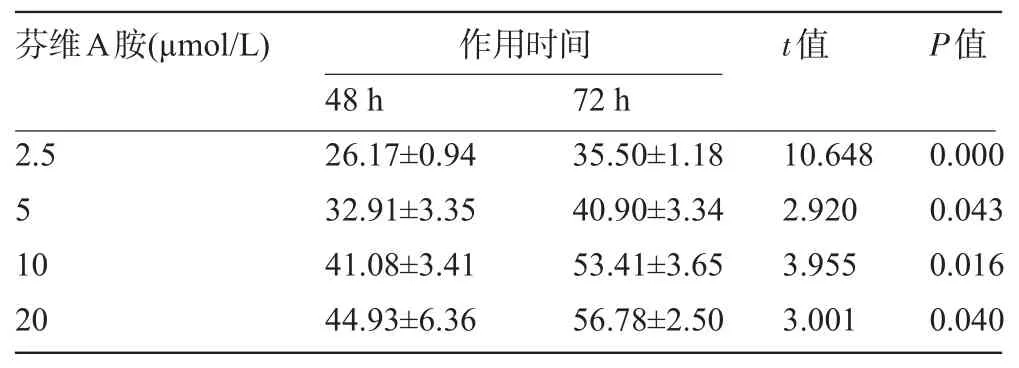
表1 芬维A胺作用于HepG2细胞的抑制率(±s)
芬维A胺(µmol/L)作用时间t值P值48 h 72 h 2.5 5 10 20 26.17±0.94 32.91±3.35 41.08±3.41 44.93±6.36 35.50±1.18 40.90±3.34 53.41±3.65 56.78±2.50 10.648 2.920 3.955 3.001 0.000 0.043 0.016 0.040
2.2 流式细胞仪检测细胞周期及凋亡率 芬维A胺处理72 h,HepG2细胞周期中的G0~G1期比例明显升高,从(40.67±0.57)%上升到(66.58±0.65)%,G2~M期比例从(15.43±0.58)%下降到(8.32±0.02)%;S期比例从(26.60±1.57)%下降到(14.38±1.21)%。凋亡率从(3.45±0.23)%上升到(19.08±1.35)%,差异均有统计学意义(P<0.05),见表2。
表2 芬维A胺处理72 h后HepG2细胞周期比例和凋亡率(%,±s)
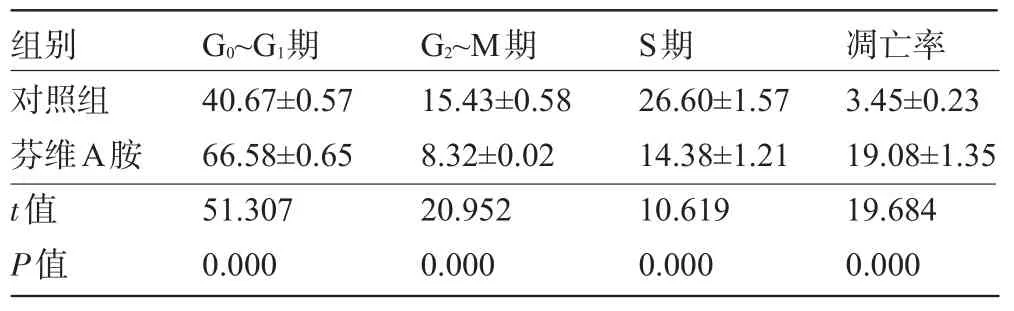
表2 芬维A胺处理72 h后HepG2细胞周期比例和凋亡率(%,±s)
组别G0~G1期G2~M期S期 凋亡率40.67±0.57 66.58±0.65 51.307 0.000对照组芬维A胺t值P值15.43±0.58 8.32±0.02 20.952 0.000 26.60±1.57 14.38±1.21 10.619 0.000 3.45±0.23 19.08±1.35 19.684 0.000
3 讨 论
芬维A胺是在全反式维甲酸的基础上经过结构改造而成的维甲酸类似物,是目前已知毒副作用最小的维生素类化合物,能够抑制致癌物所诱导的多种肿瘤,并能诱导实体肿瘤如乳腺癌、神经母细胞瘤、膀胱癌以及头颈部等肿瘤细胞发生凋亡,在实验研究和临床治疗上显示出较强的抗癌活性,可以预防乳腺癌和卵巢癌的术后复发,但不损伤正常肝细胞等[4-5],其主要作用于肿瘤细胞,增大内质网压力,提高细胞内活性氧水平,从而启动一系列通路,抑制肿瘤细胞生长和增殖,诱导细胞凋亡。芬维A胺还可用于脂肪肝和肝纤维化的预防和治疗,研究显示给高脂饮食喂养小鼠服用芬维A胺可以改善小鼠肝内胰岛素抵抗从而预防脂肪肝。芬维A胺能诱导肝星状细胞凋亡,减轻四氯化碳诱导的肝纤维化[6-7]。因此,芬维A胺可逆转肝脏早期病理变化可用于肝癌的预防。
本实验通过MIT法发现芬维A胺对肝癌HepG2细胞株的增殖有明显的增殖抑制作用。呈现浓度和时间依赖关系。随着芬维A胺浓度的增加和作用时间的延长,对肝癌HepG2细胞的抑制率逐渐上升,说明它的抑制作用具有一定的剂量和时间依赖性。芬维A胺浓度从10µmol/L到20µmol/L作用48 h后,其抑制率即可达到50%以上,再无明显上升。
芬维A胺可以将肝癌HepG2细胞的周期阻滞在G0~G1期,G0~G1期细胞比例从(40.67±0.57)%上升到(66.58±0.65)%,导致G0~G1期细胞比例增加,而进人S期的细胞比例减少,从而阻断了细胞的生长和分裂,延长了细胞周期,起到抗增殖作用。
本研究发现10µmol/L芬维A胺能明显诱导肝癌HepG2细胞发生凋亡,并呈时间依赖性。细胞凋亡率凋亡率从(3.45±0.23)%上升到(19.08±1.35)%,这个结果与Yang等[8-9]的报道相符,以人肝癌细胞株来检测芬维A胺对肝癌细胞的敏感性,发现芬维A胺显著诱导人肝癌细胞株凋亡,这一凋亡效应与芬维A胺抑制ERK1/2通路活性促使Nur77出核诱导凋亡有关,但人肝癌细胞株耐受芬维A胺是因为ERK1/2-Nur77凋亡通路受抑制有关。并且也与其他芬维A胺诱导癌细胞凋亡的研究相似。国内吴小琴等[10]的研究结果显示在对芬维A胺不敏感的肝癌细胞株SNU475、 SNU449、SNUl82中,芬维A胺上调P-ERKl/2蛋白表达,而在敏感细胞SK-HEP-1、PLC/PRF/5中,芬维A胺下调P-ERKl/2蛋白表达,提示芬维A胺体外促肝癌细胞凋亡可能通过抑制ERKl/2蛋白活化起作用。同时芬维A胺对HepG2细胞的诱导凋亡效应也存在浓度依赖性,随着作用浓度的增加,其凋亡效应也随之增加。由此可见,芬维A胺作为肿瘤预防性药物对于癌细胞具有诱导凋亡的效应。
芬维A胺作为一种抗肿瘤分子靶向新药,与化疗药物相比其毒副作用较小,如与化疗药物联用能增强疗效,因此具有广泛的临床应用前景。但芬维A胺抑制肿瘤的具体机理尚未完全清楚,鉴于细胞内信号传递途径十分复杂,更确切的作用机制尚有待进一步研究。
[1]Tang ZY,Ye SL,Liu YK,et al.A decade's studies on metastasis of hepatocellular carcinoma[J].J Cancer Res Clin Oncol,2004,130: 187-96.
[2]Llovet JM,Bruix J.Molecular targeted therapies in hepatocellular carcinoma[J].Hepatology,2008,48:1312-1327.
[3]Hail N Jr,Kim HJ,Lotan R.Mechanisms of fenretinide-induced apoptosis[J].Apoptosis,2006,11:1677-1694.
[4]Sogno I,Vene R,Ferrari N,et al.Angioprevention with fenretinide: targeting angiogenesis in prevention and therapeutic strategies[J]. Crit Rev Oncol Hematol,2010,75:2-14.
[5]Decensi A,Zanardi S,Argusti A,et al.Fenretinide and risk reduction of second breast cancer[J].Nat Clin Pract Oncol,2007,4: 64-65.
[6]Preitner F,Mody N,Graham TE,et al.Long-term fenretinide treatment prevents high-fat diet-induced obesity,insulin resistance,and hepatic steatosis[J].Am J Physiol Endocrinol Metab,2009,297: E1420-1429.
[7]Qian J,Zhang JS,Wang XQ,et al.Fenretinide stimulates the apoptosis of hepatic stellate cells and ameliorates hepatic fibrosis in mice [J].Hepatol Res,2009,39:1229-1247.
[8]Yang H,Bushue N,Bu P,et al.Induction and intracellular localization of Nur77 dictate fenretinide-induced apoptosis of human liver cancer cells[J].Biochem Pharmacol,2010,79:948-954.
[9]Yang H,Zhan Q,Wan YJ.Enrichment of Nur77 mediated by retinoic acid receptorβleads to apoptosis of human hepatocellular carcinoma cells induced by fenretinide and histone deacetylase inhibitors [J].Hepatology,2011,53(3):865-874.
[10]吴小琴,杨 辉,钟 赘,等.芬维A胺通过抑制ERKl/2活化促进人肝癌细胞凋亡[J].实用医学杂志,2012,28(18):3006-3008.
Effect of fenretinide on the proliferation and apoptosis of human liver cancer cell line hepG2.
SHI Sheng-li,DAI Xiao-hua,MA Ya-mei,ZHOU Hai-hua.Department of Gastroenterology,Zhongshan Xiaolan People's Hospital, Zhongshan 528415,Guangdong,CHINA
ObjectiveTo investigate the depressant effects of fenretinide on human liver cancer cell line HepG2 cellsin vitro.MethodsHuman liver carcinoma line HepG2 cells were culturedin vitro.The HepG2 cells of the test group were incubated in the medium with fenretinide at different concentrations(2.5 μmol/L,5 μmol/L,10 μmol/L, 20 μmol/L).The cells of the control group were incubated in the medium for 48 hours.MTT method was used to detect the antiproliferative ratio of fenretinide on HepG2 cells,and flow cytometry was applied to analyze the cell cycle and apoptotic ratio.ResultsFenretinide could obviously inhibit the proliferation of HepG2 cells,showing time-and dose-dependent effects.72 hours after the HepG2 cells were treated with fenretinide,the percentage of HepG2 cells in G0~G1period increased,and that in G2~M period and S period decreased,with the aopototic ratio of HepG2 cells increased significantly(P<0.05).ConclusionFenretinide can inhibit proliferation and promote apoptosis of human liver cancer cell line HepG2 cellsin vitro.
Fenretinide;Human liver cancer cell line HepG2;Cell proliferation;Apoptosis
R735.7
A
1003—6350(2013)04—0472—03
2014-07-09)
10.3969/j.issn.1003-6350.2015.04.0173
2012中山市科技局立项课题(编号:20122A106)
石胜利。E-mail:shishengli2004@163.com
