周脂素和ADRP在糖代谢异常大鼠肝脏组织中的表达*
2015-04-15樊林花刘茂林卫兵艳刘田福王春芳庞文彪郭永昌刘建新
樊林花, 刘茂林, 卫兵艳, 刘田福, 王春芳 庞文彪, 郭永昌, 刘建新
(1山西医科大学实验动物中心,实验动物和人类疾病动物模型山西省重点实验室,山西 太原 030001; 2山西省一○九医院,山西 太原 030006)
·短篇论著·
周脂素和ADRP在糖代谢异常大鼠肝脏组织中的表达*
樊林花1, 刘茂林1, 卫兵艳1, 刘田福1, 王春芳1庞文彪1, 郭永昌1, 刘建新2△
(1山西医科大学实验动物中心,实验动物和人类疾病动物模型山西省重点实验室,山西 太原 030001;2山西省一○九医院,山西 太原 030006)
目的: 探讨脂滴相关蛋白周脂素(perilipin)和脂肪分化相关蛋白(ADRP)在糖尿病发生发展过程中的变化情况以及在糖代谢异常合并非酒精性脂肪肝中的作用。方法: 分别用高脂饲料喂养和高脂饲料喂养加小剂量链脲佐菌素建立糖耐量受损(IGT)和2型糖尿病大鼠模型(T2DM),采用光镜观察各组大鼠肝组织的形态学改变;用ELISA法测定血清周脂素perilipin和ADRP含量;real-time PCR 技术检测肝脏组织中perilipin和ADRP mRNA的表达;用 Western blotting法检测肝脏组织中ADRP蛋白的表达。结果: HE结果显示, IGT组和 T2DM组大鼠均有肝细胞脂肪变性,IGT组变性更严重;各模型组的生化指标与临床相关疾病的表现一致;血清perilipin水平各组之间无差异,但IGT组和T2DM组肝组织perilipin mRNA表达明显升高(P<0.01);与IGT组相比,T2DM组perilipin mRNA表达显著增加(P<0.05)。T2DM组血清ADRP含量较其对照组明显降低(P<0.01);模型组肝组织ADRP mRNA表达明显降低(P<0.01);ADRP蛋白表达较其对照组也明显降低(P<0.01);与IGT组相比,T2DM组ADRP mRNA表达明显降低(P<0.01)。结论: 血清ADRP含量在T2DM的形成中起一定的作用,与胰岛素抵抗指数呈明显负相关;高脂喂养后能导致大鼠糖代谢异常,并伴有非酒精性脂肪肝的发生;糖代谢异常合并非酒精性脂肪肝的发生可能与肝组织perilipin表达升高和ADRP表达降低有关。
周脂素; 脂肪分化相关蛋白; 糖耐量受损; 2型糖尿病
2型糖尿病发病机制复杂,但胰岛素抵抗(insulin resistance,IR)和脂代谢紊乱是其主要特征,研究表明,脂肪分解途径紊乱可能是联系IR和糖代谢异常时高脂血症的重要环节[1]。近年来研究发现脂滴相关蛋白perilipin和ADRP等对脂肪的代谢调节具有重要作用[2-3]。尽管脂代谢紊乱在糖尿病中发挥着重要作用,但就perilipin和ADRP而言在糖代谢异常的不同病理状态下研究较少,且尚未见在糖耐量受损阶段的相关报道,因此,本实验室建立糖耐量受损(impaired glucose tolerance,IGT)大鼠模型和2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠模型,观察不同糖代谢状态下血清及肝组织周脂素(perilipin)和ADRP的表达状况,旨在探讨perilipin和ADRP在糖尿病发生发展过程中的变化,以及在糖代谢异常合并非酒精性脂肪肝中的作用。
材 料 和 方 法
1 主要仪器与试剂
酶标仪(BioTeK);全自动生化测定仪(Beckman Coulter Lx-20),所用试剂、质控及标准均为Beckman 生产;高速冷冻离心机(Sigma);德国罗氏优越H型血糖仪及试纸,荧光定量PCR仪(ABI 7300);垂直电泳仪(Bio-Rad);链脲佐菌素(Sigma);GPO-PAP试剂盒(南京建成生物研究所);Perilipin、ADRP与胰岛素ELISA试剂盒(R&D);ADRP和GAPDH抗体(Abclonal Biotechnology);RNAiso Plus总RNA提取试剂、RT试剂盒、PCR试剂盒以及perilipin、ADRP和β-actin引物由宝生物工程大连有限公司提供或合成。
2 动物模型的建立及样本收集
健康SD大鼠60只,雄性,清洁级,体质量170~210 g,由山西医科大学实验动物中心提供[合格证编号为SCXY(晋)2009-0001],饲养于本中心屏障环境动物实验室[合格证编号为SYXY(晋)2009-0004],将大鼠随机分为IGT模型组(IGT)、IGT对照组(control)、2型糖尿病组(T2DM)和糖尿病对照组(T2DM control),对照组饲喂普通饲料 (3.2 kCal/g,其中脂肪、碳水化合物和蛋白质分别提供热量10.2%、66.5%和23.3%),模型组饲喂高脂饲料(5.24 kCal/g,其中脂肪、碳水化合物和蛋白质分别提供热量 60%、20%和 20%),自由饮水,IGT组及其对照组共饲养12周。2型糖尿病组饲喂高脂饲料4周后,腹腔注射小剂量STZ(35 mg/kg)[4],其对照组腹腔注射等剂量柠檬酸-柠檬酸钠缓冲液。每4周测量1次体重。
IGT组高脂饲养12周后,进行口服糖耐量试验(oral glucose tolerance test,OGTT),选出OGTT中2 h血糖值在7.8~11.1 nmol/L且伴有胰岛素抵抗[用胰岛素抵抗指数(HOMA-IR)来评判]者为IGT大鼠[5]。糖尿病组于注射链脲佐菌素72 h后,检测空腹血糖(fasting blood glucose,FBG),选择FBG高于11.1 nmol/L为2型糖尿病大鼠模型[6]。选择拟处死大鼠禁食12 h以上,称重,腹主动脉采血,分离血清,在-80 ℃保存,备测生化指标、脂滴相关蛋白和胰岛素水平。迅速摘取肝脏,切取同一部位肝组织以备病理检测;另取一部分用铝箔包好液氮速冻后,冻存于-80 ℃冰箱,以备real-time PCR和Western blotting以及肝组织甘油三酯检测。每组选取6份样本进行real-time PCR和Western blotting检测。
3 主要方法
3.1 血清perilipin、ADRP和空腹胰岛素(fasting insulin, FINS)含量的检测 ELISA法测定血清perili-pin、ADRP和FINS含量,按照试剂盒说明书进行操作。
3.2 血生化指标检测 FBG及2 h OGTT血糖用快速血糖仪测量;甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)用全自动生化测定仪测定,按照操作规程和试剂使用说明进行;HOMA-IR=FBG×FINS/22.5。
3.3 大鼠肝组织脂质含量测定 取300 mg肝脏组织,经氯仿/甲醇抽提TG后,分离水相物质和有机相物质,吸取有机相物质,应用GPO-PAP试剂盒测肝组织TG含量。
3.4 肝脏组织病理学检查 肝脏组织经10%中性甲醛固定,常规石蜡包埋, 4 μm厚度切片,HE染色,光镜下观察肝脏组织形态学改变。
3.5 实时荧光定量PCR 技术检测肝脏perilipin和ADRP mRNA的表达 剪取冻存的肝组织 50 mg, 按试剂说明书操作, 提取总 RNA, 逆转录成 cDNA, 然后进行荧光定量PCR 扩增, 以β-actin作为内参照,用2-ΔΔCt值表示目的基因的相对表达量。Perilipin的上游引物为5’-CGAGTCACAACCCCACGAT-3’,下游引物为5’-TCAGCCCACGAGAGAGGAA-3’;ADRP的上游引物为5’-CGTGGAAAGGACCAAGTCTG-3’,下游引物为5’-TTCTGAGTGAGCGGCAAGTA-3’;β-actin的上游引物为5’-CCACCCGCGAGTACAACCTTC-3’,下游引物为5’-CCCATACCCACCATCACACC-3’。 扩增条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 31 s,循环40次。
3.6 Western blotting法检测肝脏组织中ADRP蛋白的表达 提取肝组织总蛋白,用BCA法定量,将定量好的组织蛋白变性后,进行聚丙烯凝胶电泳,将分离后的蛋白转到NC膜,丽春红染色后用蒸馏水脱色至褪去。将裁好的膜置于蛋白干粉的封闭液中(室温轻摇1 h)。将封闭好的膜置于 I 抗稀释液中(1∶1 000),4 ℃孵育过夜,洗涤后加入HRP标记的 II 抗中室温孵育1 h,洗涤后,DAB显色,Bandscan软件对显影条带进行灰度分析,将ADRP灰度值与内参照GAPDH灰度值的比值作为其蛋白的相对表达水平。
4 统计学处理
数据采用均数±标准差(mean±SD)表示,采用SPSS 16.0软件进行统计分析,以单因素方差分析比较各组的均数差异;相关性采用Pearson相关检验。以P<0.05为差异有统计学意义。
结 果
1 大鼠体质量的变化及成模情况
各组大鼠实验起始(0 d)体质量无差异,从30 d开始,至实验结束,各模型组体质量明显高于其对照组(P<0.01)。随时间延长,两者体质量的差距虽然呈进行性增加,但其差距的增长幅度有所降低。IGT组20只大鼠,成模12只,成模率为60%,T2DM组20只死亡6只,其余的全部成模,见表1。

表1 各组不同时点体质量变化
**P<0.01vsIGT control;##P<0.05vsT2DM control.
2 各组大鼠生化指标检测结果
与各自对照组相比,IGT组和T2DM组血清FINS、TG、TC、HOMA-IR、ALT和肝组织TG水平明显升高(P<0.05);IGT组与其对照组相比,血清FBG、AST、ADRP和perilipin含量无显著差异(P>0.05);T2DM组与其对照组相比,血清FBG、AST和perilipin含量无显著差异(P>0.05),ADRP含量明显降低(P<0.01);与IGT组相比,T2DM组FBG、HOMA-IR和TC明显升高(P<0.01),FINS和肝组织的TG明显降低(P<0.01);IGT对照组与T2DM对照组相比,除ADRP含量显著降低外(P<0.01),其余各指标均无显著差异,见表2。
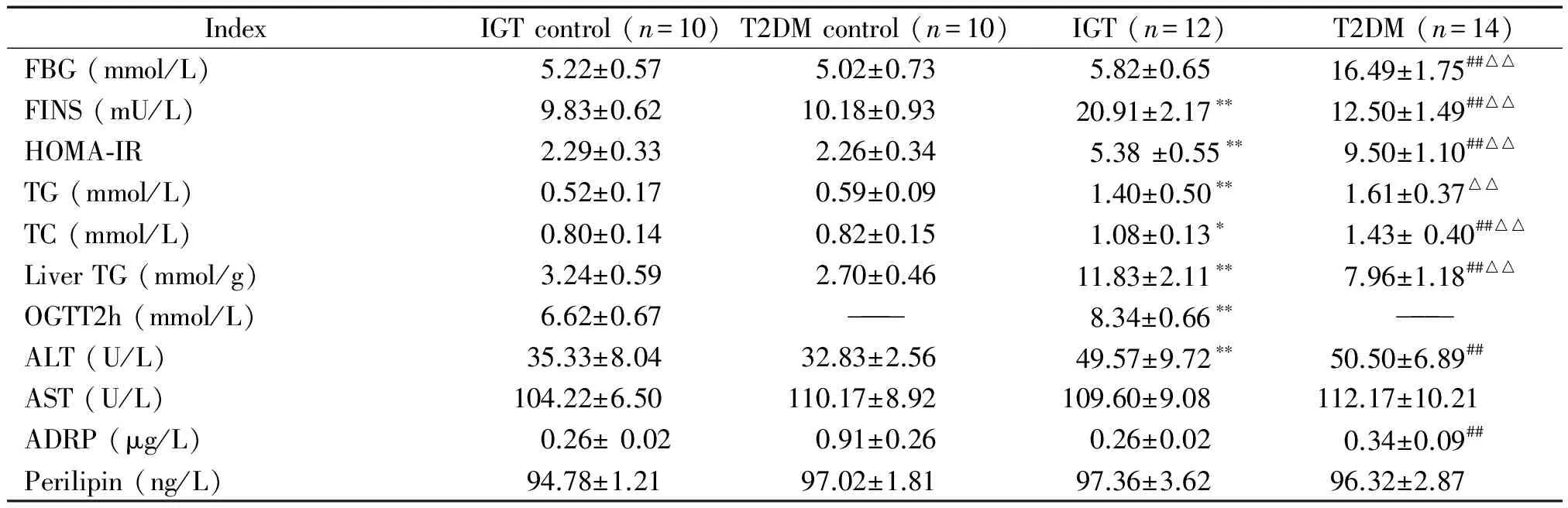
表2 各组大鼠生化指标检测结果
*P<0.05,**P<0.01vsIGT control;##P<0.01vsT2DM control;△△P<0.05vsIGT.
3 各组肝组织病理学变化
IGT对照组的肝组织基本正常,肝细胞结构基本完整清晰,偶见胞浆内有小脂滴;T2DM对照组肝组织正常,肝小叶结构完整,肝细胞排列整齐,形态规则;IGT组的肝细胞肿胀,胞浆内有大小不等的脂滴,部分脂滴形成大空泡,将细胞核挤向一侧,肝小叶结构破坏,肝细胞内有大量脂滴存在,肝脂肪变性明显并伴有炎症细胞浸润,可见点状或小灶性坏死;T2DM组的肝小叶结构紊乱,大部分肝细胞体积增大,大小不均,多数细胞内可见大小不等的脂滴,小叶内炎症细胞浸润,伴有散在的点状坏死,肝组织脂肪变性没有IGT组严重,见图1。
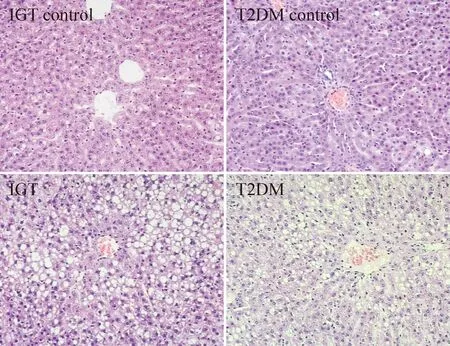
Figure 1.Morphological changes of the liver tissues in different groups (HE staining, ×200).
4 不同糖代谢大鼠肝脏组织perilipin和ADRP mRNA表达的变化
与各自对照组相比,IGT组和T2DM组的肝组织perilipin mRNA表达明显升高,分别是各自对照组的(1.87±0.28)倍和(2.17±0.13)倍(P<0.01);ADRP mRNA表达明显降低,分别是各自对照组的(77±14)%和(47±5)%(P<0.01);与IGT组相比,T2DM组perilipin mRNA表达升高(P<0.05),ADRP mRNA表达明显降低(P<0.01),见图2。
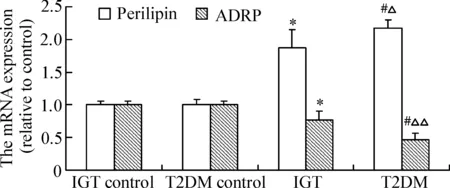
Figure 2.The mRNA expression of perilipin and ADRP in the liver tissues. Mean±SD. n=6. *P<0.01 vs IGT control; #P<0.05 vs T2DM control; △P<0.05, △△P<0.01 vs IGT.
5 不同糖代谢大鼠肝脏组织ADRP的蛋白表达水平
与各自对照组相比,IGT组和T2DM组的肝组织ADRP蛋白表达明显降低(均P<0.01);与IGT组相比,T2DM组的ADRP蛋白表达水平有所降低,但无显著差异(P>0.05),见图3。

Figure 3.The protein expression of ADRP in liver tissues. Mean±SD. n=6. **P<0.01 vs IGT control; ##P<0.01 vs T2DM control.
6 Perilipin和ADRP与各指标的相关性分析
相关分析结果显示,血清perilipin水平与各指标没有相关性,但肝组织perilipin mRNA表达与FBG、HOMA-IR、TG、TC、ALT及肝组织TG呈明显正相关(P<0.05),与血清ADRP含量和肝组织ADRP mRNA及蛋白表达呈明显负相关(P<0.01);血清ADRP含量与肝组织mRNA及蛋白表达呈明显正相关(P<0.01),与HOMA-IR、TG、ALT及肝组织TG呈明显负相关(P<0.05);肝组织ADRP mRNA及蛋白表达均与HOMA-IR、FINS、FBG、TG、TC、ALT和肝组织TG呈明显负相关(P<0.05)。
讨 论
本实验采用单纯高脂饲料喂养SD大鼠复制IGT模型,该模型组大鼠体重明显增加,12周时空腹血糖与对照组血糖相比无显著差异,但OGTT 2 h明显升高,达到了糖耐量受损的诊断标准,成模率为60%,且判断胰岛素抵抗的指标——HOMA-IR与对照组相比有显著差异,说明已形成胰岛素抵抗,肥胖IGT大鼠模型复制成功;以高脂饲料加小剂量STZ复制T2DM模型, 该组体重增加明显,空腹血糖比对照组明显升高,除个别死亡外,全部达到了T2DM的诊断标准,HOMA-IR也明显增大,说明T2DM模型制备成功。所制备的模型均具有高胰岛素血症、高脂血症、胰岛素抵抗和肝脏脂质沉积等特点,这些与临床相应的IGT和T2DM在生化指标方面相符,符合糖尿病发生发展的慢性病理过程。
IGT是一种糖代谢介于正常和糖尿病之间的血糖异常代谢状态,此阶段属于糖尿病前期,在此期间出现的症状未达到糖尿病标准,不易引起足够重视,但体内糖代谢平衡已破坏,成为T2DM及其并发症风险的一个重要诱因,因此IGT阶段的监测和干预具有重要意义。非酒精性脂肪肝就是糖耐量受损阶段以及2型糖尿病期间发生的并发症之一[7]。本实验肝脏HE染色显示,IGT组由于高脂饲料喂养相对较长,肝组织脂肪变性严重;T2DM组脂肪变性较IGT组有所减轻,IGT对照组虽未用高脂饲料喂养,但实验周期相对较长,体重增加也明显,肝组织内偶见脂肪变性细胞,T2DM对照组肝组织未见有脂肪变性细胞,这与生化检测指标相一致,能够代表不同糖代谢异常下肝组织的病理状态用于后续研究。
脂肪细胞最主要成分是细胞内脂滴,其表面覆盖如perilipin和ADRP等多种脂滴相关蛋白,这些蛋白对脂滴的代谢和调节具有重要作用[8],目前对于perilipin和ADRP的研究尚处于起步阶段,主要集中在脂解及肥胖等方面,而且在肥胖研究中存在争议[9-10],在糖异常状态下表达情况报道较少。因此本实验检测了糖代谢异常大鼠血清及肝脏组织中perilipin和ADRP的表达水平,探讨perilipin和ADRP在糖尿病发生发展过程中以及在糖代谢异常合并非酒精性脂肪肝中是否起一定的作用。实验结果显示,各组大鼠血清中perilipin含量无差异,但模型组肝组织中perilipin mRNA表达均明显升高,与Kenr等[10]在脂肪组织中的研究结果相一致。相关分析也表明肝组织perilipin mRNA表达与FBG、HOMA-IR、血清TG、肝组织TG呈明显正相关,说明perilipin的明显升高参与了糖代谢异常合并非酒精性脂肪肝的发生。 T2DM模型组较其对照组血清ADRP明显降低,在IGT模型组及对照组之间无显著差异,相关分析表明,血清ADRP含量与HOMA-IR、血清TG、血清ALT、肝组织TG呈明显负相关,说明血清ADRP在T2DM的形成中起一定的作用,而且IGT对照组其含量较T2DM对照组也明显降低,这似乎暗示,在糖代谢正常的情况下,体重对血清ADRP含量有很大的影响。但肝组织ADRP mRNA和蛋白表达水平均表明,模型组较各自的对照组均明显降低,与文献报道不一致[11],这可能与体内外实验的不同有关,有待进一步加以验证。相关分析表明,肝组织ADRP mRNA表达及蛋白表达均与HOMA-IR、FINS、FBG、TG、TC、ALT和肝组织TG呈明显负相关。说明ADRP明显降低参与了糖代谢异常合并非酒精性脂肪肝的发生。
综上所述,分别采用单纯高脂饲料喂养和高脂饲料加小剂量链脲佐菌素可以复制IGT模型和T2DM模型,能够代表不同糖代谢异常病理状态用于后续研究。血清perilipin水平各组间表达无显著差异,与胰岛素抵抗指数也无相关性;但血清ADRP含量较T2DM对照组明显降低,而且IGT对照组也明显降低,这说明除糖脂代谢异常影响血清ADRP的水平外,似乎体重对其影响也很明显。模型组肝组织perilipin mRNA表达均明显升高,ADRP mRNA和蛋白表达水平均明显降低,说明糖代谢异常合并非酒精性脂肪肝的发生可能与其perilipin表达的上调和ADRP表达的降低有关,其具体机制需进一步实验研究加以探讨。
[1] Bergman RN, Ader M. Free fatty acids and pathogenesis of type 2 diabetes mellitus[J]. Trends Endocrinol Metab, 2000, 11(9):351-356.
[2] Sztalryd C, Kimmel AR. Perilipins: lipid droplet coat proteins adapted for tissue-specific energy storage and utilization, and lipid cytoprotection[J]. Biochimie, 2014, 96: 96-101.
[3] Ohhira M, Motomura W, Fukuda M, et al. Lipopolysaccharide induces adipose differentiation-related protein expression and lipid accumulation in the liver through inhibition of fatty acid oxidation in mice[J]. J Gastroenterol, 2007, 42(12):969-978.
[4] 王 艳,刘 蔚,王 征. 应用链脲佐菌素构建SD大鼠2型糖尿病模型效果的研究[J].湖南农业科学, 2012, (7):130-132.
[5] 李 军,李秀钧,张 杰,等. 糖耐量受损大鼠胰岛α细胞高血糖素及神经肽Y的表达[J].中华内分泌代谢杂志, 2004, 20(3):185-189.
[6] 施 红,金国琴,余文珍. 诱导构建最佳类似人类2型糖尿病大鼠的造模方式[J]. 中国临床康复,2005, 9(39):69-71.
[7] 张林杉,卞 华,颜红梅,等. 2型糖尿病患者肝脏脂质含量与肝病结局的相关性研究[J]. 中华内分泌代谢杂志, 2014, 30(1):3-7.
[8] Cho SY, Shin ES, Park PJ, et al. Identification of mouse Prp19p as a lipid droplet-associated protein and its possible involvement in the biogenesis of lipid droplets[J]. J Biol Chem, 2007, 282(4):2456-2465.
[9] Mottagui-Tabar S, Rydén M, Löfgren P, et al. Evidence for important role of perilipin in the regulation of human adipocyte lipolysis[J]. Diabetologia, 2003, 46(6):789-797.
[10]Kenr AP, Di Gregorio G, Lu T, et al. Perilipin expression in human adaipose tissue. Is elevated with obesity[J]. J Clin Endocrinol Metab, 2004, 89(3):1352-1358.
[11]王 辉,陈 骁,项夏霖,等. 游离脂肪酸混合物对肝细胞脂毒性及脂代谢相关基因表达的影响[J]. 中国病理生理杂志, 2014, 30(7):1153-1157.
Expression of perilipin and ADRP in rat liver tissues with abnormal glucose metabolism
FAN Lin-hua1, LIU Mao-lin1, WEI Bing-yan1, LIU Tian-fu1, WANG Chun-fang1, PANG Wen-biao1, GUO Yong-chang1, LIU Jian-xin2
(1LaboratoryAnimalCenterofShanxiMedicalUniversity,ShanxiKeyLaboratoryofExperimentalAnimalsandAnimalMo-delsforHumanDiseases,Taiyuan030001,China;2109HospitalofShanxiProvince,Taiyuan030006,China.E-mail:jianxinliu_690101@sina.com)
AIM: To observe the changes of perilipin and adipose differentiation-related protein (ADRP) du-ring the development of diabetes mellitus and to explore the effect of perilipin and ADRP on abnormal glucose metabolism with non-alcoholic fatty liver disease (NAFLD). METHODS: The rat model of impaired glucose tolerance (IGT) was induced by feeding high-fat diet, and the type 2 diabetes mellitus (T2DM) model was induced by feeding high-fat diet for 4 weeks and intraperitoneally injecting streptozotocin. The morphological change of the liver tissue was observed under optical microscope. The serum contents of perilipin and ADRP were measured by ELISA. The mRNA expression of perilipin and ADRP in the liver tissues was detected by real-time PCR. The protein expression of ADRP in the liver tissues was determined by Western blotting. RESULTS: HE staining showed steatosis in the liver of the rats in IGT group was more serious than that in T2DM group. The biochemical and the pathological processes of rat models were consistent with the clinical feature of related diseases. The serum content of perilipin had no difference among various groups. The mRNA expression of perilipin in IGT group and T2DM group was significantly higher than that in control group. Compared with IGT group, the mRNA expression of perilipin in T2DM group was significantly increased. The serum content of ADRP in T2DM group was significantly lower than that in control group. The mRNA and protein expression of ADRP in model groups was significantly lower than that in control group. Compared with IGT group, the mRNA expression of ADRP in T2DM group was significantly reduced. CONCLUSION: The serum content of ADRP plays a role in the development and progression of T2DM. It is negatively correlated with HOMA-IR. NAFLD occurs during progression of abnormal glucose metabolism induced by feeding high-fat diet. The development of abnormal glucose metabolism with NAFLD is probably related to the increased expression of perilipin and the reduced expression of ADRP.
Perilipin; Adipose differentiation-related protein; Impaired glucose tolerance; Type 2 diabetes mellitus
1000- 4718(2015)03- 0534- 05
2014- 08- 18
2014- 12- 24
山西省实验动物专项资金资助项目(No. 2013k11); 山西医科大学科技创新基金资助项目(No.01201425)
△通讯作者 Tel: 0351-2676672; E-mail: jianxinliu_690101@sina.com
R363.2
A
10.3969/j.issn.1000- 4718.2015.03.026
