系统性红斑狼疮中A20表达特点的研究*
2015-04-15朱丽花陈少华杨力建吴秀丽李扬秋
张 帆, 朱丽花, 王 旭, 陈少华, 杨力建, 吴秀丽, 李 萡, 周 毅, 李扬秋,△
( 1广东药学院生命科学与生物制药学院广东省生物技术候选药物研究重点实验室,广东 广州 510006; 暨南大学 2医学院血液病研究所, 3第一附属医院风湿免疫科, 4再生医学教育部重点实验室,广东 广州 510632)
系统性红斑狼疮中A20表达特点的研究*
张 帆1,2, 朱丽花3, 王 旭4, 陈少华2, 杨力建2, 吴秀丽2, 李 萡2, 周 毅3, 李扬秋2,4△
(1广东药学院生命科学与生物制药学院广东省生物技术候选药物研究重点实验室,广东 广州 510006; 暨南大学2医学院血液病研究所,3第一附属医院风湿免疫科,4再生医学教育部重点实验室,广东 广州 510632)
目的: 了解系统性红斑狼疮(SLE)患者外周血中肿瘤坏死因子α诱导蛋白3(TNFAIP3,也称A20)、核因子κB(NF-κB)、黏膜相关淋巴瘤易位基因1(MALT1)及其转录本1(MALT1V1)的mRNA表达特点。方法: 采用real-time PCR法检测21例SLE患者(其中合并硬皮症2例,合并类风湿关节炎1例,合并淋巴瘤1例)及31例健康人外周血单个核细胞(PBMC)中MALT1、A20、NF-κB和MALT1V1 mRNA的表达情况。结果: SLE样本中,A20 mRNA表达水平较健康人明显降低(P<0.01),MALT1和NF-κB也较健康人降低(P<0.01)。在健康人组,A20和NF-κB mRNA的表达水平未呈现明显相关性,MALT1和NF-κB则呈正相关(P<0.05);而在SLE组中,A20和NF-κB mRNA则显示出显著正相关(P<0.05),MALT1和NF-κB则不存在相关性。SLE中MALT1V1表达量显著低于正常人(P<0.05),相关性研究还显示,健康人中A20和MALT1V1存在正相关关系(P<0.01),在SLE中则不存在(P>0.05)。结论: 本研究首先提供了MALT1-A20-NF-κB通路在SLE中的表达特点。SLE患者异常低表达A20,这可能与患者低免疫耐受相关,其与NF-κB表达的正相关性情况可能与其它因素的调控有关,有待进一步证实。
系统性红斑狼疮; A20; MALT1; NF-κB
系统性红斑狼疮(systemic lupus erythematosus,SLE)是自身免疫介导、以免疫性炎症为突出表现的弥漫性结缔组织病。SLE患者发病机制尚不十分明确,主要表现为自身免疫调节紊乱,预后差。研究表明, 免疫系统失衡在SLE发病中发挥了重要作用,从而导致免疫细胞活化和促炎因子的增多。免疫系统活化导致靶器官自身免疫复合物的沉积和组织破坏性T细胞的渗入,而促炎因子则有助于免疫活化状态的维持。
A20,也称为肿瘤坏死因子α诱导蛋白3(tumor necrosis factor α-induced protein 3,TNFAIP3),A20基因定位于染色体6q23.3,其cDNA序列为4 440 bp,其开放读码框为2 370 bp,编码790氨基酸的90 kD蛋白。A20蛋白在羧基末端含有7 个Cys2-Cys2 锌指(zinc finger,ZnF)基序,是一种新类型的锌指蛋白,这些锌指基序是NF-κB 信号转导作用所必须的。而A20 的氨基端则含有一个基序,称为卵巢肿瘤基序(ovarian tumor domain,OTU),具有去泛素化蛋白酶活性作用。因此A20具有肿瘤抑制因子及炎症信号转导的中心调节因子NF-κB抑制因子的双重功能[1-4]。它在天然免疫和过继性免疫调节中发挥了重要作用,对免疫动态平衡有重要的调节作用[5]。A20缺失与炎症介导的自身免疫性疾病和淋巴细胞肿瘤的发生发展关系密切[5-6]。近年研究发现,A20作为炎症调控因子对SLE的发生发展起着重要的作用,A20基因的缺失、突变和甲基化与SLE的发生关系密切[7-10]。而黏膜相关淋巴瘤易位基因1 (mucosa-associated lymphoid tissue lymphoma translocation gene 1,MALT1)是NF-κB信号通路中的一种调控蛋白,在T细胞受体(T-cell receptor,TCR)介导的NF-κB的活化和调控淋巴细胞增殖和分化的过程中具有重要作用[11- 12]。基因库资料显示MALT1存在2种转录本,转录本2(MALT1V2)比转录本1(MALT1V1)缺少 33 个碱基,但未有2种转录本在正常人、血液肿瘤和免疫系统疾病中分布特点的报道。同时,MALT1作为一种蛋白酶可水解NF-κB负性调控因子A20。因此,A20和MALT1有可能在SLE 的发病中具有一定作用。MALT1在淋巴瘤和白血病中的作用及其与A20关系已有一定研究,但其在SLE患者中是否扮演一样的角色还未见报道。同样,尽管已发现A20基因的一些单核苷酸多态性可能是SLE的易感位点,但A20在SLE患者中的表达情况研究尚不充分,其调控机制也不明确。本研究通过观察SLE 患者和正常人外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)中MALT1、A20和NF-κB mRNA的表达特点及其与SLE 疾病状态的关系,期望进一步了解SLE细胞异常的分子机制。
材 料 和 方 法
1 样本收集
收集暨南大学附属华侨医院2008年至2011年确诊的SLE患者外周血标本21例(其中合并硬皮症2例,合并类风湿关节炎1例,合并弥漫大B细胞淋巴瘤1例,无合并症17例),另收集31例健康人外周血标本作为对照组。
2 方法
2.1 RNA提取及cDNA合成 RNA提取采用TRIzol试剂盒(Invitrogen)提取RNA。另外,采用反转录酶试剂盒( BD)反转录合成cDNA 第1链;用RT-PCR 检测β2-微球蛋白(β2-microglobulin, β2M)mRNA的表达情况以检验所合成cDNA 的质量。
2.2 引物设计 根据MALT1基因(Accession No: NM_006785, NM_173844),A20基因 (Accession No: NM_006290) 和NF-κB基因设计,引物均由上海英潍捷基有限公司合成。以β2M作为内参照设计上、下游引物,各引物序列见表1[13]。

表1 Real-time PCR使用的引物
2.3 实时定量PCR 利用SYBR GreenⅠ染料进行各基因的实时荧光定量PCR检测,扩增总反应体系为20 μL,应用Real Master Mix试剂盒(Tiangen),其中包括2×Real Mastr Mix 10 μL、10 mmol/L上、下游引物0.5 μL 以及1 μL cDNA。每1个标本均设复孔,每1个基因均设1个阴性对照孔。反应条件为95 ℃预变性15 min后,共进行45个循环扩增,每一循环包括95 ℃ 15 s,60 ℃ 40 s。随后,以0.17 ℃/s变化速度从55 ℃到95 ℃,每隔2 s记录1次荧光值,获得熔解曲线。反应在CFX96荧光定量PCR仪(Bio-Rad)中进行[14]。
2.4 mRNA表达水平的计算方法 采用相对定量法分别分析SLE患者和健康人外周血细胞中MALT1、A20、NF-κB mRNA表达水平的差异,以β2M为内参照,利用Ct值,计算SLE患者和健康人各基因的相对表达量。相对定量法的计算公式为2-ΔΔCt[15]。
3 统计学处理
利用SPSS 17.0软件进行相关分析 SLE组和健康人组A20/MALT1/NF-κB mRNA,检测数据以中位数表示,各组mRNA表达水平比较采用秩和检验(Wilcoxon),并采用Pearson’s correlation进行相关性分析,以P<0.05为差异有统计学意义。
结 果
1 MALT1、A20和NF-κB mRNA在SLE中的表达水平
Real-time PCR结果显示,SLE组和健康对照组样本均表达MALT1、A20和NF-κB mRNA,在健康对照组中,各样本之间MALT1、A20和NF-κB的表达水平比较接近,在SLE患者中3种mRNA的表达水平差异较大,应用独立样本秩和检验进行分析发现,在SLE患者中,A20的表达水平显著低于健康对照组(P<0.01),MALT1表达水平低于健康对照组(P<0.01),NF-κB的表达水平较健康对照组也明显减低(P<0.05)。根据其表达水平特点,分为高表达和低表达2组(P<0.01);此外,根据SLE合并其它疾病与否分为2组,合并其它疾病组4例,均为A20低表达(P<0.01),见表2。

表2 健康对照和SLE组中A20、MALT1和NF-κB mRNA的相对表达水平
HI: healthy individuals.**P<0.01vsHI.
另外,我们还分别分析A20高或低表达组及有无合并症组样本mRNA的表达水平差异,结果显示这些组间并无显著差异(P>0.05)。
2 SLE中MALT1两种转录本的表达特点
根据NCBI基因库报道,MALT1有2种转录本,两者的表达水平在不同细胞和疾病中存在差异[16-17]。本研究分别检测同时含有2种MALT1转录本和仅含MALT1转录本1的PCR产物[16],通过MALT1V1/MALT1可间接得出HALT1V2表达量。进一步比较正常人、SLE样本中MALT1两种转录本的表达情况,结果可见,所有样本均表达2种转录本,在正常人和SLE的大多数样本中MALT1V2比MALT1V1表达量要高。SLE组的MALT1V1表达量与正常人比较显著降低(P<0.05)。MALT1V1/MALT1百分比表达稍高于正常人,但无统计学意义(P>0.05),见表3。

表3 健康人和SLE中MALT1两个转录本相对表达情况
HI: healthy individuals.*P<0.05vsHI.
3 SLE中A20、NF-κB和MALT1两个转录本表达水平相关性
理论上,MALT1-A20-NF-κB信号分子的表达水平之间应存在一定的相关性,在健康对照组中,可以发现MALT1和NF-κB的表达水平呈现正相关(P<0.05),见图1。MALT1V1、MALT1V1/MALT1百分比和A20呈现明显负相关(P<0.05),见图2、3。而MALT1和A20,A20和NF-κB表达水平之间无显著的相关性(P>0.05)。在SLE患者组中,A20和NF-κB则存在明显正相关(P<0.01),见图1。而MALT1和A20、MALT1和NF-κB则不存在明显相关性(P>0.05)。

Figure 1.Correlations between NF-κB expression and A20 or MALT1V1 in healthy group and SLE group.
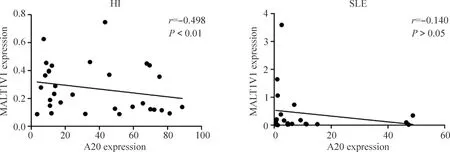
Figure 2.Correlations between expression of A20 and MALT1V1 in healthy group and SLE group.

Figure 3.Correlations between expression of A20 and MALT1V1 in healthy group and SLE group.
讨 论
SLE是一种涉及多个免疫调节基因功能异常的慢性炎症性疾病。而A20基因在负性免疫调节中起着关键作用。我们的研究结果显示在SLE中A20基因表达明显降低,而NF-κB、MALT1基因表达也存在下调趋势。SLE患者中A20与NF-κB基因的表达显示明显正相关,而MALT1与NF-κB、A20和MALT1V1、MALT1V1/MALT1百分比的正相关关系则被打破。国内外研究表明,A20是NF-κB的负调控因子,但本研究结果却显示在SLE中,两者呈正相关关系,这可能与NF-κB同时接受其它因素的调控有关。在正常人中因MALT1(本研究结果提示主要为MALT1V1调控作用)对A20具有水解酶作用,MALT1间接调控NF-κB改变,从而影响T细胞的活化和增殖,形成了精密的MALT1-A20-NF-κB信号调节途径。然而在SLE中,MALT1并未见到对A20有抑制作用,从而失去了对NF-κB的调控能力。我们推测,其它异常因素的调控使得A20虽在mRNA水平表达下降,却仍然出现了NF-κB表达下降,T细胞免疫功能也受到抑制。而MALT1和MALT1V1降低这一现象可能是由于A20表达下降后使对A20具有降解作用的MALT1反馈性降低引起,而它是否与SLE病程和治疗情况有关尚待进一步研究。我们在多发性骨髓瘤病人中,也发现类似的改变特点[18],提示NF-κB表达可能涉及多重调控。本文首次报道了SLE中A20的调控因素MALT1的表达特点,分析了其2个转录本的分布情况。健康人A20和MALT1V1存在的负相关关系在SLE患者中被打破,这可能由于A20功能异常或MALT1V1之外的其它调控因素作用的结果,但由于尚未有其它研究报道SLE中MALT1的改变特点,2个转录本的功能也不明确,尚需做进一步研究。
根据目前研究,A20表达异常导致SLE的病理机制可归纳为以下几方面:(1)A20的低表达造成自身反应性T细胞过度活化,这是SLE的关键致病因素。A20通过去泛素化MALT1扰乱TCR信号向NF-κB的传递,从而抑制T细胞的活化[19],进而引起组织器官损害;(2)A20的降低增强了自身免疫复合物的沉积,这也是SLE的重要特点。A20阻碍了B细胞和树突状细胞的生成和活化[20-21]。A20在B细胞中的缺失增加了B细胞的增殖和自身抗体的生成[22]。因此,A20 的低表达导致B细胞的过度活化和自身抗体的聚积;(3)A20的低表达促使IL-4 、IL-6、TNF-α和IFN-γ等促炎症因子的血清水平升高,这是SLE的另一个特性[23-24]。A20缺失小鼠血清中含高水平的炎症细胞因子,并表现为持续性的NF-κB活化和巨噬细胞产生高水平的TNF-α[25]。A20在RA和其它自身免疫性疾病中的低表达同样证明这一机制[26-27]。总之,由于通常情况下A20对多种免疫细胞的活化具有调控作用,而当A20表达降低时可引起异常的免疫应答,是SLE发生中的一个重要因素。而造成A20低表达原因可能与调控A20的上游分子如MALT1,以及A20基因的突变、缺失或启动子甲基化等相关[10, 28],至于在本研究中SLE病人样本A20基因是否同样存在基因突变等,还有待后续的研究。
总之,在本研究中,我们首次报道了SLE中MALT1- A20-NF-κB表达模式的特点和MALT1两个转录本的分布情况。总的来说,SLE患者出现了A20的低表达和功能异常,而SLE的发生提示NF-κB可能受除A20以外的其它因素调节或A20存在转录后水平的调控,其可能与疾病的缓解和治疗有关。此外,我们的研究仅限于real-time PCR方法检测mRNA水平表达,蛋白定量和机理的阐明还有待下一步的研究,并期望能明确T细胞中A20、MALT1V1和MALT1V2的功能及其与SLE疾病转归的相关性。
[1] Dixit VM, Green S, Sarma V, et al. Tumor necrosis factor-alpha induction of novel gene products in human endothelial cells including a macrophage-specific chemotaxin[J]. J Biol Chem,1990, 265(5):2973-2978.
[2] Opipari AW Jr, Boguski MS, Dixit VM. The A20 cDNA induced by tumor necrosis factor alpha encodes a novel type of zinc finger protein[J]. J Biol Chem, 1990, 265(25):14705-14708.
[3] Hymowitz SG, Wertz IE. A20: from ubiquitin editing to tumour suppression[J]. Nat Rev Cancer, 2010, 10(5):332-341.
[4] Bosanac I, Wertz IE, Pan B, et al. Ubiquitin binding to A20 ZnF4 is required for modulation of NF-kappaB signaling[J]. Mol Cell,2010, 40(4):548-557.
[5] Shembade N, Harhaj EW. Regulation of NF-kappaB signaling by the A20 deubiquitinase[J]. Cell Mol Immunol,2012, 9(2):123-130.
[6] Zhang F, Yang L, Li Y. The role of A20 in the pathoge-nesis of lymphocytic malignancy[J]. Cancer Cell Int, 2012, 12:44.
[7] Vereecke L, Beyaert R, van Loo G. Genetic relationships betweenA20/TNFAIP3, chronic inflammation and autoimmune disease[J]. Biochem Soc Trans,2011, 39(4):1086-1091.
[8] Musone SL, Taylor KE, Lu TT, et al. Multiple polymorphisms in theTNFAIP3 region are independently associa-ted with systemic lupus erythematosus[J]. Nat Genet, 2008, 40(9):1062-1064.
[9] Adrianto I, Wen F, Templeton A, et al. Association of a functional variant downstream ofTNFAIP3 with systemic lupus erythematosus[J]. Nat Genet, 2011, 43(3):253-258.
[10]Frenzel LP, Claus R, Plume N, et al. Sustained NF-kappaB activity in chronic lymphocytic leukemia is indepen-dent of genetic and epigenetic alterations in the TNFAIP3 (A20) locus[J]. Int J Cancer, 2011, 128(10):2495-2500.
[11]Thome M. Multifunctional roles for MALT1 in T-cell activation[J]. Nat Rev Immunol, 2008, 8(7):495-500.
[12]Oshima N, Ishihara S, Rumi MA, et al. A20 is an early responding negative regulator of Toll-like receptor 5 signalling in intestinal epithelial cells during inflammation[J]. Clin Exp Immunol, 2010, 159(2):185-198.
[13]Zha X, Yan X, Shen Q, et al. Alternative expression of TCRzeta related genes in patients with chronic myeloid leukemia[J]. J Hematol Oncol, 2012, 5:74.
[14]曾可静,李 萡,牛宇哲,等.职业苯接触工人外周血T-bet 和GATA-3 表达变化的特点[J].中国病理生理杂志, 2011,27(9): 1807-1810.
[15]Stams WA, den Boer ML, Beverloo HB, et al. Sensitivity to L-asparaginase is not associated with expression levels of asparagine synthetase in t(12;21)+pediatric ALL[J]. Blood, 2003, 101(7):2743-2747.
[16]王 旭,张 帆,徐 艳,等.MALT1基因2种转录本在正常人和B细胞白血病中的表达特点[J]. 中国病理生理杂志,2013, 2(6):1124-1128,1132.
[17]Shi L, Chen S, Lu Y, et al. Changes in the MALT1-A20-NF-kappaB expression pattern may be related to T cell dysfunction in AML[J]. Cancer Cell Int, 2013, 13:37.
[18]王 旭,徐 玲,张 帆,等. MALT1-A20-NF-κB 信号分子在MM中的表达特点[J].暨南大学学报:自然科学与医学版,2013, 34(4):373-377.
[19]Duwel M, Welteke V, Oeckinghaus A, et al. A20 negatively regulates T cell receptor signaling to NF-kappaB by cleaving Malt1 ubiquitin chains[J]. J Immunol, 2009, 182(12):7718-7728.
[20]Tavares RM, Turer EE, Liu CL, et al. The ubiquitin modifying enzyme A20 restricts B cell survival and prevents autoimmunity[J]. Immunity, 2010, 33(2):181-191.
[21]Kool M, van Loo G, Waelput W, et al. The ubiquitin-editing protein A20 prevents dendritic cell activation, recognition of apoptotic cells, and systemic autoimmunity[J]. Immunity, 2011, 35(1):82-96.
[22]Hovelmeyer N, Reissig S, Xuan NT, et al. A20 deficiency in B cells enhances B-cell proliferation and results in the development of autoantibodies[J]. Eur J Immunol, 2011, 41(3):595-601.
[23]Apostolidis SA, Lieberman LA, Kis-Toth K, et al. The dysregulation of cytokine networks in systemic lupus erythematosus[J]. J Interferon Cytokine Res, 2011, 31(10):769-779.
[24]Ohl K, Tenbrock K. Inflammatory cytokines in systemic lupus erythematosus[J]. J Biomed Biotechnol, 2011, 2011:432595.
[25]Matmati M, Jacques P, Maelfait J, et al. A20 (TNFAIP3) deficiency in myeloid cells triggers erosive polyarthritis resembling rheumatoid arthritis[J]. Nat Genet, 2011, 43(9):908-912.
[26]Igarashi H, Yahagi A, Saika T, et al. A pro-inflammatory role for A20 and ABIN family proteins in human fibroblast-like synoviocytes in rheumatoid arthritis[J]. Immunol Lett, 2012, 141(2):246-253.
[27]Dieude P, Guedj M, Wipff J, et al. Association of theTNFAIP3 rs5029939 variant with systemic sclerosis in the European Caucasian population[J]. Ann Rheum Dis, 2010, 69(11):1958-1964.
[28]Chanudet E, Huang Y, Ichimura K, et al. A20 is targeted by promoter methylation, deletion and inactivating mutation in MALT lymphoma[J]. Leukemia, 2010, 24(2):488-489.
Expression of A20 in patients with systemic lupus erythematosus
ZHANG Fan1, 2, ZHU Li-hua3, WANG Xu4, CHEN Shao-hua2, YANG Li-jian2, WU Xiu-li2, LI Bo2, ZHOU Yi3, LI Yang-qiu2, 4
(1GuangdongProvincialKeyLaboratoryofBiotechnologyCandidateDrugResearch,CollegeofLifeScienceandBio-pharmacopedics,GuangdongPharmaceuticalUniversity,Guangzhou510006,China;2InstituteofHematology,SchoolofMedicine,3DepartmentofHematology,FirstAffiliatedHospital,4ChinaKeyLaboratoryforRegenerativeMedicineofMinistryofEducation,JinanUniversity,Guangzhou510632,China.E-mail:jnyangqiuli@163.com)
AIM: To investigate the expression and regulation of A20 in healthy individuals and the patients with systemic lupus erythematosus (SLE). METHODS: The expression levels of A20, NF-κB, MALT1, and MALT1V1 in peripheral blood mononuclear cells (PBMC) of the patients with SLE (including 2 cases with scleroderma, 1 case with rheumatoid arthritis, and 1 case with lymphoma) were analyzed by real-time PCR. RESULTS: A significantly lower A20 expression level was found in the PBMC from SLE group compared with the healthy controls, while the expression levels of MALT1 and NF-κB were also decreased. In addition, no significant correlation between A20 and NF-κB expression levels in healthy group was observed, but a positive correlation was found in SLE group (P<0.05). A significant positive correlation between MALT1 and NF-κB expression levels in healthy group (P<0.05) was observed, and no significant correlation was found in SLE group. The expression level of MALT1V1 in SLE group was significantly lower than that in healthy control group, and there was a positive correlation between A20 and MALT1V1 in healthy volunteers (P<0.01), but that did not exist in SLE group. CONCLUSION: The characteristics of the expression pattern of MALT1-A20-NF-κB in the SLE patients were presented. Lower level of A20 expression was found in the SLE patients, in particular with other autoimmune disease or lymphomas, indicating the lower immune tolerance in SLE. The positive correlation of A20 and NF-κB may relate to positive regulation of MALT1.
Systemic lupus erythematosus; A20; MALT1; NF-κB
1000- 4718(2015)03- 0518- 06
2014- 08- 06
2015- 01- 20
国家自然科学基金资助项目(No. 91129720)
△通讯作者 Tel: 020-85226877; E-mail: jnyangqiuli@163.com
R363.2; R593.24+1
A
10.3969/j.issn.1000- 4718.2015.03.023
