远程缺血预处理对大鼠体外循环后肺损伤的保护作用及机制探讨
2015-04-14梁东科刘国锋梁蓓薇韦秋英刘菊梅张炳东
涂 杰,梁东科,刘国锋,梁蓓薇,韦秋英,刘菊梅,张炳东
(广西医科大学第一附属医院心血管病研究所手术麻醉室,广西 南宁 530021)
远程缺血预处理对大鼠体外循环后肺损伤的保护作用及机制探讨
涂 杰,梁东科,刘国锋,梁蓓薇,韦秋英,刘菊梅,张炳东
(广西医科大学第一附属医院心血管病研究所手术麻醉室,广西 南宁 530021)
目的 评价远程缺血预处理(RIPC)对大鼠体外循环(CPB)后肺损伤的保护作用并探讨相关机制。方法成年雄性SD大鼠60只,随机分为三组(n=20):假手术组(S组)、CPB组和RIPC+CPB组。S组行麻醉和穿刺但不行CPB;CPB组采用尾动脉插管灌注,右颈静脉插管引流建立CPB模型;RIPC+CPB组在实施CPB前对后肢进行RIPC(通过驱血带阻断后肢血流10 min,复灌10 min,两侧后肢交替进行,每侧进行3次)。麻醉复苏后2 h采集上腔静脉血样,测定血清TNF-α和IL-6浓度,然后处死大鼠取肺组织,测定肺湿/干重比值(W/D比值)、丙二醛(MDA)含量和谷胱甘肽过氧化物酶(GSH-px)活性,光镜下观察病理学改变。结果与S组比较,CPB组和RIPC+CPB组血清TNF-α和IL-6浓度升高,肺组织W/D比值和MDA含量升高,GSH-px活性降低(P<0.05);与CPB组比较,RIPC+CPB组血清TNF-α和IL-6浓度下降,肺组织W/D比值和MDA含量下降,GSH-px活性升高(P<0.05)。HE染色显示RIPC+CPB组肺组织的形态学损伤轻于CPB组。结论RIPC可减轻大鼠CPB后肺损伤,其机制与抑制炎性反应和脂质过氧化反应有关。
远程缺血预处理;体外循环;肺损伤
体外循环(Cardiopulmonary bypass,CPB)诱发的肠道内毒素转移、缺血再灌注损伤和全身炎性反应等均可引起不同程度的肺损伤,轻者仅表现为亚临床症状的功能改变,重者则表现为急性呼吸窘迫综合征,严重影响术后肺功能的恢复[1]。远端缺血预处理(Remote ischemic preconditioning,RIPC)指通过对一个组织或器官进行短暂的非致死性缺血再灌注后,可加强远隔脏器对随后较长时间缺血的耐受能力。RIPC实施方便,对机体几乎无损伤,可明显减轻远隔脏器缺血再灌注损伤,但具体机制尚不清楚[2]。因此,本研究拟采用大鼠CPB模型,观察RIPC对大鼠CPB后肺损伤的影响,并探讨相关机制,为临床应用提供依据。
1 材料与方法
1.1 主要仪器与试剂 S5型多功能监测仪(美国Datex-ohmeda公司),StockertⅢ型双头滚压泵(德国Stockert公司),小动物膜式氧合器(东莞科威医疗器械有限公司),肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)试剂盒(北京科美东雅生物技术有限公司),丙二醛(MDA)和谷胱甘肽过氧化物酶(GSH-px)试剂盒(南京建成生物工程研究所)。
1.2 动物选择及分组 本实验经广西医科大学动物委员会批准,并符合国家科技部《关于善待实验动物的指导性意见》的规定。成年雄性SD大鼠60只,清洁级,6~8个月龄,体重400~450 g,由广西医科大学实验动物中心提供。采用随机数字表法分为三组:假手术组(S组)、CPB组和RIPC+CPB组,每组20只。S组仅于麻醉诱导后行机械通气和各部位插管,不行CPB;CPB组建立CPB模型;RIPC+CPB组实施CPB前,对后肢行RIPC。
1.3 RIPC方法 通过驱血带阻断后肢血流10 min,复灌10 min,两侧后肢交替进行,每侧进行3次,阻断压力以多普勒血流探测仪监测后肢动脉搏动正好消失为宜,方法同文献[3]。
1.4 CPB模型制备 参照文献[4]制作大鼠CPB模型。腹腔注射10%乌拉坦10 ml/kg麻醉,16G静脉导管行气管插管后机械通气。采用尾动脉插管灌注,右颈静脉插管引流建立循环通路。无血预充,灌注流量约为100 ml/kg,氧流量与灌注流量之比为0.8,通过变温装置保持肛温37℃,α稳态管理血气,术中加入新鲜大鼠肝素血,维持血细胞比容在0.20~0.25。CPB转流2 h后停机,管道剩余血液经离心浓缩后缓慢回输。待自主呼吸恢复平稳后停止机械通气,拔除气管导管,并密切观察大鼠麻醉复苏后生命体征。
1.5 标本采集及检测
1.5.1 血清TNF-α和IL-6浓度的检测 麻醉复苏后2 h,采集上腔静脉血5 ml,4℃下3 000 r/min离心5 min后取上清液,按试剂盒说明书以双抗体夹心酶联免疫吸附法检测TNF-α和IL-6浓度。
1.5.2 肺湿/干重比值(W/D比值)测定 大鼠上腔静脉血标本采集完毕后,剖胸取左肺下叶,滤纸吸去表面血迹后称湿质量,然后置于70℃烤箱内烘干至恒重,称干质量,计算W/D比值。
1.5.3 肺组织MDA含量和GSH-px活性测定取右肺下叶,滤纸吸干表面污物,制备10%组织匀浆,考马斯亮蓝法测定匀浆内蛋白浓度,然后按试剂盒说明书测定MDA含量和GSH-px活性。
1.5.4 肺组织病理学情况观察 取左肺上叶组织,4%多聚甲醛固定,石蜡包埋切片,HE染色,光镜下观察病理学情况。
1.6 统计学方法 采用SPSS15.0统计学软件进行分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理学观察结果 S组肺组织结构完整,无明显充血、水肿及炎性细胞浸润;CPB组肺间质水肿、出血,肺泡间隔增宽,肺泡腔内可见大量炎性细胞浸润;RIPC+CPB组肺间质略水肿,少量出血,肺泡间隔轻度增宽,肺泡腔内少量炎性细胞浸润,见图1。

图1 光镜下三组肺组织病理学检查结果(HE染色,×100)
2.2 血清TNF-α和IL-6浓度比较 与S组比较,CPB组和RIPC+CPB组血清TNF-α和IL-6浓度升高(P<0.05);与CPB组比较,RIPC+CPB组血清TNF-α和IL-6浓度下降(P<0.05),见表1。
2.3 肺组织W/D比值、MDA含量和GSH-px活性比较 与S组比较,CPB组和RIPC+CPB组肺组织W/D比值和MDA含量升高,GSH-px活性降低(P<0.05);与CPB组比较,RIPC+CPB组肺组织W/D比值和MDA含量下降,GSH-px活性升高(P<0.05),见表1。
表1 三组大鼠血清TNF-α、IL-6、肺组织W/D比值、MDA和GSH-px活性比较(n=20,±s)
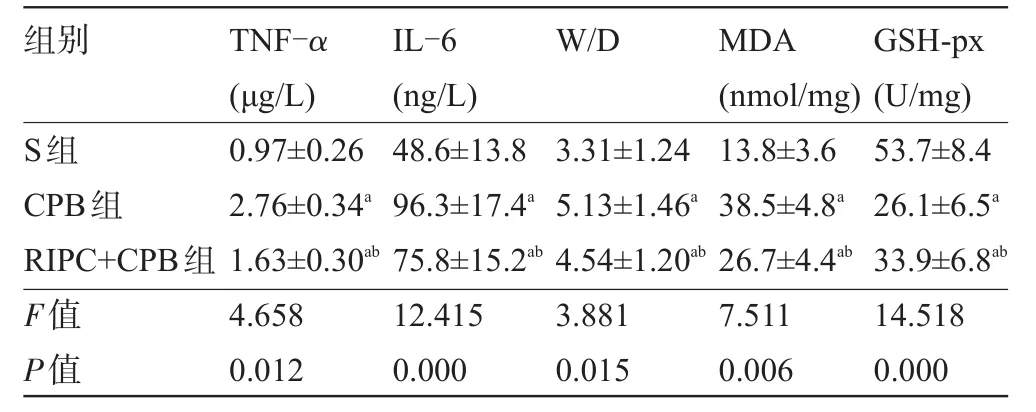
表1 三组大鼠血清TNF-α、IL-6、肺组织W/D比值、MDA和GSH-px活性比较(n=20,±s)
注:a与S组比较,P<0.05;b与CPB组比较,P<0.05。
F值P值14.518 0.000 4.658 0.012 12.415 0.000 3.881 0.015 7.511 0.006
3 讨论
本研究采用尾动脉插管灌注,右颈静脉插管引流的方法建立大鼠CPB模型,实现了接近生理的全流量转流,并使用微型动物膜式氧合器,实现无血预充,从而模拟了临床CPB的转流过程,且各组大鼠均于转流2 h后顺利停机,并于自主呼吸恢复后拔除气管导管,且存活,说明CPB模型制备成功。本研究结果显示,大鼠CPB后肺组织W/D比值增加,肺间质出血、水肿,肺泡间隔增宽,肺泡腔内大量炎性细胞浸润,提示CPB可造成一定程度的肺损伤,这与Chen等[5]的研究一致。
Dong等[6]研究表明,肺脏本身的缺血预处理可减轻肺组织的缺血再灌注损伤,但阻断肺动脉可损伤血管内膜,且短暂缺血亦可造成肺上皮细胞损伤,因此限制了其临床应用,而RIPC实施方便,对机体几乎无损伤,可较好地避免上述缺陷[2]。本研究参照文献[3]的方法,在大鼠CPB前实施RIPC干预,结果表明,与CPB组比较,RIPC+CPB组W/D比值下降,肺组织病理学改变减轻,提示RIPC可减轻大鼠CPB后的肺损伤。
目前所能检测到的与CPB后肺损伤有明确关系的炎性因子主要包括TNF-α、IL-1β、IL-6、IL-8和IL-10[7-8]。其中TNF-α是主要的促炎因子,可通过多种途径引起肺损伤;IL-6是炎性因子积聚的主要因素,并促进炎性因子进一步释放,其水平与CPB炎性反应导致的组织损伤有密切关系。Goebel等[9]通过动物实验证实,CPB后大鼠血清中TNF-α和IL-6水平即有增加,CPB结束后2 h达到高峰,本研究亦证实了这一观点。而RICP干预后,可显著降低血清中TNF-α和IL-6浓度,且肺组织W/D比值下降,肺组织病理学损伤减轻,提示RICP减轻大鼠CPB后肺损伤的机制,可能与抑制炎性反应有关。
MDA是脂质过氧化反应的产物,并间接反映组织受自由基攻击的程度;GSH-px可特异的催化还原型谷胱甘肽对过氧化氢的还原反应,间接反映组织清除自由基的能力[10]。本研究结果显示,大鼠CPB后肺组织MDA浓度增高,GSH-px活性下降,而实施RICP干预后,肺组织MDA浓度下降,GSH-px活性升高,且肺组织W/D比值下降,肺组织病理学损伤减轻,说明RICP可减少大鼠CPB后氧自由基的释放,减轻肺组织细胞的损伤。
综上所述,RIPC可减轻大鼠CPB后肺损伤,其机制可能与抑制炎性反应和脂质过氧化反应有关。但RIPC实施的最适时机和持续时间有待进一步研究。
[1]Young RW.Prevention of lung injury in cardiac surgery:a review [J].J Extra Corpor Technol,2014,46(2):130-141.
[2]符传艺,王鹏程,赵建农,等.远程缺血预处理的研究进展[J].海南医学,2011,22(23):137-140.
[3]Hu X,Lu Y,Zhang Y,et al.Remote ischemic preconditioning improves spatial learning and memory ability after focal cerebral ischemia-reperfusion in rats[J].Perfusion,2013,28(6):546-551.
[4]Fujii Y,Shirai M,Tsuchimochi H,et al.Hyperoxic condition promotes an inflammatory response during cardiopulmonary bypass in a rat model[J].Artif Organs,2013,37(12):1034-1040.
[5]Chen S,Xu L,Tang J.Association of interleukin 18 gene polymorphism with susceptibility to the development of acute lung injury after cardiopulmonary bypass surgery[J].Tissue Antigens,2010,76 (3):245-249.
[6]Dong LY,Zheng JH,Qiu XX,et al.Ischemic preconditioning reduces deep hypothermic circulatory arrest cardiopulmonary bypass induced lung injury[J].Eur Rev Med Pharmacol Sci,2013,17(13):1789-1799.
[7]Luo Y,Wang Y,Poynter JA,et al.Pretreating mesenchymal stemcells with interleukin-1βand transforming growth factor-βsynergistically increases vascular endothelial growth factor production and improves mesenchymal stem cells-mediated myocardial protection after acute ischemia[J].Surgery,2012,151(3):353-363.
[8]杨志刚,张志新,李振东,等.乌司他丁对室间隔缺损手术患儿的肺氧合功能及C-反应蛋白、白介素-6水平的影响[J].海南医学, 2013,24(22):3336-3338.
[9]Goebel U,Siepe M,Mecklenburg A,et al.Reduced pulmonary inflammatory response during cardiopulmonary bypass:effects of combined pulmonary perfusion and carbon monoxide inhalation[J]. Eur J Cardiothorac Surg,2008,34(6):1165-1172.
[10]Disli OM,Sarihan E,Colak MC,et al.Effects of molsidomine against doxorubicin-induced cardiotoxicity in rats[J].Eur Surg Res, 2013,51(1-2):79-90.
Protective effects of remote ischemic preconditioning on lung injury and its mechanism in rats undergoing cardiopulmonary bypass.
TU Jie,LIANG Dong-ke,LIU Guo-feng,LIANG Bei-wei,WEI Qiu-ying,LIU Ju-mei, ZHANG Bing-dong.Operation&Anesthesia Room,Institute of Cardiovascular Disease,the First Affiliated Hospital of Guangxi Medical University,Nanning 530021,Guangxi,CHINA
ObjectiveTo investigate the protective effects of remote ischemic preconditioning(RIPC)on lung injury and its mechanism in rats undergoing cardiopulmonary bypass(CPB).MethodsSixty adult male Sprague-Dawley rats were randomly divided into three groups(n=20 each):sham operation group(group S),group CPB and group RIPC+CPB.Rats in group S were anaesthetized and cannulated but did not undergoing CPB;rats in group CPB were cannulated in tail arteries and right jugular vein for CPB;rats in group RIPC+CPB were subjected to RIPC before CPB.RIPC was used by compressing the two hindlimbs alternately with a tourniquet for three cycles of 10 min ischaemia followed by 10 min reperfusion.The superior vena cava blood samples were collected at 2 h after anesthesia resuscitation for determination of concentrations of TNF-αand IL-6,and pulmonary tissue were obtained to observe the wet to dry weight ratio(W/D ratio),concentrations of malondialdehyde(MDA)and activity of glutathione peroxidase(GSH-px).The histopathological changes of lung tissue were also examined.ResultsCompared with group S,the plasma concentrations of TNF-αand IL-6,the W/D ratio and concentrations of MDA in lung tissues were increased,while activity of GSH-px in lung tissues was decreased in group CPB and group RIPC+CPB(P<0.05). Compared with group CPB,the plasma concentrations of TNF-αand IL-6,the W/D ratio and concentrations of MDA in lung tissues were decreased,while activity of GSH-px in lung tissues was increased in group RIPC+CPB(P<0.05). Compared with group CPB,the morphological injury of pulmonary tissue was alleviated in group RIPC+CPB under HE staining.ConclusionRIPC can reduce the lung injury in rats undergoing CPB.The mechanism is closely related to inhibiting the inflammatory reaction and lipid peroxidation.
Remote ischemic preconditioning;Cardiopulmonary bypass;Lung injury
R-332
A
1003—6350(2015)09—1256—03
10.3969/j.issn.1003-6350.2015.09.0452
2014-12-03)
广西壮族自治区教育厅科学技术研究项目(编号:LX033)
张炳东。E-mail:zbdong2007@163.com