Ranibizumab抑制碱烧伤诱导小鼠角膜新生血管作用观察
2015-04-14马晓昀丁雯芝
张 婷,马晓昀,张 昀,刘 林,丁雯芝,邹 俊,
(1.上海交通大学附属第六人民医院眼科,上海 200233;2.上海市光华中西医结合医院,上海 200052;3.上海市第十人民医院眼科,上海 200072)
Ranibizumab抑制碱烧伤诱导小鼠角膜新生血管作用观察
张 婷1,马晓昀2,张 昀2,刘 林3,丁雯芝1,邹 俊1,3
(1.上海交通大学附属第六人民医院眼科,上海 200233;2.上海市光华中西医结合医院,上海 200052;3.上海市第十人民医院眼科,上海 200072)
目的 观察雷尼单抗(Ranibizumab)抑制碱烧伤诱导小鼠角膜新生血管(CorNV)的作用。方法取清洁级BALB/c小鼠36只,将加有NaOH溶液(1 mol/L)的直径2 mm圆形滤纸片轻贴角膜中央烧灼30 s,制备角膜碱烧伤CorNV模型:右眼接受碱烧伤处理,左眼不予处理。后随机将小鼠分为两组,于碱烧伤后2 d、8 d时右眼分别行球结膜下注射0.9%生理盐水(阴性对照组,18只小鼠)、10 mg/ml Ranibizumab(Ranibizumab治疗组,18只小鼠)。碱烧伤后4 d、7d、14 d时行眼前节照相大体观察CorNV生长变化并计算CorNV面积;分别于碱烧伤后7 d、14 d时行苏木素-伊红(HE)染色观察角膜组织病理结构及CorNV变化;免疫组织化学(IHC)染色检测角膜HIF-1α、VEGF-A蛋白表达;实时荧光定量聚合酶链式反应(Real-time PCR)检测角膜HIF-1αmRNA、VEGF-A mRNA表达。结果眼前节照相、HE染色结果显示:碱烧伤后7 d、14 d时Ranibizumab治疗组较阴性对照组角膜新生血管减少,细小稀疏,CorNV面积明显减小,差异均有统计学意义(P<0.05)。PCR结果显示:Ranibizumab治疗组中角膜VEGF-AmRNA相对表达于7 d、14 d时均较阴性对照组降低,7 d时HIF-1αmRNA相对表达降低;差异均有统计学意义(P<0.05)。免疫组化结果显示:Ranibizumab治疗组VEGF-A蛋白表达于7 d、14 d时较阴性对照组均降低,差异均有统计学意义(P<0.05);HIF-1α表达未明显改变。结论Lucentis通过下调VEGF对碱烧伤诱导小鼠角膜CorNV具有一定抑制作用。
角膜新生血管;碱烧伤;雷尼单抗;低氧诱导因子-1α;血管内皮生长因子
角膜结构无血管特性是保证角膜透明和良好视力的前提[1]。角膜主要依靠其特殊的免疫赦免优势机制维持角膜无血管[2-3]。膜新生血管(Corneal neovascularization,CorNV)是继发于炎症、低氧、外伤等病理性条件的常见眼部并发症,可不同程度影响视力[1]。临床常规治疗CorNV因局限性较多、疗效不佳而无统一有效治疗方案,故积极探索新的治疗途径十分必要[4]。角膜中HIF-1α/VEGF通路碱烧伤诱导CorNV中起着重要作用[5]。本研究试图观察Ranibizumab在碱烧伤诱导小鼠CorNV模型中疗效及HIF-1α、VEGF表达变化。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄的清洁级BALB/c小鼠36只(体重18~20 g,雌雄不限)。实验动物于上海西普尔-必凯实验动物有限公司购入,于上海交通大学附属第六人民医院动物实验室统一饲养。动物生产许可证号为[SCXK(沪)2008-0016],使用许可证号为[SYXK(沪)2011-0128]。严格遵循《动物实验管理条例》进行动物实验。实验前排除角膜新生血管、混浊等角膜疾患。
1.1.2 主要试剂 盐酸丙美卡因滴眼液(美国Alcon公司);Ranibizumab试剂(美国Genentech公司);兔抗人HIF-1α、VEGF-A多克隆抗体、羊抗兔IgG抗体、HIF-1α、VEGF-A、GAPDH引物序列(上海生工生物工程股份有限公司);Trizol试剂(美国Invitrogen公司);实时荧光定量聚合酶链式反应(Real-time polymerase chain reaction,Real-time PCR)逆转录试剂盒及聚合酶链反应试剂盒(日本Takara公司)。
1.2 方法
1.2.1 动物模型建立 实验前腹腔注射戊巴比妥麻醉小鼠,右眼予点滴0.5%盐酸丙美卡因表面麻醉。向单层圆形滤纸(直径2 mm)加入1 μl NaOH溶液(1 mol/L),手术显微镜下将滤纸轻轻贴附于小鼠右眼角膜中央,烧灼30 s,后立即用0.9%生理盐水充分冲洗眼表、眼睑等位置1 min,建立碱烧伤诱导小鼠CorNV模型,左眼不予处理。术后盐酸林可霉素滴眼预防感染。
1.2.2 实验分组及球结膜下注射 将上述动物随机分为2组,每组18只小鼠,分别于碱烧伤后2 d、8 d时使用微量进样器(上海光正医疗仪器有限公司)距小鼠右眼角膜缘0.5~1 mm处行球结膜下注射:(1)阴性对照组:10 μl 0.9%生理盐水;(2)Ranibizumab治疗组:10 μl Ranibizumab(10 mg/ml)。注射后点滴盐酸林可霉素。
1.2.3 CorNV形态学观察 每日观察碱烧伤后CorNV生长情况。于碱烧伤后4 d、7 d、14 d进行眼前节照相,通过Image-Pro Plus 6.0(IPP 6.0)图像分析软件测量CorNV长度,自角膜缘向中央长入的最长、弯曲度小的新生血管纳入测量范围,根据面积(A)计算公式A=C/12×3.1416[r2-(r-l)2][6]计算CorNV面积,C为新生血管累及的角膜圆周钟点数,小鼠角膜半径r=1.5 mm,l为所测量的新生血管长度。
1.2.4 苏木素-伊红染色和免疫组织化学染色 碱烧伤后7 d、14 d各随机处死3只小鼠,摘除眼球制作石蜡切片,4 μm连续切片。随机取3张切片行HE染色,光学显微镜下观察碱烧伤后CorNV生长、角膜组织病理结构改变,每张切片在×200倍显微镜视野下随机选取3个视野照相。随机取3张切片行IHC染色。切片经抗原修复、10%山羊血清封闭等。加入兔抗人HIF-1α、VEGF-A多克隆抗体(稀释度均为1: 150),4℃过夜。羊抗兔IgG抗体孵育后经二氨基联苯胺显色。每张切片在×200倍视野下随机选取3个视野照相,运用IPP 6.0软件对角膜HIF-1α、VEGF-A染色进行积分光密度(Integral optical density,IOD)分析,IOD值代表照片中蛋白表达总量。
1.2.5 Real-time PCR 碱烧伤后7 d、14 d各随机处死3只小鼠,提取角膜组织总RNA后将其逆转录为cDNA。使用SYBR GREEN法行PCR反应检测HIF-1αmRNA、VEGF-A mRNA表达。GAPDH作为HIF-1α和VEGF-A内参。角膜HIF-1αmRNA、VEGF-A mRNA相对表达量计算应用2-△△Ct方法。此实验重复2次。
HIF-1α引物序列:上游5'-ACTGCCACCACTGATGAATCAAAAACAG-3';下游5'-TTCCATTTTT CGCTTCCTCTGAGCATTC-3';VEGF-A引物序列:上 游 5'-CCTTCGTCCTCTCCTTACCC-3',下 游5'-AAGCCACTCACACACACAGC-3';GAPDH引物序列:上游5'-GACTTCAACAGCAACTCCCAC-3',下游5'-TCCACCACCCTGTTGCTGTA-3',。
1.3 统计学方法 两组的CorNV面积、角膜HIF-1αmRNA和VEGF-A mRNA相对表达值、角膜HIF-1α和VEGF-A染色的IOD值以均数±标准差(±s)表示,采用SPSS13.0软件对所有数据进行独立样本t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠角膜碱烧伤后CorNV形成观察
2.1.1 形态学观察 碱烧伤后2 d时两组角膜均水肿,未见明显CorNV。4 d时两组CorNV面积大小差异无统计学意义。7 d时新生血管尖端出现分叉且部分交织吻合,14 d时新生血管较7 d时更趋向角膜中央,生长旺盛且面积增大。7 d、14 d时Ranibizumab治疗组面积较阴性对照组减小,差异均具有统计学意义(P<0.05),新生血管较阴性对照组明显稀疏、变短,见图1、表1。

图1 小鼠角膜碱烧伤后眼前节照相
表1 小鼠角膜碱烧伤后角膜新生血管面积(±s,mm2,n=6)
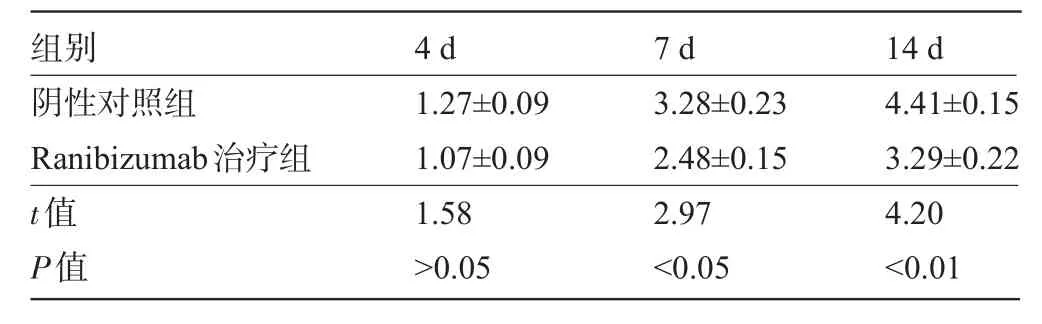
表1 小鼠角膜碱烧伤后角膜新生血管面积(±s,mm2,n=6)
阴性对照组Ranibizumab治疗组t值P值1.27±0.09 1.07±0.09 1.58>0.05 3.28±0.23 2.48±0.15 2.97<0.05 4.41±0.15 3.29±0.22 4.20<0.01
2.1.2 组织病理学观察 HE染色下发现碱烧伤后7 d、14 d时两组小鼠角膜上皮层均有不同程度萎缩变薄、角膜仍水肿;Ranibizumab治疗组较阴性对照组新生血管减少且细小、分叉减少,更接近于角膜缘位置。14 d时,两组新生血管生长趋势较7 d时接近角膜中央、数量增加,见图2。
2.2 小鼠角膜HIF-1α、VEGF表达 碱烧伤后7 d时Ranibizumab治疗组HIF-1αmRNA表达较阴性对照组下调(P<0.05),而14 d时HIF-1αmRNA表达与阴性对照组差异无统计学意义(P>0.05)。7 d、14 d时Ranibizumab治疗组VEGF-A mRNA表达均较阴性对照组下调(P<0.01),见图3。
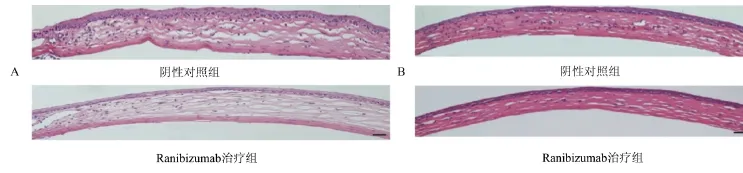
图2 小鼠角膜碱烧伤后7 d(A)、14 d(B)时角膜HE染色(×100)(比例尺=20µm)

图3 小鼠角膜碱烧伤后角膜HIF-1α mRNA(A)和VEGF-A mRNA(B)相对表达值
HIF-1α主要在胞核和胞质中表达,VEGF主要在胞质和胞膜中表达。碱烧伤后阴性对照组组可见HIF-1α和VEGF阳性表达主要见于角膜上皮层、新生血管区,呈棕色或棕黄色。碱烧伤后7 d、 14 d时Ranibizumab治疗组VEGF-A蛋白表达较阴性对照组降低,差异均有统计学意义(P<0.01),而两组HIF-1α蛋白表达均差异无统计学意义(P>0.05),见图4、表2。
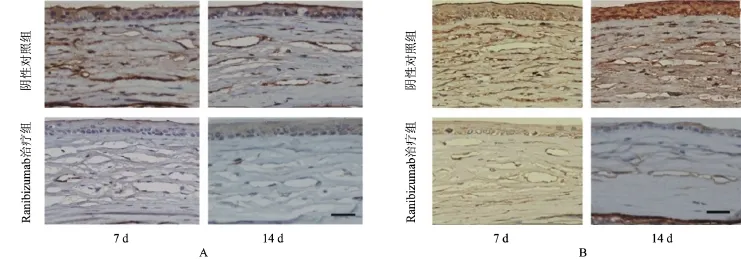
图4 小鼠角膜碱烧伤后7 d、14 d时角膜IHC染色
表2 小鼠角膜碱烧伤后角膜HIF-1α和VEGF-A表达积分光密度值(±s)

表2 小鼠角膜碱烧伤后角膜HIF-1α和VEGF-A表达积分光密度值(±s)
组别HIF-1αVEGF-A阴性对照组Ranibizumab治疗组t值P值7 d 6087.00±599.30 4363.00±452.10 2.30>0.05 14 d 5488.00±651.80 3583.00±462.90 2.38>0.05 7 d 13515.00±1480.00 5256.00±453.20 5.33<0.01 14 d 10464.00±757.20 2845.00±219.10 9.67<0.01
3 讨论
角膜是位于眼球外壁前段1/6的透明组织。角膜外伤、感染、低氧等病理性因素可使维持正常角膜透明无血管的特殊免疫赦免状态遭到破坏,导致新生血管自角膜缘长入角膜形成CorNV[2-3]。目前CorNV病理机制复杂且不明确,临床缺乏统一、有效的CorNV治疗方案,故探究其发生机制对CorNV相关疾病进行预防和治疗非常重要。
CorNV是多种角膜病变的共同病理现象,可不同程度影响视力甚至导致失明,也是角膜移植手术后发生排斥反应的高危因素[7]。眼部烧伤约占整个眼外伤的18%,眼烧伤80%多为化学试剂引起,可导致角膜穿孔、纤维化、血管新生和眼睑粘连等[7-8]。因此本实验采用碱烧伤角膜诱导CorNV模型进行机制研究,其操作简便、成熟且具有临床意义[9]。实验过程未发生碱烧伤引起角膜混浊、溃疡、穿孔等情况。
临床用于治疗CorNV的药物如皮质激素和非甾体类抗炎药,易引起白内障、眼压升高、角膜变薄等;激光光凝法可引起虹膜萎缩、坏死性巩膜炎、角膜出血和变薄等;而光动力学疗法虽然效果较好但代价大限制了其应用;眼表重建术和角膜移植术不仅难度大,而且可能引起一些术后并发症等[7]。尽管CorNV治疗手段很多,但目前临床上仍缺乏统一、有效治疗方案。
VEGF已知是新生血管的重要调控因子,临床常规使用的抗VEGF药物主要有Ranibizumab(商品名Lucentis)等[7]。Ranibizumab等VEGF抗体可用于临床治疗脉络膜视网膜新生血管等疾病[10]。Ranibizumab是一种来自于人源化抗VEGF抗体的抗原结合片段,可与VEGF-A各亚型特异性结合并抑制其活性,具有较高的角膜效率穿透和与VEGF-A结合力[7]。VEGF-A是VEGF家族中最重要的成员,与病理性新生血管关系最密切[7]。诸多动物研究[11-12]表明Ranibizumab通过抑制VEGF表达可有效抑制CorNV生长。目前,Ranibizumab是否可应用于人CorNV治疗尚不明确,因而本研究试图观察Ranibizumab对碱烧伤诱导小鼠CorNV发生发展的作用。本实验发现14 d时两组CorNV较7 d时更趋向角膜中央、面积均增大;7 d、14 d时形态学检测发现Ranibizumab组面积均较生理盐水组减小、新生血管较稀疏、变短,病理学检测发现Ranibizumab组较生理盐水组新生血管减少且细小、分叉减少,更接近于角膜缘位置。结果提示Ranibizumab对碱烧伤诱导小鼠CorNV具有一定抑制作用。
HIF-1是缺氧条件下产生的一种重要的异二聚体转录因子,由两个亚基组成:HIF-1α和HIF-1β[13]。HIF-1α是HIF-1的活性形式,正常氧环境中因可被迅速降解而几乎检测不到HIF-1α蛋白表达,是主要的氧调节因子,可调节多种靶基因如VEGF、葡萄糖转运因子等表达,对维持肿瘤能量代谢、增殖和迁移,刺激血管新生等发挥重要作用[13]。同时,本研究发现与生理盐水组比较,7 d、14 d时Ranibizumab组CorNV减轻同时伴有VEGF-A(mRNA和蛋白)表达减少,提示Ranibizumab可通过直接阻断VEGF-A抑制CorNV。HIF-1α可通过上调VEGF受体表达起促血管新生作用[14]。本实验中我们还发现Ranibizumab组于7 d时HIF-1αmRNA表达下调,提示Ranibizumab可能对HIF-1α也有作用,推测可能由于Ranibizumab治疗后CorNV减轻,某(些)上游调控因子受调控从而抑制HIF-1α表达,表达下调的VEGF部分可能源自HIF-1α靶向抑制,目前尚不明确需进一步证明。
CorNV病理机制不明确、临床尚缺乏有效治疗,本研究发现Ranibizumab可通过下调VEGF表达从而有效抑制碱烧伤诱导小鼠CorNV,为临床治疗CorNV提供可能的新途径。
[1]Beebe DC.Maintaining transparency:a review of the developmental physiology and pathophysiology of two avascular tissues[J]. Semin Cell Dev Biol,2008,19(2):125-133.
[2]Zhang SX,Ma JX.Ocular neovascularization:Implication of endogenous angiogenic inhibitors and potential therapy[J].Prog Retin Eye Res,2007,26(1):1-37.
[3]李志杰,李 辰.角膜移植免疫赦免机制的研究现状[J].眼科研究,1996,14(4):273-276.
[4]Gupta D,Illingworth C.Treatments for corneal neovascularization: a review[J].Cornea,2011,30(8):927-938.
[5]Kwon YS,Hong HS,Kim JC,et al.Inhibitory effect of rapamycin on corneal neovascularizationin vitroandin vivo[J].Invest Ophth Vis Sci,2005,46(2):454-460.
[6]Amato RJ,Laughnan MS,Flynn E,et al.Thalidomide is an inhibitor of angiogenesis[J].Proc Natl Acad Sci USA,1994,91(9): 4082-4085.
[7]Stevenson W,Cheng SF,Dastjerdi MH,et al.Corneal Neovascularization and the utility of topical VEGF inhibition:Ranibizumab(Lucentis)vs Bevacizumab(Avastin)[J].Ocul Surf,2012,10(2):67-83.
[8]Ferrari G,Bignami F,Giacomini C,et al.Safety and efficacy of topical infliximab in a mouse model of ocular surface scarring[J].Invest Ophth Vis Sci,2013,54(3):1680-1688.
[9]Chen WL,Lin CT,Lin NT,et al.Subconjunctival injection of bevacizumab(Avastin)on corneal neovascularization in different rabbit models of corneal angiogenesis[J].Invest Ophth Vis Sci,2009,50 (4):1659-1665.
[10]Chen CY,Wong TY,Heriot WJ.Intravitreal bevacizumab(Avastin) forneovascular age-related macular degeneration:a short-term study [J].Am J Ophthalmol,2007,143(3):510-512.
[11]Kim EK,Kong SJ,Chung SK.Comparative study of Ranibizumab and Bevacizumab on corneal neovascularization in rabbits[J].Cornea,2014,33(1):60-64.
[12]Cho KJ,Choi JS,Choi MY,et al.Effects of subconjunctival ranibizumab in a presensitized rat model of corneal graft[J].Exp Eye Res,2013,107:74-79.
[13]樊利芳,刁路明,陈德基.缺氧诱导因子1与肿瘤[J].中华病理学杂志,2002,31(2):168-170.
[14]Büchler P,Reber HA,Büchler M,et al.Hypoxia-inducible factor 1 regulates vascular endothelial growth factor expression in human pancreatic cancer[J].Pancreas,2003,26(1):56-64.
Inhibition effect of Ranibizumab on alkali burn induced-corneal neovascularization in mice.
ZHANG Ting1,MA Xiao-yun2,ZHANG Yun2,LIU Lin3,DING Wen-zhi1,ZOU Jun1,3.1.Department of Ophthalmology,Shanghai Sixth People's Hospital,Shanghai Jiaotong University,Shanghai 200233,CHINA;2.Shanghai Guanghua Hospital of Integrative Medicine,Shanghai 200052,CHINA;3.Department of Ophthalmology,Shanghai Tenth People's Hospital, Shanghai 200072,CHINA
ObjectiveTo observe the inhibition effect of Ranibizumab on alkali burn induced-corneal neovascularization(CorNV)in mice.MethodsThirty-six healthy BALB/c mice received 1 mol/L NaOH for 30 s to establish models of alkali induced-CorNV of the right eyes.All the mice were randomly divided into two groups, negative control group(eighteen cases,the right eyes received subconjuctival injections of 0.9%normal saline),Ranibizumab treatment group(eighteen cases,the right eyes received subconjuctival injections of 10 mg/ml Ranibizumab).On days 2,8 after alkali burn,CorNV was observed and photographed on days 4,7,14.The areas of CorNV were calculated.On days 7,14,hematoxylin-eosin(HE)and immunohistochemical(IHC)staining were conducted to observe histopathological change and to detect corneal hypoxia-inducible factor-1α(HIF-1α)and vascular endothelial growth factor(VEGF)expression.Quantitative real-time polymerase chain reaction(real-time PCR) was applied to detect the expression of HIF-1αmRNA and VEGF-A mRNA.ResultsFrontal section photograph and HE staining revealed that on days 7 and 14 after alkali burn,areas of CorNV in Ranibizumab treatment group were significantly lower than that in negative control group(P<0.05).Real-time PCR showed that relative expression levels of VEGF-A mRNA in Ranibizumab treatment group were all significantly lower than negative control group on day 7 and day 14 after alkali burn,and relative expression levels of HIF-1αmRNA were lower than negative control group on day 7(allP<0.05).IHC staining revealed that on days 7 and 14 after alkali burn,VEGF-A pro-tein expression in Ranibizumab treatment group decreased compared to negative control group(P<0.05),while HIF-1αprotein expression did not show any significant change.ConclusionRanibizumab has some inhibition effect on mouse CorNV induced by alkali burn through down-regulation of VEGF.
Corneal neovascularization;Alkali burn;Ranibizumab;Hypoxia-inducible factor-1α(HIF-1α); Vascular endothelial growth factor(VEGF)
R-332
A
1003—6350(2015)19—2813—05
10.3969/j.issn.1003-6350.2015.19.1027
2015-04-15)
上海市科技委员会基金(编号:11JC1401202)
张 婷。E-mail:crystalzhang89@163.com
