聚丙烯酸功能化LaF3:Ce3 + /Tb3 +荧光探针测定鲑鱼精DNA
2015-04-14张艺李紫薇高红艳
张艺,李紫薇,高红艳
(伊犁师范学院 化学与生物科学学院 新疆凝聚态相变与微结构实验室,新疆 伊宁 835000)
目前,常用的化学分析方法[1]有色谱分析法、电化学分析法等,但色谱分析法对检测人员的技术要求较高,需要较大的设备投入、成本高、操作耗时等。电化学分析法的灵敏度、选择性较差。所以迫切需要发展高灵敏度、选择性好、方便操作和低成本的分析方法。荧光分析法可以满足上述要求,而成为较活跃的检测手段[2]。传统的荧光材料有有机染料、荧光蛋白、量子点等,但它们大都存在光漂白、信号强度低、稳定性差、低毒等缺点,限制了其在生物和环境检测领域的深入应用。所以寻找低毒性、良好化学稳定性、高荧光量子产率的新型荧光材料十分必要。
功能化的稀土发光材料在生物和环境检测领域的应用是利用材料表面的特征官能团(氨基、羧基、巯基等)与待测物质间的能量转移或生成新的荧光物质而建立起来的荧光淬灭或荧光增强的机理[3-5]。李丹[6]用巯基乙酸(TGA)为表面活性剂与油胺中合成的NaYF4纳米晶进行配体交换,利用巯基与稀土Y3+配位,另一端的羧基可以增强其水溶性,并使发光纳米材料具有生物活性,最后采用MTT 比色法对肝癌细胞进行了毒性分析。
本文是采用简单易操作的溶剂热法制备出LaF3:Ce3+/Tb3+材料,并用聚丙烯酸(PAA)对发光材料进行功能化,使LaF3:Ce3+/Tb3+表面包裹上生物相容性官能团羧基(─COOH),基于DNA 对COOH-LaF3:Ce3+/Tb3+材料的荧光猝灭作用,定量分析了鲑鱼精DNA(hs-DAN),结果令人满意。
1 实验部分
1.1 试剂与仪器
La (NO3)3· 6H2O、Tb (NO3)3· 6H2O、Ce(NO3)3·6H2O、Na2HPO4、NaH2PO4、CH3CH2OH、HOCH2CH2OH、NaF 均为分析纯;鲑鱼精DNA,标准品;实验用水为二次蒸馏水。
CYIYE-QI 型移液器;FA2104N 型电子天平;79-1 型磁力加热搅拌器;pHSJ-5 型pH 计;GZX-9146MBE 型数显鼓风干燥箱;TGL-16C 型高速台式离心机;XRD-6000 型X-射线粉末衍射仪;LS-55 型荧光分光光度计;Prestige-21 型红外光谱仪(KBr 压片)。
1.2 LaF3:Ce3+ /Tb3+材料的制备
搅拌条件下,在10 mL 乙二醇和20.00 mL 无水乙醇的混合溶剂中分别加入0.9 mL 的La(NO3)3·6H2O、50 μL Tb(NO3)3·6H2O 和50 μL Ce(NO3)3·6H2O。搅拌均匀后,逐滴加入2 mL NaF 水溶液,再继续搅拌30 min。然后转移至带聚四氟乙烯内衬的不锈钢反应釜中,将其放入烘箱,160 ℃条件下加热12 h。反应结束后,待温度降到室温,倒去反应釜里上清液,釜底的白色固体就是LaF3:Ce3+/Tb3+沉淀,将其分散在水中,转速为8 000 r/min,离心8 min,同样的方法用蒸馏水洗涤3 次,除去残留的溶剂,80 ℃烘干样品,备用。
1.3 聚丙烯酸(PAA)对LaF3:Ce3+ /Tb3+材料的包裹
称取0. 112 8 g LaF3:Ce3+/Tb3+样品,加到20 mL 无水乙醇和10 mL 蒸馏水混合溶液中,再加入1 mL 聚丙烯酸,超声48 h 后,得到PAA-LaF3:Ce3+/Tb3+功能材料。用去离子水离心清洗3 次,离心清洗后的样品超声分散在50 mL 去离子水中,样品浓度为0.011 52 mol/L(以LaF3的物质的量浓度计算),备用。
1.4 PAA-LaF3:Ce3+ /Tb3+功能材料测定鲑鱼精DNA
在10 mL 容量瓶中分别加1 mL PAA-LaF3:Ce3+/Tb3+(0.011 52 mol/L)样品,5 mL 蒸馏水,再分别加0,60,100,500,1 000,2 500 μL 的100 μg/mL鲑鱼精DNA 水溶液,用PBS 缓冲溶液调pH 为5.5,最后用蒸馏水定容至10 mL(样品浓度为1. 1 ×10-3mol/L)。用荧光分光光度计测其荧光强度,以275 nm 为激发波长,531 nm 为发射波长。PAALaF3:Ce3+/Tb3+制备及与DNA 作用见图1。

图1 PAA 包裹LaF3:Ce3+ /Tb3+晶体及与DNA作用示意图Fig.1 Schematic illustration of PAA-LaF3:Ce3+ /Tb3+ and detection for hs-DNA
2 结果与讨论
2.1 LaF3:Ce3+ /Tb3+纳米晶的XRD 表征
图2 为制备的LaF3:Ce3+/Tb3+晶体的X 射线衍射图谱。
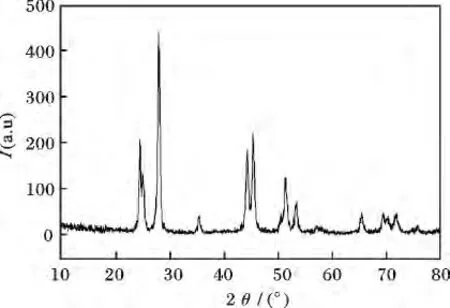
图2 LaF3:Ce3+ /Tb3+晶体的XRD 图Fig.2 X-ray diffraction patterns of LaF3:Ce3+ /Tb3+ crystals
由图2 可知,谱图的衍射峰分别对应(110)、(111)、(112)、(113)、(212)、(220)、(310)、(320)、(115)、(411)、(403)、(314)等晶面。其衍射峰与标准卡片号为72-1435 立方相的LaF3晶体相符合,无明显杂质峰,说明纯度高、结晶好。
2.2 红外谱图分析
图3 给出了PAA-LaF3:Ce3+/Tb3+晶体红外吸收谱图。
由图3 可知,3 440 cm-1处吸收峰对应着─COOH 基的νO─H峰,2 954 cm-1为PAA 中饱和烷烃─CH2的特征峰,1 726 cm-1处吸收峰是─COOH 基中的特征峰,在1 577 cm-1和1 464 cm-1两峰为─COOH 基中ν─COO的对称和不对称伸缩振动峰。1 429 cm-1为νC─O特征峰,说明聚丙烯酸中的─COOH 与La 发生了键合。由此,可以确定聚丙烯酸已成功修饰于LaF3:Ce3+/Tb3+晶体外表面上。

图3 PAA-LaF3:Ce3+ /Tb3+晶体的红外谱图Fig.3 FTIR spectra of PAA-LaF3:Ce3+ /Tb3+ crystals
2.3 鲑鱼精DNA(hs-DNA)的测定
鲑鱼精DNA(hs-DNA)的测定结果见图4,谱线a ~f 给出了不同摩尔浓度hs-DNA 存在时,体系荧光强度的变化。结果表明,pH =5.5,λem/λex=531/275 nm 时,体系的荧光强度随hs-DNA 浓度的增加呈线性降低。a ~f 分别是hs-DNA 浓度为0.0,0.6,1.0,5.0,10.0,25.0 μg/mL,LaF3:Ce3+/Tb3+浓度为1.92 ×10-3mol/L 的荧光谱图。下图为PAALaF3:Ce3+/Tb3+荧光强度与hs-DNA 浓度之间的线性关系。

图4 hs-DNA 体系荧光光谱Fig.4 Luminescent spectra of hs-DNA system
由图4 可知,在浓度为0.6 ~25 μg/mL 范围内,ΔF 与hs-DNA 浓度呈良好的线性关系,线性方程ΔF =113.9-1.5c,检测限为0.97 μg/mL,RSD为0.97%。相关系数R=0.998 2。宽的线性范围、低的检测限表明此种方法对DNA 的定量分析效果良好。hs-DNA 之所以对PAA-LaF3:Ce3+/Tb3+材料有荧光猝灭现象,是因为功能化的材料表面有羧基可以与核酸上的氨基键合,然后Tb3+或Ce3+的激发电子与DNA 之间的传递而导致体系发生荧光猝灭[7]。
2.4 pH 值的选择
考察了pH 3.5,4.5,5.5,6.5,7.5,8.5,9.5,10.5 八种不同缓冲溶液对体系荧光强度的影响,结果见图5。在10 mL 容量瓶中分别加1 mL PAALaF3:Ce3+/Tb3+样品(浓度为1. 1 ×10-3mol/L),1 mL 鲑鱼精DNA,用PBS 缓冲溶液调pH 值,最后蒸馏水定容。
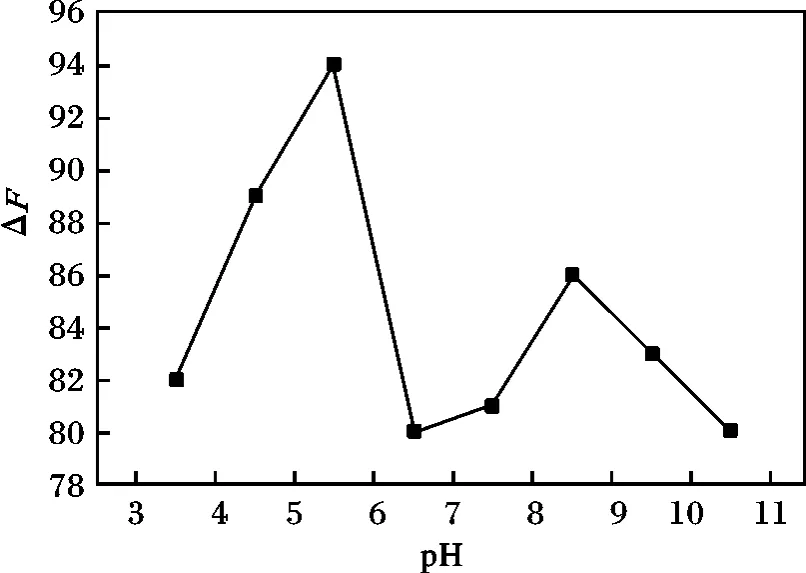
图5 酸度对体系荧光强度的影响Fig.5 Effect of pH on the quenching of the fluorescence
由图5 可知,体系的荧光强度随pH 值的增加略有增强,pH 5.5 时,荧光最强,当pH 值>5.5 时,体系的荧光强度反而降低。故本实验选择pH 5.5时测定体系。
2.5 共存物的干扰
考察了当hs-DNA 浓度为5.0 μg/mL 时,不同浓度的干扰物质对测定的影响,见表1。

表1 共存物质对测定的干扰Table 1 Tests for the interference of coexisting substances
由表1 可知,大部分共存物质对hs-DNA 的分析的干扰都很小。表明该方法有较好的选择性。
3 结论
用简单的溶剂热方法制备了LaF3:Ce3+/Tb3+晶体,利用超声微乳包裹技术将聚丙烯酸包裹在LaF3:Ce3+/Tb3+材料表面,合成出羧基功能化的PAA-LaF3:Ce3+/Tb3+材料。这样增大了材料的水溶性及生物相容性,据此建立了与鲑鱼精DNA 之间的荧光探针,利用荧光猝灭法,对核酸进行了定量测定,灵敏度和选择性较好。该方法可以用于生物样品的测定。参考文献:
[1] 高鸿. 分析化学前沿[M]. 北京:科学出版社,1999:370.
[2] 王欢,高奕红,张萍.荧光传感器及其分子识别作用的研究进展[J].应用化工,2014,43(4):718-728.
[3] Wang L Y,Yan R X,Hou Z Y,et al. Fluorescence resonant energy transfer biosensors based on upconversion luminescent nanoparticles[J]. Angew Chem Int Ed,2005,44:6054-6057.
[4] Chen Hongqi,Yuan Fei,Xu Yong,et al.Simple and sensitive detection method for cobalt(Ⅱ)in water using CePO4:Tb3+nanocrystals as fluorescent probes[J].Spectrochimica Acta Part A,2013,107:151-155.
[5] Liu J N,Bu W B,Pan L M,et al.NIR-triggered anticancer drug delivery by upconverting nanoparticles with integrated azobenzene-modified mesoporous silica[J]. Angewandte Chemie,2013,125:4471-4475.
[6] 李丹.巯基乙酸修饰对六角相NaYF4:Yb,Er 上转换发光纳米材料的影响[D].长春:吉林大学,2010.
[7] Dong Ling,Yang Z H,Zhang Y,et al. Novel luminescent nanoparticles for DNA detection[J].Spectrochimica Acta Part A,2010,75:1530-1534.
