微载体技术肝细胞体外高密度培养的实验
2015-04-14杨波刘宝林任杰庄灵霞
杨波,刘宝林,任杰,庄灵霞
(上海理工大学 医疗器械与食品学院,上海 200093)
急性肝功能衰竭(ALF)病情危重,死亡率高。生物人工肝支持系统(BALSS)可使ALF 患者顺利过渡到肝移植或肝再生,而生物人工肝治疗主要依靠大量的肝细胞,一般需要1010个功能良好的肝细胞[1],因此需求数量巨大。大量高密度和高活性肝细胞只能在体外高密度增殖培养。建立一种体外高密度增殖细胞并能较长时间维持细胞功能的培养方法,对于生物人工肝的发展有重要意义。
由于肝细胞的贴壁依赖性,在高密度条件下,存在细胞接触抑制效应,细胞的生长和表达会受到严重影响[2],因此体外高密度培养肝细胞需要使用载体材料,以供肝细胞在其粘附生长,细胞在载体材料的粘附是后续细胞增殖生长,进而组织化的关键[3-4]。微载体是目前较广泛使用的载体材料,其比表面积大,可实现细胞高密度培养[5]。国内外研究报道了十余种微载体,材料也分为葡聚糖、明胶、玻璃、纤维素、塑料乃至羟基磷灰石等很多类型,用以培养细胞,取得了良好的效果[6-8]。目前应用较多的是美国GE 公司实体微载体Cytodex 与多孔微载体Cytopore 等,这些微载体,不只是营养物质可以进入其空间,细胞也可以粘附生长。近年来,陆续有Cytodex 与Cytopore 系列载体应用于高密度细胞培养,并取得满意的结果[9-12]。Cytodex 微载体平均直径为180 μm,可以使200 个细胞在其表面生长,被广泛应用于贴壁细胞的生长,尤其是高密度生产病毒疫苗等;利用较多的是生产CHO 细胞,CHO 细胞在微载体Cytodex 的生长密度和数量都比在细胞悬液高很多[13]。大孔微载体Cytopore 能够为细胞提供贴壁生长的内部空间,细胞在孔洞里可以高密度生长,对贴壁细胞而言,较大的比表面积和多孔的结构可以提高细胞产量[14]。
Cytopore 和Cytodex 这两种微载体,何种更适合于微重力条件下大规模培养肝细胞,以达到高密度并能维持细胞功能。本课题采用两种载体进行微重力培养大鼠肝细胞,观察细胞生长的形态及细胞活力等情况,并通过细胞生长代谢功能中的白蛋白、葡萄糖和尿素等指标测定,探究最佳的微载体浓度和最适宜培养肝细胞的微载体。
1 实验部分
1.1 材料与仪器
大鼠肝细胞;Cytodex 为实心小球微载体(球径133 ~215 μm);Cytopore 为大孔微载体(平均粒度235 μm);Me2SO(无菌);胎牛血清;1640 培养液;葡萄糖等。Sartorius BP 211D 电子天平;HH.CP-01W 二氧化碳培养箱;立式压力蒸汽灭菌器;ECLIPSE 55i 显微镜;LRM340M 酶标仪;Quanta FEG 场发射环境扫描电子显微镜。
1.2 微载体Cytodex 和Cytopore 大鼠肝细胞的培养
1.2.1 培养板的硅化 超净台上,取一次性无菌6孔细胞培养板一个,在每个孔中加入60 mL/L 甲基硅树脂乙醇溶液12 mL,轻轻摇匀,吸出多余的溶液,置60 ℃电烤箱烘干备用。
1.2.2 微载体Cytodex 和Cytopore 灭菌处理 在超净台上,干燥的微载体在无Ca2+和Mg2+的磷酸缓冲液(PBS)(每克Cytodex 和Cytopore 各加50 ~100 mL)中在室温下浸泡膨胀至少3 h。弃去上清液,用新配制的无Ca2+、Mg2+的PBS(每克Cytodex和Cytopore 各加30 ~50 mL)洗涤微载体数分钟。弃去PBS,换上新的无Ca2+、Mg2+的PBS(每克Cytodex 和Cytopore 各加30 ~50 mL),然后,微载体溶液用高压灭菌法灭菌(115 ℃,15 min,15 psi)。所有溶液的pH 应为7.4。
1.2.3 肝细胞接种前的平衡 在超净台上,将上述培养板孔中的液体吸出,再用灭菌的无Ca2+、Mg2+的PBS 漂洗1 次,吸弃 PBS,用温和的含有100 mL/L胎牛血清(FBS)及RPMI 1640 培养基漂洗微载体,将温度调节37 ℃,培养基的pH =7. 1 ~7.4,通入95%空气和5%CO2混合气体,5 min。
1.2.4 大鼠肝细胞的接种 在超净台上,将大鼠肝细胞按2 "105cells/mL 的密度接种于含2 g/L 的Cytodex 或Cytopore (作为三维支架材料,形成三维培养环境)的六孔培养板中,补充上述培养基至5 mL,置培养板于37 ℃,5%CO2,100%湿度的二氧化碳培养箱中。
1.2.5 大鼠肝细胞与载体的“相对”静止培养 前6 h,每15 ~20 min 将培养板取出在超净台上,匀速轻柔水平摇晃1 次,6 h 后每1 h 再摇晃1 次,10 h后每2 h 摇晃1 次,每次摇晃时间均为1 ~2 min,16 h停止摇晃,置于培养箱中静止培养。培养24 h后换液,以后根据培养液颜色和透亮度来更换培养液,每次换去约4 mL 的培养上清。
1.3 测试表征
1.3.1 电镜的形态学观察 小心用镊子取0.5 cm3左右的Cytodex 和Cytopore 支架样本,放入样品管内。喷金,喷镀均匀后扫描电镜下观察。
1.3.2 细胞形态学观察 用倒置生物显微镜对培养过程进行观察拍照。
1.3.3 细胞MTT 值的测定 分别在培养0,2,4,6,8,10 d 时,使用MTT 试剂盒在酶标仪对细胞的MTT值进行测定。
1.3.4 肝细胞的代谢功能 以溴甲酚绿法、二乙酰一肟显色法、葡萄糖氧化酶法用试剂盒在酶标仪测定白蛋白、尿素和葡萄糖的含量。
2 结果与讨论
2.1 实验结果与分析
多孔载体Cytopore 的表面积为2.8 m2/g,选取0.5 ~2 mg/mL 4 个浓度。Cytodex 比表面积小于Cytopore,实验选取高于Cytopore 的浓度,选用2.0~3.5 mg/mL 4 个浓度。在细胞培养的第0,2,4,6,8 d,对各个浓度的Cytopore 与Cytodex 进行细胞计数,结果见图1。
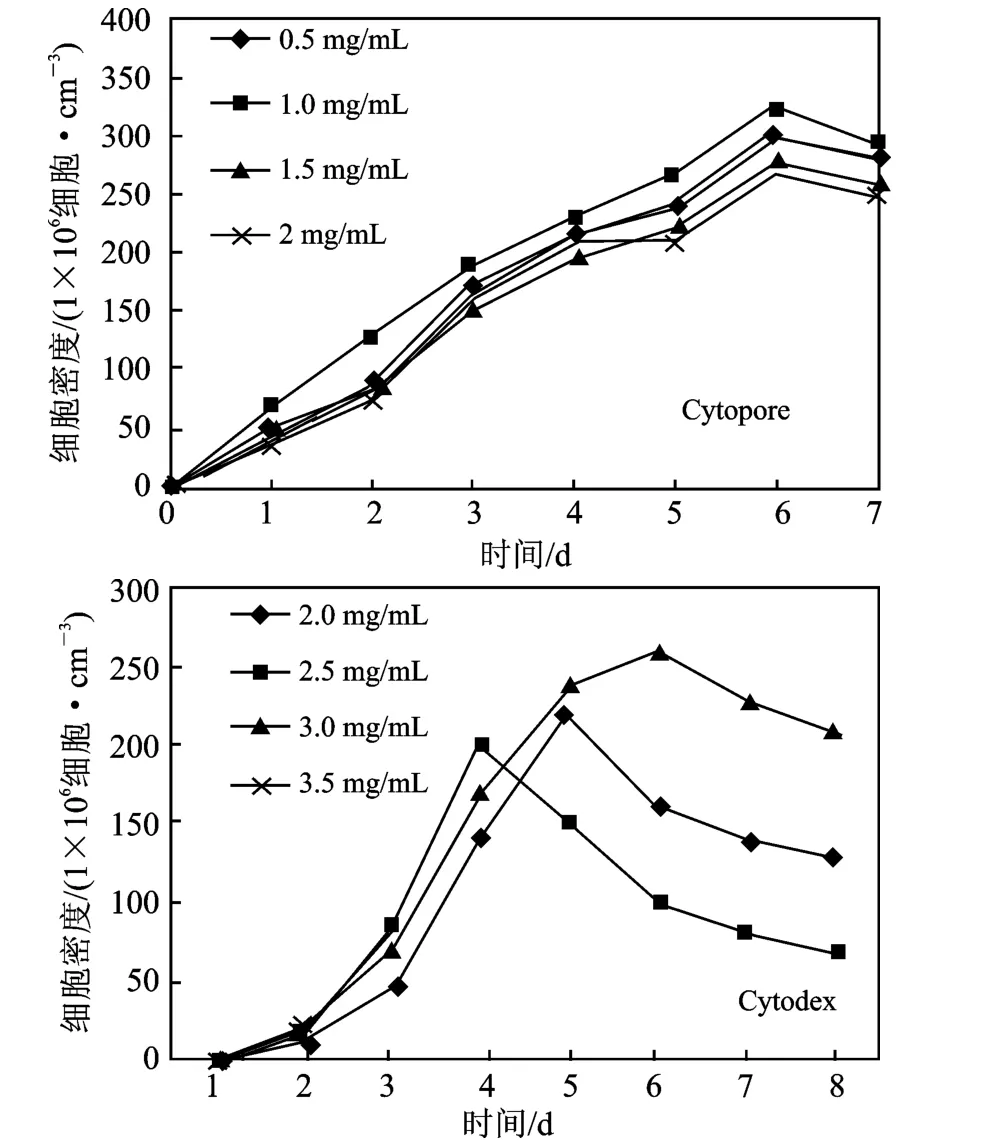
图1 Cytopore 与Cytodex 浓度与细胞的密度Fig.1 The relationship between specific productivity and cell density whin Microcarrier concentration Cytopore and Cytodex
由图1a 可知,1.0 mg/mL 浓度的微载体培养出的细胞密度值最大,即细胞生物活性最大、生长增殖快。所以,本实验所用的 Cytopore 接种浓度为1.0 mg/mL。
由图1b 可知,3 mg/mL 的微载体细胞密度值最大,故选用3 mg/mL 的接种浓度。
2.2 Cytopore 和Cytodex 的扫描电镜观察
由图2 可知,Cytopore 是多孔载体,以纤维素为基架,其内部存在大量孔洞,细胞可以在其内部生长,Cytodex 是实心球体,以交联葡聚糖为基架,外表面化学偶联一层较薄的变性胶原,细胞可以贴附其表面生长。
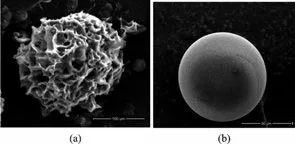
图2 扫描电镜下(a)Cytopore 和(b)CytodexFig.2 SEM images of microcarriers(a)Cytopore and (b)Cytodex
2.3 Cytopore 和Cytodex 的显微镜观察

图3 Cytopore 培养的肝细胞(×100)Fig.3 Image of cell growth in microcarrier cytopore(×100)(a)培养2 d 后;(b)培养4 d 后;(c)培养6 d 后

图4 Cytodex 培养的肝细胞(×100)Fig.4 Image of cell growth in microcarrier cytodex(×100)(a)培养2 d 后;(b)培养4 d 后;(c)培养6 d 后
由图3 可知,Cytopore 微载体大鼠肝细胞培养2 d,微载体空洞内贴附生长的细胞(图中用箭头指出),载体孔隙内充满密集的细胞,细胞的直径一般在10 μm。
由图4 可知,Cytopore 由于载体特殊的孔洞结构,平均孔径为235 μm,因此细胞生长空间巨大,可以自由生长聚集,一旦粘附于载体,就可以聚集成团生长,不受空间限制,培养至4 d 开始大量贴附于微载体表面,至第6 d 时细胞几乎贴满微载体表面,生长至于顶峰,当细胞占满载体空间后,从第8 d 细胞开始出现凋亡现象。
2.4 Cytopore、Cytodex 微载体培养大鼠肝细胞的MTT 值及代谢指标的对比
分别在培养0,2,4,6,8,10 d 后对Cytopore 与Cytodex 培养的大鼠肝细胞BRL 进行MTT 值及代谢指标的测定,计算各值后作出柱状图进行对比。
2.4.1 MTT 值 见图5。
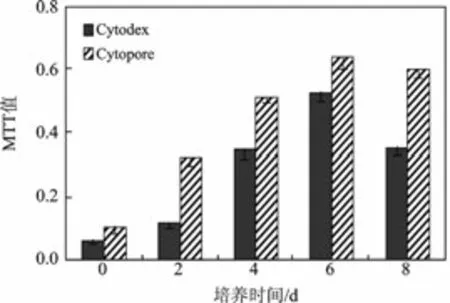
图5 微载体培养的大鼠肝细胞MTT 值比较(珋±s)Fig.5 MTT of rat hepatocytes growth in microcarrier
由图5 可知,Cytopore、Cytodex 微载体培养的大鼠肝细胞所测的MTT 值在前6 d 均呈现上升趋势,第6 d 时其细胞活性最大,Cytopore 最大达到0.64,Cytodex 最大达到0.53,>6 d 后开始明显下降。Cytopore 微载体培养的细胞的MTT 值明显大于Cytodex 培养细胞的值。
2.4.2 分泌白蛋白量 见图6。
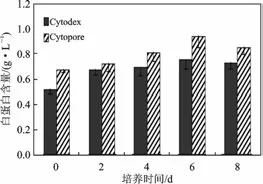
图6 微载体培养的大鼠肝细胞分泌白蛋白比较(±s,g/L)Fig.6 Albumin concentration of rat hepatocytes growth in microcarrier
由图6 可知,Cytopore、Cytodex 微载体培养的大鼠肝细胞所测的白蛋白分泌量在前6 d 均呈上升趋势,第6 d 时其细胞分泌量最大,Cytopore 最大达到0.95 g/L,Cytodex 最大达到0.86 g/L,并从第6 d 后开始缓慢下降。Cytopore 微载体培养的细胞的白蛋白分泌量普遍大于Cytodex 培养细胞的值。
2.4.3 尿素合成量 见图7。
由图7 可知,Cytopore、Cytodex 微载体培养的大鼠肝细胞的尿素合成量在前6 d 均呈上升趋势,并在第6 d时其细胞尿素合成量最大,Cytopore 最大达到6.1 mmol/L,Cytodex 最大达到2.79 mmol/L,并从第6 d 后开始逐渐下降。总体来说,Cytopore 微载体培养的细胞尿素的合成量明显大于Cytodex 培养细胞的值,是Cytodex 的1 ~2 倍。
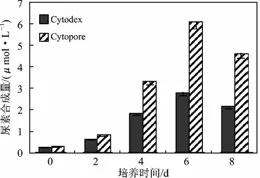
图7 微载体培养的大鼠肝细胞尿素合成量比较±s,mmol/L)Fig.7 Synthesized urea of rat hepatocytes growth in microcarrier
2.4.4 葡萄糖消耗量 见图8。

图8 微载体培养的大鼠肝细胞葡萄糖含量比较珋±s,μmol/mL)Fig.8 Synthesized urea of rat hepatocytes growth in microcarrier
由图8 可知,Cytopore、Cytodex 微载体培养的大鼠肝细胞所消耗的葡萄糖量在前6 d 均呈上升趋势,并在第6 d 时其细胞葡萄糖含量最大,Cytopore最 大 达 24. 73 μmol/mL,Cytodex 最 大 达17.89 μmol/mL,并从第6 d 后开始缓慢下降。Cytopore 培养的细胞消耗的葡萄糖量在培养期间明显大于Cytodex 培养细胞的值,是Cytodex 的1 倍。
目前很多实验证实,在细胞增殖生长和代谢功能上,微载体培养明显优于静止培养,是大规模扩增培养细胞很有前景的技术手段[15-16]。
3 结论
以微载体Cytopore 培养大鼠肝细胞的MTT 值、代谢指标值是Cytodex 的1 ~1.5 倍,在细胞培养期间,以Cytopore 为载体培养的细胞生长密度比Cytodex 高,细胞生长时间多4 d 左右。原因可能是Cytodex 是由葡聚糖构成的实心球体微载体,比表面积为2 700 cm2/g,细胞铺满表面后,就无法继续粘附生长,阻碍细胞在培养期间代谢;而Cytopore 为疏松的空心多孔网状结构,比表面积为1.1 m2/g,其比表面积是Cytodex 的4 倍,大多数细胞可以在孔内立体生长,为细胞的增殖提供了足够的空间,良好的孔隙有利于细胞的代谢,更适合大鼠肝细胞BRL 的培养。但由于它的多孔结构,在显微镜下不易观察到孔洞内细胞生长情况,只能在扫描电镜下对细胞进行染色处理后才可观察,无法实时在线观察。
[1] Khalil M,Shariat-Panahi A,Tootle R,et al.Human hepatocyte cell lines proliferating as cohesive spheroid colonies in alginate markedly upregulate both synthetic and detoxificatory liver function[J]. J Hepatol,2001,34 (1):68-77.
[2] Vecht-Lifshitz S E,Magdassi S,Braun S. Pellet formation and cellular aggregation in Streptomyces tendae[J]. Biotechnology and Bioengineering,1990,35:890-896.
[3] Kemeny S F,Cicalese S,Figueroa D S,et al.Glycated collagen and glucose increase endothelial cell adhesion strength[J]. Journal of Cellular Physiology,2013,228(8):1727-1736.
[4] Remya K,Joseph J,Mani S,et al.Nanohydroxyapatite incorporated electrospun polycaprolactone/polycaprolactone polyethyleneglycol polycaprolactone blend scaffold for bone tissue engineering applications[J]. Journal of Biomedical Nanotechnology,2013,9(9):1483-1494.
[5] GE-Healthcare. Cytodex surface microcarriers[R]. Sweden:Wikstroms,2002.
[6] 张瑞,韩宝三,吴薇,等. 微载体及其在肝细胞培养中的作用与应用[J]. 中国组织工程研究与临床康复,2008,12(32):6331-6334.
[7] Tao X,Shaolin L,Yaoting Y. Preparation and culture of hepatocyte on gelatin microcarriers[J]. J Biomed Mater Res A,2003,65(2):306-310.
[8] Kiyota A,Matsushita T,Ueoka R.Induction and high density culture of human hepatoblasts from fetal hepmocytes with suppressing transformation[J]. Biol Pharm Bull,2007,30(12):2308-2311.
[9] 胡显文,肖成祖,高丽华,等. 用多孔微载体大规模长期培养动物细胞的方法[J]. 生物技术通报,2001,1(1):45-48.
[10] Heath C,Kiss R. Cell culture process development:advances in process engineering[J].Bioteehnol Prog,2007,23:46-51.
[11]Kistner O,Barrett P N,Mundt W,et al.Development of a mammalian cell(Veto)derived candidate influenza virus vaccine[J].Vaccine,1998,16:960-968.
[12] Trabelsi K,Majoul S,Rourou S,et al. Development of a measles vaccine production process in MRC-5 cells grown on Cytodexl microcarriers and in a stirred bioreactor[J].Appl Microbiol Biotechnol,2012,93:1031-1040.
[13] Chevalot I,Visvikis A,Nabet P,et al. Production of amembrane-bound protein,the human gammaglutamyl transferase,by CHO cells cultivated on microcarriers,in aggregates and suspension[J]. Cytotechnology,1994,16:121-129.
[14]Nikolai T J,Hu W S. Cultivation of mammalian cells on macroporous microcarriers[J]. Enyzme and Microbial Technology,1992,14:203-208.
[15]Michele L,Marquette,Diane Byerly,et al.A novel in vitro three dimensional skeletal muscle model[J]. Biol Animal,2007,43:255-263.
[16]Faeer S R,Zaharias R S,Andracki M E,et al.Rotary culture enhances pre-osteoblast aggregation and mineralization[J].J Dent Res,2005,84(6):542-547.
