RP-HPLC 测定山竹花不同部位芦丁、木犀草素的含量
2015-04-14梁春辉张寒任连新
梁春辉,张寒,任连新
(1.西安市儿童医院,陕西 西安 710083;2.西安医学院 药学院,陕西 西安 710021;3.华北制药股份有限公司,河北 石家庄 051430)
山竹花(Disporam cantoniense (Lour.)Merr.)别名万寿竹、豪猪七、白毛七、竹叶参等,产于秦岭北坡甘肃天水的小陇山、陕西太白山及南坡之略阳、佛坪、宁陕和甘肃、成诸县等。山竹花生长海拔高度700 ~3 000 m,多见山坡灌丛中或林下草地,喜肥沃而湿润的腐殖土。其以根及根茎入药,性寒味甘,具有清热解毒、舒筋活血之功效,民间常将其用于治疗痛经、跌打损伤、风湿关节痛、骨折等症[1-2]。
目前,国内相关文献报道山竹花中含有芦丁、木犀草素、芹菜素、木犀草素-7-O-β-D-葡萄吡喃糖苷等黄酮类成分[3]。目前国内外尚未见山竹花中黄酮类含量测定的相关记载,本文在参考了大量有关山竹花和黄酮类化合物提取分离及含量测定的文献资料后,分别以芦丁和木犀草素为对照品对山竹花进行了不同部位(叶、茎、根)中芦丁和木犀草素的含量测定。另外,由于山竹花中含有木犀草素-7-Oβ-D-葡萄吡喃糖苷等苷类成分,而苷类在酸性条件下易发生水解,本文在实验过程中将用于测定木犀草素的样品溶液进行酸处理,再次测定该样品中木犀草素的含量,并与未经酸处理的样品测得的结果进行了比较。
1 实验部分
1.1 材料与仪器
芦丁对照品(HPLC 检测用,纯度≥98%);木犀草素对照品(HPLC 检测用,纯度≥98%);甲醇,色谱纯;其它试剂均为分析纯;山竹花采自秦岭太白山,经西安医学院生药教研室汪兴军老师鉴定为百合科山竹花。
Agilent 1260 高效液相色谱仪;Thermo C18柱色谱柱(250 mm×4.6 mm,5 μm);KQ-300B 型超声波清洗器;GR-202 型分析天平。
1.2 实验方法
1.2.1 色谱条件与系统适用性
1.2.1.1 芦丁 色谱柱:Thermo C18柱(250 mm ×4.6 mm,5 μm),柱温30 ℃,进样量20 μL,流动相:甲醇-0.1%磷酸水溶液(38∶62);流速1.0 mL/min;检测波长358 nm。在此色谱条件下,芦丁分离度较好[4-8],见图1。
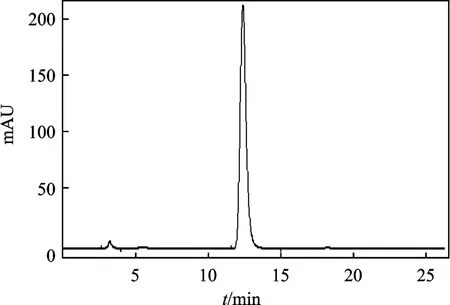
图1 芦丁对照液色谱图Fig.1 Rutin control the liquid chromatogram
1.2. 1. 2 木犀 草素 色 谱柱:Thermo C18柱(250 mm × 4. 6 mm,5 μm),柱温30 ℃;进样量20 μL;流动相:甲醇-0.2%磷酸水溶液(55∶45),流速1.0 mL/min,检测波长350 nm。在此色谱条件下,木犀草素分离度较好[9-10],见图2。
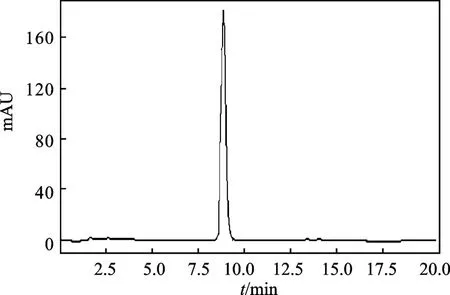
图2 木犀草素对照液色谱图Fig.2 Luteolin control liquid chromatogram
1.2.2 对照品溶液的配制
1.2.2.1 芦丁对照品溶液的配制 精密称定芦丁对照品3.9 mg,以60%乙醇并转移至10 mL 容量瓶中,定容,即得每1 mL 含芦丁0. 39 mg 的对照品溶液。
1.2.2.2 木犀草素对照品溶液的配制 精密称定木犀草素对照品3.4 mg,以100%甲醇溶解并转移至10 mL 容量瓶中,定容,即得每1 mL 含木犀草素0.34 mg 的对照品溶液。
1.2.3 供试品溶液的配制
1.2.3.1 芦丁供试品溶液的配制 分别精密称取山竹花根、茎、叶粉末5 g(各3 份,编号a、b、c、d、e、f),置于500 mL 圆底烧瓶中,加入200 mL 蒸馏水,沸水煎煮1 h,过滤,所余药渣加100 mL 蒸馏水继续煎煮45 min,合并两次煎液,用四层纱布过滤,抽滤,将所得滤液水浴蒸干,以60%乙醇溶解,并转移至50 mL 容量瓶,定容即得芦丁供试品溶液。
1.2.3.2 木犀草素供试品溶液(Ⅰ)的配制 分别精密称取山竹花根、茎、叶粉末5 g(各3 份,编号a、b、c、d、e、f),将其置于500 mL 索氏提取器中,向内加入200 mL 石油醚,浸泡12 h 后,70 ℃水浴加热提取至无色,放置至室温,旋转蒸干石油醚,加甲醇100 mL,超声提取30 min,将甲醇水浴蒸干,以100%甲醇溶解,并转移至10 mL 容量瓶中,定容即得木犀草素供试品溶液(Ⅰ)。
1.2.3.3 木犀草素供试品溶液(Ⅱ)的配制 分别精密量取木犀草素供试品溶液(Ⅰ)中9 份溶液200 μL,向其中各加入1 滴稀硫酸溶液,摇匀后静置10 min,即得木犀草素供试品溶液(Ⅱ)。
1.2.4 测定方法 分别精密吸取1.2.2、1.2.3 节配制所得的对照品溶液、供试品溶液各20 μL,注入高效液相色谱仪,按1.2.1 节色谱条件测定。
2 结果与讨论
2.1 专属性实验
2.1.1 芦丁 分别吸取芦丁对照品溶液、供试品溶液各20 μL 注入高效液相色谱仪,按照1.2.1.1 节色谱条件测定,结果在供试品中芦丁与对照品色谱峰保留时间一致,并且能达到基线分离,见图3。
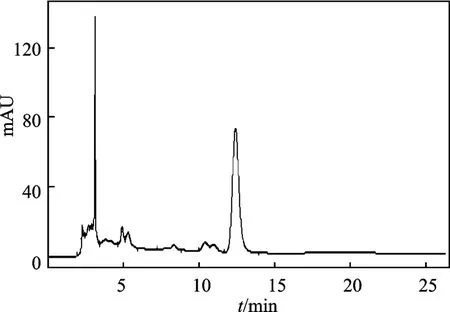
图3 山竹花样品色谱图Fig.3 Sample chromatogram
2.1.2 木犀草素 分别吸取木犀草素对照品溶液、供试品溶液(Ⅰ)(Ⅱ)20 μL,注入高效液相色谱仪,按照1.2.1.2 节色谱条件进行测定,结果在供试品中木犀草素与对照品色谱峰保留时间一致,并且能达到基线分离,见图4。
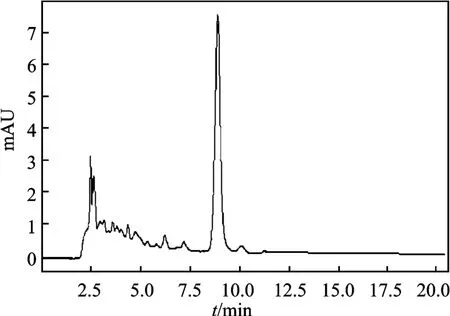
图4 山竹花样品色谱图Fig.4 Sample chromatogram
2.2 线性关系的考察
2.2.1 芦丁 精密量取1.2.2 节芦丁对照品溶液0.1,0.2,0.4,0.8,1.6 mL 至5 mL 容量瓶中,加入60%乙醇溶液定容至刻度,摇匀,即得。按上述色谱条件,分别进样20 μL,测定。以对照品进样浓度为横坐标(X),峰面积积分值为纵坐标(Y)分别绘制标准曲线,得芦丁线性回归方程为Y =16 232X +47.054,r=0.999 7(n=5)。结果表明,芦丁进样量在0.007 8 ~0.124 8 mg/mL 范围内线性关系良好。2.2.2 木犀草素 精密量取1.2.2 节木犀草素对照品溶液0.05,0.1,0.2,0.4,0.8 mL 至5 mL 容量瓶中,用100%甲醇定容至刻度,摇匀,即得。按上述色谱条件,分别进样20 μL,测定。以对照品进样浓度为横坐标(X),峰面积积分值为纵坐标(Y)分别绘制标准曲线,得木犀草素回归方程为Y =12 040X+11.358,r=0.999 1(n =5)。结果表明,木犀草素进样量在0.003 4 ~0.054 4 mg/mL 范围之内线性关系良好。
2.3 重复性实验
精密量取1.2.2 节芦丁、木犀草素对照品溶液各6 份(20 μL),分别进样,测定峰面积。结果芦丁RSD 为0.003 5%,木犀草素RSD 为0.034 9%,表明二者重复性良好。
2.4 稳定性实验
精密量取芦丁、木犀草素对照品溶液,分别在0,2,4,8,12,24 h 各进样20 μL,分别测定两者的峰面积。结果芦丁RSD 为0.002 5%,木犀草素RSD为1.48%,表明二者均在24 h 内稳定。
2.5 加样回收率实验
取已知含量的山竹花叶b、e 供试品溶液各3份,精密量取b 溶液1 mL,加入芦丁对照品溶液100 μL;量取e 溶液400 μL,加入木犀草素对照品溶液100 μL,分别混匀即得供试样品。分别量取以上两种溶液各20 μL 进行测定,计算各自加样回收率。结果芦丁加样平均回收率为97.51%,RSD 为0.13%;木犀草素加样平均回收率为96.03%,RSD为0.54%。表明该样品制备方法准确性较高,可靠性较强。
2.6 样品测定
精密量取1. 2. 3 节制得的供试品溶液,进样20 μL,计算各成分含量,测定结果见表1。
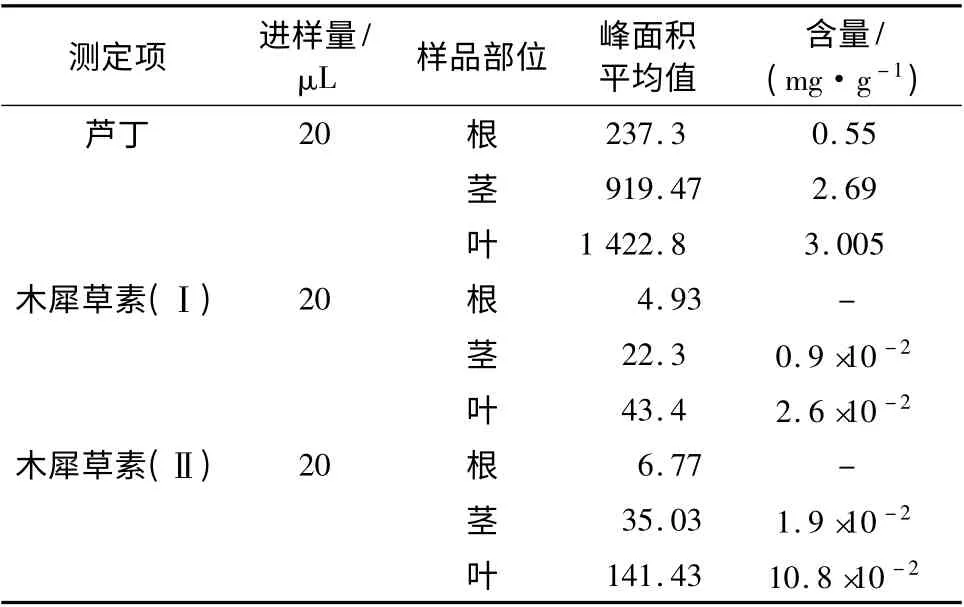
表1 样品测定结果Table 1 Disporam cantoniense(Lour.)Merr.samples for the determination of results
由表1 可知,山竹花叶中芦丁含量最高,木犀草素叶中含量比茎中高,根中木犀草素未检出,经酸处理过的样品溶液中木犀草素比没有处理过的含量高。
3 结论
(1)在参考文献[4-8]中,芦丁的检测波长为368,358,510 nm,实验中发现在358 nm 处芦丁的峰型和峰面积均十分理想,故本实验采用358 nm 对芦丁进行检测。
(2)在参考文献[9-10]中木犀草素的检测波长为283,350 nm,实验中发现在350 nm 处木犀草素的峰型和峰面积均十分理想。故本实验采用350 nm对木犀草素进行检测。
(3)本实验采用反相高效液相色谱法,分别建立测定山竹花药材中芦丁、木犀草素的含量的方法,所用方法灵敏、简单易行,专属性、重复性、回收率均符合要求。
(4)对比木犀草素样品溶液(Ⅰ)、(Ⅱ)的结果可以看出,经酸处理过的样品溶液中木犀草素含量更高,说明山竹花中的黄酮苷类成分在酸性条件下发生了水解,从而测得样品中木犀草素的含量升高。
[1] 西北植物研究所. 秦岭植物志[M]. 北京:科学出版社,1976:353.
[2] 胡本祥,张学民,董丽君.竹叶参的生药学研究[J].西北药学杂志,1995,10(1):16-18.
[3] 陈磊.百合科两种药用植物化学成分及生物活性研究[D].天津:天津大学,2009.
[4] 覃成,高键,罗希榕.苦苣菜总黄酮提取工艺及HPLC法测定芦丁的含量[J].贵州农业科学,2010,38(35):199-201.
[5] 冯薇,王文全,赵平然.甘草总黄酮含量测定方法研究[J].时珍国医国药,2007,18(11):2608-2610.
[6] 刘丽萍,唐克华,张敏,等. 阔叶十大功劳叶与花总黄酮提取及含量测定[J]. 中国野生植物资源,2007,26(1):33-35.
[7] 李宁,李楚. 银杏叶总黄酮提取工艺的正交设计研究[J]. 西农业大学学报:自然科学版,2010,30(1):74-76.
[8] 国家药典委员会. 中国药典:第一部[S].2010 版. 北京:中国医药科技出版社,2010:279.
[9] 高勇,马东升,邓立育.木犀草素的高效液相色谱分析[J].检验检疫学,2004,14(5):24-25.
[10]王柯,王艳艳,赵东保,等.HPLC 法测定金银花不同部位中木犀草素及其苷的含量[J].河南大学学报:自然科学版,2001,41(1):39-43.
