双孢蘑菇培养料发酵过程中细菌群落结构分析
2015-04-13魏启舜张洪海赵荷娟
王 琳, 李 敏, 魏启舜, 张洪海, 周 影, 赵荷娟
(1.江苏丘陵地区南京农业科学研究所,江苏 南京210046;2.南京农业大学资源与环境学院,江苏 南京210095;3.金坛市农林局)
堆肥是一个好氧能自身产热并通过微生物对有机物降解的固态发酵过程[1-4]。双孢蘑菇培养料发酵是一个类似堆肥的过程。目前国内双孢蘑菇培养料的制备主要采用二次发酵技术,一次发酵在发酵槽内进行,持续时间9 ~16 d,中间倒仓2 ~3 次,一次发酵过程中温度升高,促使堆料物质发生转化,发酵结束后,干物质减少30%左右。二次发酵在隧道内进行,是一个控温的过程,首先经历12 h 的巴氏消毒阶段,然后降温至50 ℃左右恒温发酵4 ~5 d,在高温菌的作用下物料转化成有利于蘑菇菌丝吸收利用的没有病原菌的选择性栽培基质。在这一过程中,各种嗜热微生物的生理代谢和群落演替发挥至关重要的作用。
关于堆肥中的微生物群落演替和多样性的研究较多,利用传统培养的方法从堆肥发酵初期分离出的细菌大多数属于Actinobacteria 和Bacilli[5-7],高温阶段分离出的主要种群是Thermus thermophilus,结束阶段分离出的细菌多为 Pseudomonasa 和 Xanthomona[8]。然而对双孢蘑菇培养料发酵过程中微生物群落变化信息相对较少[9],尤其对一次发酵阶段微生物群落结构变化的研究更少,因为相对二次发酵,一次发酵过程较慢,且发酵进程相对不可控制[10]。
微生物群落演替是决定双孢蘑菇培养料发酵成功与否的关键因素之一,微生物群落演变过程受到培养料原材料特性和一次发酵环境条件的影响,季节的变化不仅影响了堆温也影响了原材料的质量。本研究以PCR-DGGE 技术为基础,结合基因克隆等技术,探讨冬季和春季2 批培养料在一次发酵的不同阶段和二次发酵结束时的细菌群落结构,希望利用现代分子生态学的方法能够快速、准确地对培养料发酵过程中的微生物群落结构进行动态的检测,为今后培养料发酵的质量控制提供理论依据。
1 材料和方法
1.1 培养料的制作和取样
本试验的培养料取自江苏金坛市银湖食用菌有限公司,培养料的配方为:稻草20 000 kg、麦草10 000 kg、牛粪肥6 000 kg、复合肥300 kg、过磷酸钙800 kg、菜饼300 kg、石灰750 kg、石膏粉750 kg。培养料的一次发酵采用槽式发酵,发酵槽(宽4 m、长8 m、高4 m)配备强制通风系统,一次发酵翻堆3 次后转移至密闭的具有强制通风系统的二次发酵隧道内,二次隧道宽4 m、长6.5 m、高4 m,温度升至58 ℃时维持8 h,降温至48 ℃,保持5 d,此时培养料的氨气浓度小于1.0 ×10-7cm3/m3,pH 为7.6。
取样时间分别为:预湿后、一次翻堆后、二次翻堆后、三次翻堆后、二次发酵结束时。一次发酵过程包括一次翻堆、二次翻堆、三次翻堆。分别在冬季和春季各取1 批料,春季采样的时间为:2014 年5 月19 日、2014 年5 月25 日、2014 年5 月30 日、2014年6 月5 日、2014 年6 月10 日;冬季采样的时间为:2013 年12 月3 日、2013 年12 月10 日、2013 年12月16 日、2013 年12 月21 日、2013 年12 月28 日。
取样方法:样品取自表面以下50 cm,随机取3个点,每个点取样200 g,混匀后采用四分法,将样品液氮速冻后-70 ℃保存。
1.2 双孢蘑菇培养料样品DNA 的提取与分析
培养料样品DNA 的提取使用MP 公司的FastDNA SPIN Kit for Soil 试剂盒,提取方法按照说明书进行,取0.2 g 培养料进行提取。将提取好的DNA 作为PCR 的模板,对细菌16S rDNA 的V3 区进行扩增,使用引物为含有GC 夹子的GC338F:5'-CGCCCGGGGCGCGCCCCGGGGCGGGGCGGGGGCGCGGGGGGCCTACGGGAGGCAGCAG-3'和518 R:5'-ATTACCGCGGCTGCTGG-3'。PCR 反 应 程 序 为:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸l min,35 个循环;72 ℃延伸5 min。PCR反应的产物用1.5%(质量体积比)琼脂糖凝胶电泳检测。
1.3 变性梯度凝胶电泳(DGGE)
DGGE 程序按照文献[11]进行,10%丙烯酰胺凝胶,变性剂线性梯度为40% ~60%,1 ×TAE 缓冲液,上样量为每孔20 μl,220 V 电泳10 min 后60 V 60 ℃电泳16 h,电泳完毕后进行硝酸银染色。
DGGE 胶的主要条带分析按照以下程序:将主要条带切割下来浸入40 μl 无菌的DEPC 水中,4 ℃静置12 h,用于PCR 扩增,取1 μl 作为模板,用不含GC 夹338F 和518 R 引物扩增,将50 μl PCR 产物进行1.5%的琼脂糖凝胶电泳,然后使用Axygen 公司的胶回收试剂盒割胶回收。回收后的PCR 产物溶于20 μl TE (pH 8.0)缓冲液-20 ℃保存用于后续的酶连与转化。TA 克隆使用全式金生物公司的pEASY-T3 Cloning Kit。每个条带送3 个克隆子至南京思普金生物科技有限公司测序分析。
为了获得培养料中主要细菌种群的分类信息,对主要条带的16S rDNA V3 基因进行克隆测序与生物信息学分析。对不同发酵阶段的11 个条带(分别命名A、B、C、D、E、F、G、H、I、J、K)进行割胶回收、测序及BLAST 比对。
1.4 数据分析
序列在GenBank 数据库中进行Blast 比对,检索相近序列。对本试验获得的序列及数据库中的相近序列应用Clustal X 软件计算其亲缘关系,用Mega4软件构建系统发育树。DGGE 条带的比对和系统发育树的构建使用Quantity One(Bio-Rad)软件完成。用Quantity one 软件对DGGE 图谱进行分析,粗细不同的条带反映了DGGE 胶中样品的聚集密度,通过统计不同样品的条带数,计算样品细菌群落丰富度R 值(泳道上的条带数除以图谱中的总条带数)。
2 结果
2.1 DGGE 分析
从图1 可以看出,培养料发酵过程中不同时间段样品的16S rRNA V3 片段都得到了很好的分离,每一条带由16S rDNA 序列解链特性相近的细菌物种组成,代表不同的细菌种群[12],电泳条带越多说明细菌种群数量越多[13]。整个培养料发酵过程中细菌多样性较为丰富,并且存在明显的演替过程,建堆初期的带谱与一次翻堆后的带谱差异明显,一次发酵结束时的带谱与二次发酵结束时的带谱差异最为明显,一次翻堆后、二次翻堆后、三次翻堆后(一次发酵期间)的DGGE 条带相似性较高,其中优势条带B 和C 在一次发酵过程中都存在。二次发酵过程中存在一些特异性条带如条带G、条带F、条带J 和条带K。在发酵的每个阶段都有特有的细菌种类(图1)。本次研究培养料发酵过程中的细菌群落结构至少经历了3 个阶段的演替,即建堆初期、一次发酵阶段和二次发酵阶段。
春季和冬季培养料在一次发酵过程中DGGE图谱条带数的变化呈现的趋势比较一致(图2),一次翻堆后有所增加,随着发酵时间的增加有所降低。但是二次发酵之后,冬季培养料的DGGE 图谱条带数减少而春季培养料的DGGE 图谱条带数增加。样品不同时期细菌的丰富度(R)和DGGE 图谱的条带数变化趋势是一致的。
对不同样品间细菌群落相似性聚类分析(图3),10 个样品大致可以分为3 类:第1 类是样品8和样品9,第2 类是样品5 和样品10,第3 类是样品2、样品3、样品4、样品6 和样品7。说明培养料中细菌群落相似性与发酵的温度及进程是密切相关的。
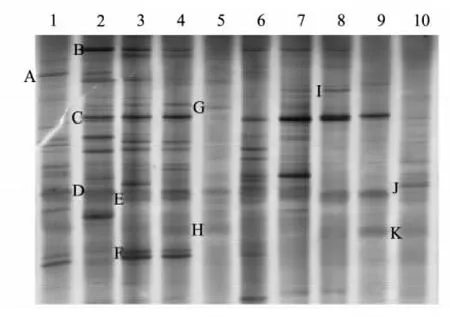
图1 春季和冬季培养料发酵不同阶段的16S rDNA V3 PCR 产物DGGEFig.1 DGGE profiles of 16S rDNA V3 fragments from compost samples of two composting cycles(spring and winter)
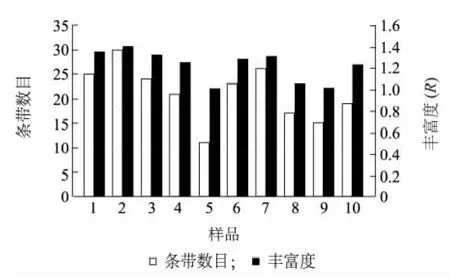
图2 不同时间段培养料样品的多样性指数Fig.2 Bacteria diversity index(R)of the mushroom compost during different fermentation stages
条带B、条带C、条带D、条带E 在2 批料的一次发酵过程中均存在,目的条带B、条带C 一次发酵期间浓度较大,到了二次发酵结束后消亡,目的条带D 在一次发酵中很明显而到二次发酵结束逐渐减弱。条带F 在春季培养料一次发酵过程中出现而在冬季培养料中不明显。二次发酵结束后春季和冬季培养料中的DGGE 条带的数目有一些差异,但通过样品间细菌群落相似性的聚类分析(图3)发现样品5 和样品10 被归在一组,说明2 批料发酵结束之后细菌种群之间具有较大的相似性。
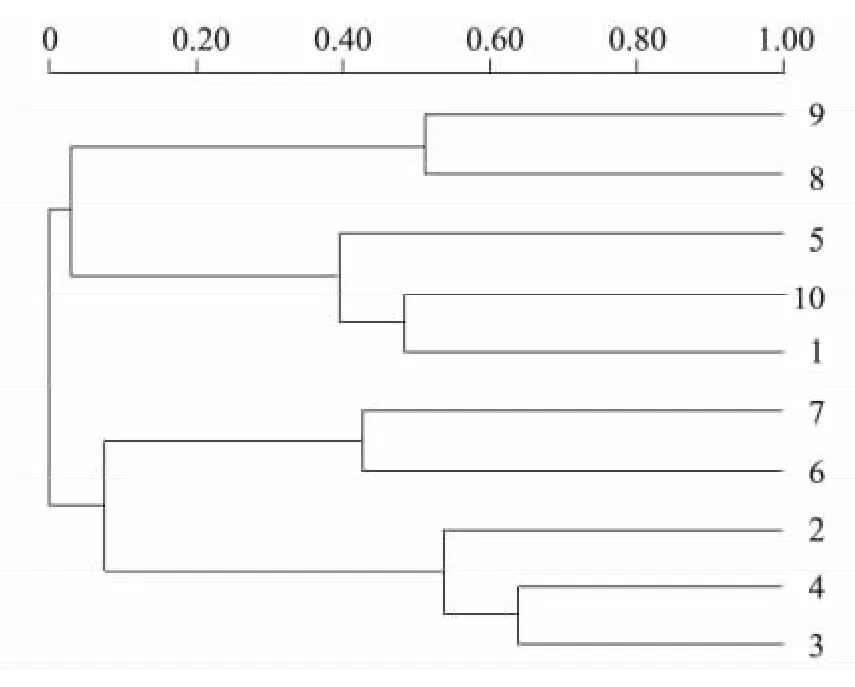
图3 不同样品细菌群落相似性的聚类分析Fig.3 Clustering analysis of bacterial community in different soil samples
2.2 DGGE 图谱中主要条带的序列测定
DGGE 分析方法通过条带测序可以直接与日益丰富的数据库中的序列直接进行比较,从而较为精确地了解微生物种群结构[14],割胶测序之后获得系统发育信息(表1)。一般情况下认为,2 种细菌16S rDNA 序列同源性为95.10% ~98. 00% 时属于不同种,而同源性为93.1% ~95. 0%时,则属于不同的属[15],这11 个优势条带所代表的细菌属于厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、高温异常球菌门(Deinococcus-Thermus)和放线菌门(Actinobacteria)以及未知分类地位的细菌种群。
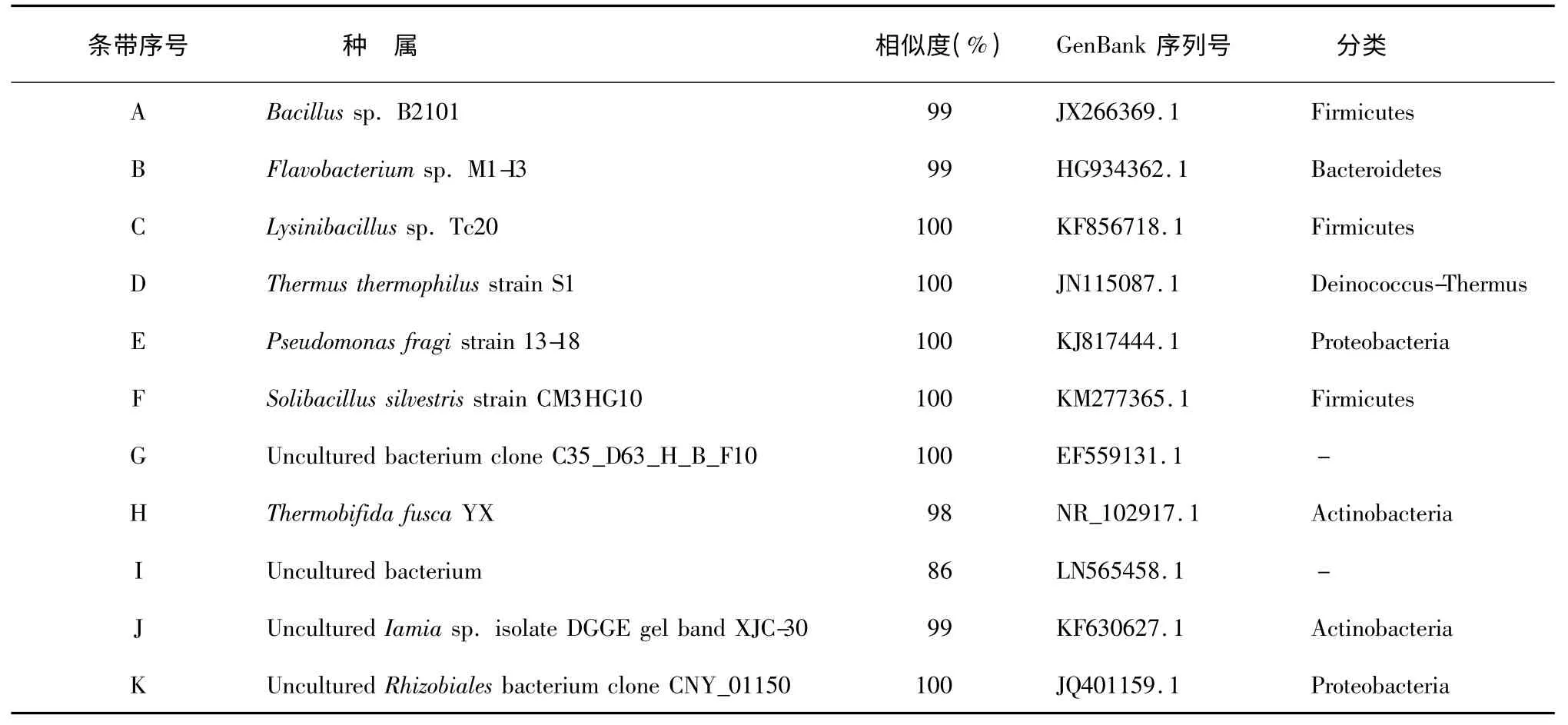
表1 目的条带的序列比对结果Table 1 Phylogenetic affiliations of DNA identified by DGGE
一次发酵过程与二次发酵过程中细菌群落的多样性差异较大,有些条带在一次发酵中存在但在二次发酵中消失,一次发酵中的细菌主要为芽孢杆菌(Bacillus)、黄杆菌(Flavobacterium)、假单胞菌(Pseudomonas fragis、Solibacillus silvestris)和高温菌(Thermus thermophilus),其中高温菌在二次发酵中一直存在,二次发酵过程的微生物多数为不可培养的细菌种群。
将11 条序列构建系统发育树,如图4 所示,其中有一类分支包括条带A、条带C、条带F,以Bacillus 属为代表的Bacilli 纲,该分支的细菌主要活跃在一次发酵阶段。另一分支其细菌类群较为复杂,条带B 代表的细菌和Flavobacterium spp.黄杆菌序列100%同源,条带G 代表了一类不可培养的细菌,条带E 代表的细菌和Pseudomonas fragi 假单胞菌的序列98%同源,条带D 代表的细菌和Thermus thermophilus 序列的同源性为94%,条带H 代表的Thermobifida fusca 和条带J 代表的细菌均是Actinobacteria 门的成员;条带I、条带K 所代表的一类细菌目前尚未获得培养。
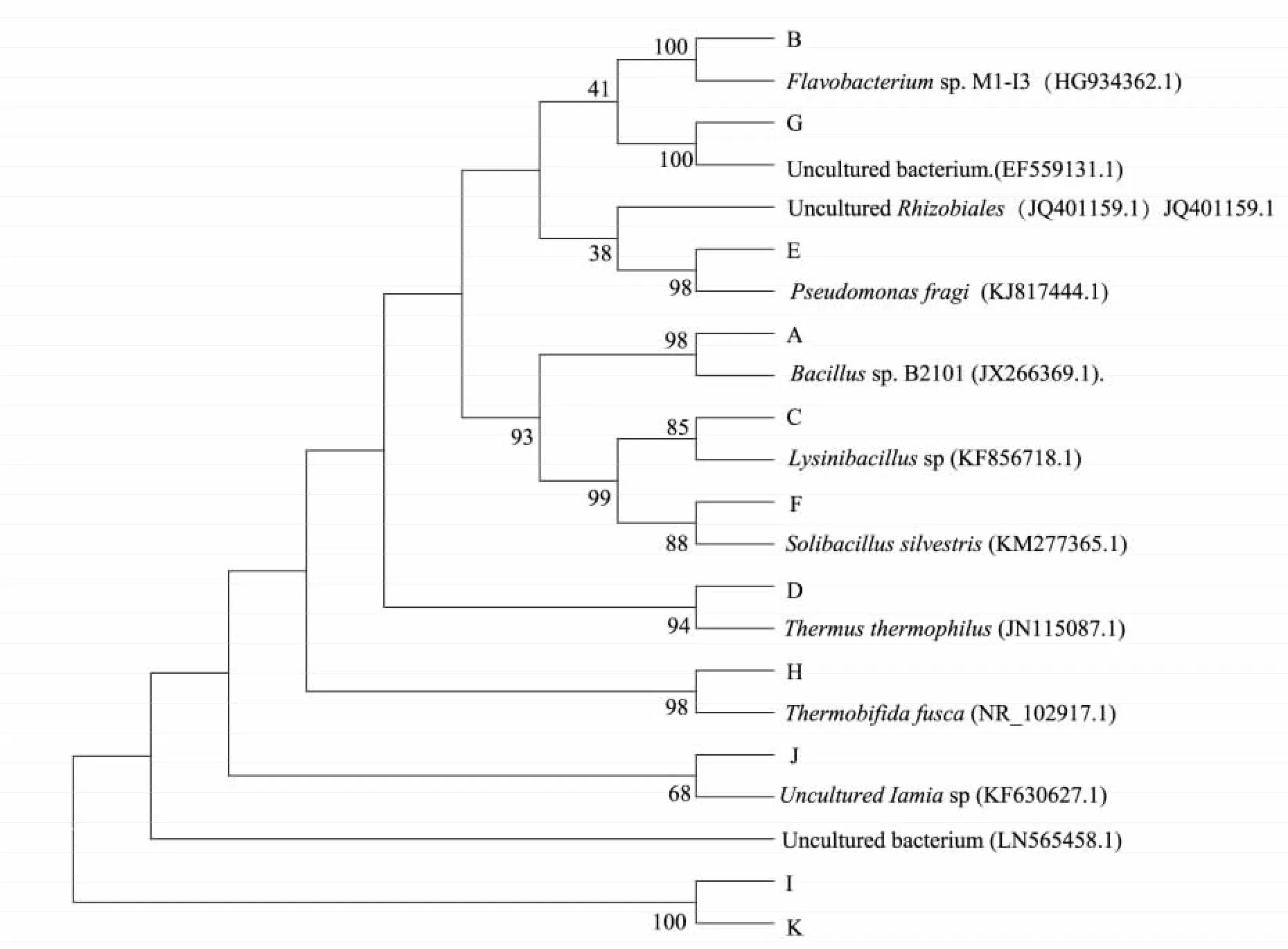
图4 DGGE 主要条带的系统发育分析Fig.4 Phylogenetic analysis of the predominant bands based on DGGE profile
3 讨论
本研究利用DGGE 分析了2 个不同季节双孢蘑菇培养料一次发酵不同阶段和二次发酵结束后细菌的菌落结构,发现双孢蘑菇培养料中具有丰富的细菌群落,其中细菌组成要远远丰富于人们用传统的分离方法所获得的类群[16]。在发酵的不同阶段,堆温和物料的理化性状不断地发生变化,培养料中的细菌群落结构也在发生变化。不同的季节双孢蘑菇培养料发酵的不同阶段的细菌结构有一些不同,春季培养料的细菌多样性大于冬季培养料,因为培养料中细菌的生长繁殖和更替会受到环境温度的影响从而影响发酵进程。但不同季节,细菌的丰度和多样性的变化趋势较为一致。Anna J. Székely 等使用DGGE 方法,同时采用基于内切酶BsuRⅠ和Hin6Ⅰ酶切的T-RFLP 的方法对冬季和夏季蘑菇培养料进行菌落结构分析,发现由于夏季的环境温度高,所以培养料中高温菌比冬季早出现[9]。
对DGGE 主要条带的测序分析可以了解到培养料中细菌的主要优势种属在发酵进程中的演变。有些嗜温菌如Psedomaonas 是生长迅速、生态幅比较广泛的细菌种属,因此在本研究的蘑菇培养料中也有发现。除此以外,本研究发现一些具有木质纤维素降解功能的细菌菌种,如高温菌Thermus thermophilus 在一次发酵和二次发酵中均存在,因为二次发酵过程中经过巴氏消毒后环境温度控制在48 ~50 ℃维持4 ~5 d,所以这种高温菌容易成为主导菌群。何丽鸿等[16]在二次发酵刚开始和即将结束的双孢蘑菇培养料中也分别检测到了Thermus thermophilus。Anna J.Székely 等人利用DGGE 检测到双孢蘑菇培养料发酵的高温阶段的主要菌群为Thermus thermophilus[9],该菌能够产生木聚糖降解酶参与半纤维素的降解[17]。大量研究结果表明,在堆肥高温期,主要微生物是链霉菌和微单胞杆菌,其中87%的高温菌属于杆菌属[18],且多数细菌具有纤维素降解能力。二次发酵过程中检测到属于Actinobacteria 门的Thermobifida(条带H 和条带J)也具有较强的纤维素和半纤维素降解能力[19]。细菌在培养料的发酵过程中起着重要的作用,根据细菌的种类和作用,调节发酵的工艺控制培养料中细菌的类群,充分发挥有益菌种的协同作用,杜绝有害菌的生长,对于提高双孢蘑菇培养料质量从而增加蘑菇产量有重要意义。
[1] GERRITS J P G. Nutrition and compost[C]//VAN GRIENSVEN L J L D. The cultivation of mushrooms. Rustington:Darlington Mushroom Laboratories,1988:29-72.
[2] 张盛华,郑凯琪,薛红波,等.城市污泥堆肥过程中腐殖酸及重金属形态的变化[J].江苏农业学报,2014,30(6):1350-1354.
[3] 林 英,王纪章,赵青松,等.堆肥对植物土传病害抑制作用研究进展[J].江苏农业科学,2014,42(12):168-171.
[4] 蒋宝南,单建明,曹启峰.堆肥发酵CO2施肥对大棚草莓生长、产量、品质的影响[J].江苏农业科学,2014,42(11):183-184.
[5] WANG C M,SHYU C L,HO S P,et al. Species diversity and substrate utilization patterns of thermophilic bacterial communities in hot aerobic poultry and cattle manure composts[J]. Microbial Ecology,2007,54(1):1-9.
[6] DEES P M,GHIORSE W C. Microbial diversity in hot synthetic compost as revealed by PCR-amplified rRNA sequences from cultivated isolates and extracted DNA[J]. FEMS Microbiology Ecology,2001,35(2):207-216.
[7] SONG J,WEON H Y,YOON S H,et al. Phylogenetic diversity of thermophilic actinomycetes and Thermoactinomyces spp. isolated from mushroom composts in Korea based on 16S rRNA gene sequence analysis[J]. Fems Microbiology Letters,2001,202(1):97-102.
[8] PETERS S,KOSCHINSKY S,SCHWIEGER F,et al. Succession of microbial communities during hot composting as detected by PCR-single-strand-conformation polymorphism-based genetic profiles of small-subunit rRNA genes[J]. Applied and Environmental Microbiology,2000,66(3):930-936.
[9] SZEKELY A J,SIPOS R,BERTA B,et al. DGGE and T-RFLP analysis of bacterial succession during mushroom compost production and sequence-aided T-RFLP profile of mature compost[J].Microbial Ecology,2009,57(3):522-533.
[10] SONG T T,CAI W M,JIN Q L,et al. Comparison of microbial communities and histological changes in Phase I rice straw-based Agaricus bisporus compost prepared using two composting methods[J].Scientia Horticulturae,2014,174:96-104.
[11] MUYZER G,DE WAAL E C,UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J]. Applied and Environmental Microbiology,1993,59(3):695-700.
[12] YANG C H,CROWLEY D E. Rhizosphere microbial community structure in relation to root location and plant iron nutritional status[J]. Applied and Environmental Microbiology,2000,66(1):345-351.
[13] KONSTANTINOV S R,ZHU W Y,WILLIAMS B A,et al. Effect of fermentable carbohydrates on piglet faecal bacterial communities as revealed by denaturing gradient gel electrophoresis analysis of 16S ribosomal DNA[J]. Fems Microbiology Ecology,2003,43(2):225-235.
[14] TIEDJE J M,ASUMING-BREMPONG S,NÜSSLEIN K,et al. Opening the black box of soil microbial diversity[J]. Applied Soil Ecology,1999,13(2):109-122.
[15] 刘石泉,胡治远,赵运林. 基于DGGE 技术的茯砖茶发花过程细菌群变化分析[J]. 生态学报,2014,34(11):3007-3015.
[16] 何丽鸿,陈明杰,潘迎捷. 采用变性梯度凝胶电泳研究双孢蘑菇培养料后发酵过程中的细菌群落结构[J]. 微生物学报,2009,49 (2):227-232.
[17] LYON P F,BEFFA T,BLANC M,et al. Isolation and characterization of highly thermophilic xylanolytic Thermus thermophilus strains from hot composts[J]. Canadian Journal of Microbiology,2000,46(11):1029-1035.
[18] 喻 曼,肖 华,张 棋,等. PLFA 法和DGGE 法分析堆肥细菌群落变化[J]. 农业环境科学学报,2011,30(6):1242-1247.
[19] 韩 铭,袁月祥,闫志英,等. 一株产耐热纤维素酶菌株的筛选及酶学性质[J]. 应用与环境生物学报,2012,18(1):75-79.
