遮阴对樟叶槭容器苗生长和生理特性的影响
2015-04-13钱萍仙李学孚吴月燕饶慧云李美芹
钱萍仙, 李学孚,2, 吴月燕, 饶慧云, 刘 蓉, 李美芹,2, 付 涛
(1.浙江万里学院生物与环境学院,浙江 宁波315100;2.上海海洋大学水产与生命学院,上海201306;3.宁波城市职业技术学院,浙江 宁波315502)
樟叶槭(Acer cinnamomifolium Hayata)为槭树科(Aceraceae)槭属(Acer. L)树种,为常绿树种,叶密集,树荫浓密,是优良的庭园树和行道树种。樟叶槭耐半荫,喜温暖湿润气候,不耐寒,主要分布于长江以南。樟叶槭繁殖方式主要为种子或扦插繁殖,但成苗率较低、质量较差,直接影响园林景观效果和生态效益,也难以满足定向、优质和标准化培育需要,而容器育苗对提高樟叶槭成活率和标准化育苗起到极为重要的作用。在中国南方,夏季强光是影响容器育苗生长发育的关键因素,对苗木的生长、光合作用、蒸腾作用、呼吸作用、物资运输与合成等均会产生深刻影响,适当的遮阴有利于苗木的生长发育[1]。目前关于樟叶槭容器育苗报道较少,尤其对樟叶槭容器苗光的适应性缺乏系统研究。本试验通过研究樟叶槭容器苗在不同遮阴条件下生长及生理的变化,探讨适合樟叶槭容器苗生长的遮阴条件,以期为其科学栽培管理提供理论依据。
1 材料与方法
1.1 试验材料
以2 年生樟叶槭幼苗为试验材料,材料来自浙江万里学院葡萄大棚栽培试验地,试验时间为2014年5 月~2014 年8 月。
1.2 试验设计
2014 年5 月2 日,选择200 株2 年生樟叶槭幼苗,栽于无纺布网袋容器(直径为15 cm×15 cm,高度20 cm)。采用泥炭:珍珠岩(7∶ 3)为基质,每盆装基质460 g,可控性缓释肥(N∶ P2O5∶ K2O=18∶18∶ 8)施肥量2 kg/m3,基质有机质42 g/kg,碱解氮125 mg/kg,速效磷94 mg/kg,速效钾213 mg/kg,pH 6.5。待幼苗长至40 cm,选择160 株生长状况良好的樟叶槭植株,2014 年5 月15 日进行遮阴处理,共设3 个处理:处理Ⅰ为1 层膜遮阴,遮阴率约30%;处理II 为2 层膜遮阴,遮阴率约55%;处理III 为3层膜遮阴,遮阴率约75%;以无遮盖作为对照(CK)。每个处理40 株,在第0 d、30 d、60 d、90 d 进行光合作用参数以及各种生理生化指标的测定,第90 d 进行形态特征的观测。采样时各处理随机选取10 株植株,于每株植株茎的中上部采集叶片,清洁干净,立即置于-80 ℃冰箱,用于各种生理生化指标的测定。
1.3 测定方法
采用LA-S 全能型植物图像分析仪系统统计株高、叶片数、单株叶面积、根系总长、根直径和须根数,再将根系剪下称质量,每个处理随机选取6 株,重复5 次。
叶绿素含量的测定采用丙酮提取分光光度法[2]。丙二醛含量的测定采用硫代巴比妥酸法[3]。还原型谷胱甘肽的测定采用间接分光光度法[3]。过氧化氢酶活性的测定采用高锰酸钾滴定法[2],过氧化物酶活性的测定采用愈创木酚比色法[4],超氧化物歧化酶的测定采用氮蓝四唑法[3]。
采用GFS-3000 光合测定仪于12∶ 00 -14∶ 00在充足阳光下随机测定植株中部功能叶片的光合速率(Pn)、蒸腾速率(Tr)、胞间CO2浓度(Ci)和气孔导度(Gs)。测定条件为:叶片温度24 ℃,相对湿度(RH)70% ~80%,光合有效辐射(PAR)900 μmol/(m2·s),photons。测定时,每个处理随机选取6 片,重复3 次。
2 结果与分析
2.1 遮阴处理对樟叶槭容器苗形态特征的影响
如表1 所示,在弱光胁迫下,樟叶槭容器苗形态特征发生了显著变化。与无遮阴对照相比,处理Ⅰ生长状况良好,株高、叶片数、单株叶面积、根系质量、根直径、根系总长和须根数均显著增加(P <0.05);处理Ⅱ和处理Ⅲ株高、叶片数、单株叶面积、根系质量、根直径、根系总长以及须根数均显著下降(P <0.05),试验结果表明,适当的遮阴有利于樟叶槭容器苗的生长,而随着弱光胁迫强度的增强,樟叶槭容器苗生长显著受到影响。
2.2 遮阴处理对樟叶槭容器苗叶片光合作用参数的影响
2.2.1 遮阴处理对樟叶槭容器苗叶片叶绿素含量的影响 如图1 所示,不同遮阴处理对樟叶槭容器苗叶绿素总量、叶绿素a(Chl.a)、叶绿素b(Chl.b)和叶绿素a/b(Chl.a/Chl.b)有显著影响。处理Ⅰ叶片叶绿素总量、Chl. a、Chl. a/Chl. b 均显著高于对照(P <0.05),Chl.b 与对照差异不显著(P >0.05);处理Ⅱ、处理Ⅲ叶片叶绿素总量、Chl.a、Chl.b、Chl.a/Chl.b均显著低于对照(P <0.05)。表明,夏季适当的遮阴有利于叶绿素的合成,促进叶片的光合作用,而光照强度过低不利于叶片的光合作用。
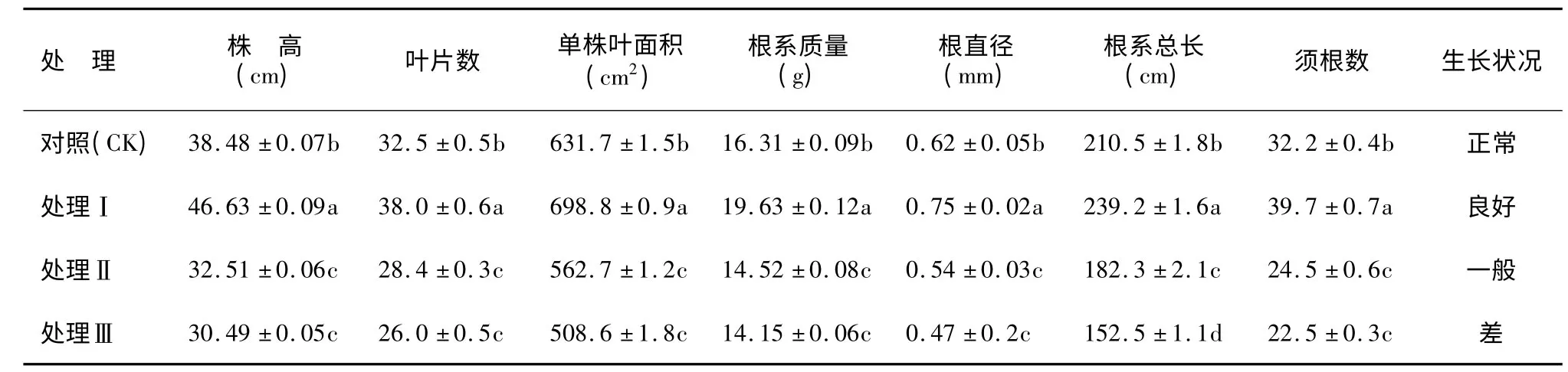
表1 遮阴处理对樟叶槭容器苗形态特征的影响Table 1 Effects of shading on the morphological characteristics of container seedlings
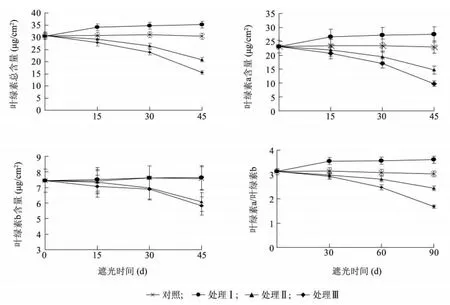
图1 遮阴处理对樟叶槭容器苗叶片中叶绿素含量的影响Fig.1 Effects of shading on the chlorophyll contents in container seedling leaves
2.2.2 遮阴处理对樟叶槭容器苗气体交换参数的影响 如图2 所示,不同遮阴处理对樟叶槭容器苗叶片气体交换参数有显著的影响。处理Ⅰ叶片净光合速率(Pn)、蒸腾速率(Tr)和气孔导度(Gs)均显著高于对照(P <0.05);处理Ⅱ、处理Ⅲ叶片Pn、Tr、Gs均显著低于对照(P <0.05)。处理Ⅰ叶片胞间CO2浓度(Ci)显著高于对照(P <0.05);处理Ⅱ、处理Ⅲ叶片Ci均先下降后升高。结果表明,夏季适当的遮阴会促进樟叶槭容器苗叶片光合作用,而光照强度过低会抑制叶片光合作用。
2.3 遮阴处理对樟叶槭容器苗丙二醛含量及保护酶活性的影响
2.3.1 遮阴处理对樟叶槭容器苗叶片丙二醛含量的影响 叶片中丙二醛(MDA)含量的高低是细胞膜系统结构是否遭受破坏的重要指标之一。图3 显示,不同遮阴处理对樟叶槭容器苗丙二醛含量有显著的影响。处理I 叶片MDA 含量显著低于对照(P <0. 05);处理Ⅱ和处理Ⅲ叶片MDA含量均显著高于对照(P <0. 05)。表明光照强度过低会加快樟叶槭容器苗生物膜的损害。
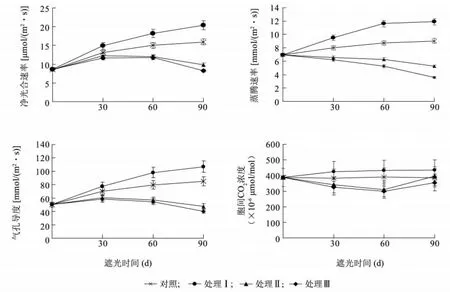
图2 遮阴处理对樟叶槭容器苗叶片气孔交换参数的影响Fig.2 Effects of shading on stomatal exchange parameters in container seedling leaves
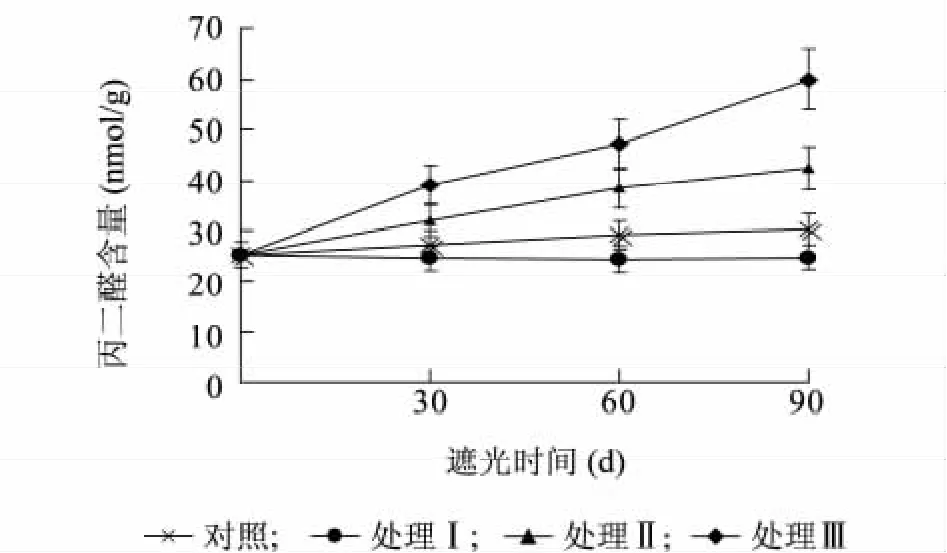
图3 遮阴处理对樟叶槭容器苗叶片丙二醛含量的影响Fig.3 Effects of shading on the MDA content in container seedling leaves
2.3.2 遮阴处理对樟叶槭容器苗叶片保护酶活性的影响 图4 显示,弱光胁迫下,处理I 叶片还原性谷胱甘肽酶(GSH)、过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)均显著高于对照(P <0.05);处理Ⅱ、处理Ⅲ叶片GSH、POD、CAT、SOD 均显著低于对照(P <0.05)。表明夏季适当的遮阴有利于保护酶的合成与积累,而随着胁迫强度的增加,保护酶活性会遭到破坏。
3 讨论
根系作为植物吸收水分和营养并进行物质转化和储藏的重要器官,其发育情况直接影响地上部的形态建成,良好的根系发育对地上部的生长具有重要意义[5-9]。在本研究中,1 层遮阴处理的樟叶槭容器苗根系生长良好,2 层和3 层遮阴处理的根系生长受到影响。表明夏季适当的遮阴有利于樟叶槭容器苗根系生长,而光照度过低会抑制其根系生长。
叶片是进行光合作用和呼吸作用等生理代谢活动的重要器官,对光照度变化最敏感[10]。吴月燕等[1]对木荷等树种叶片特征研究结果表明,30%遮阴条件可有效促进叶片的生长,使叶片整体的生长发育最好,且生产力指数最大。在本研究中,1 层遮阴处理促进樟叶槭容器苗叶片生长,2 层和3 层遮阴处理抑制叶片生长。
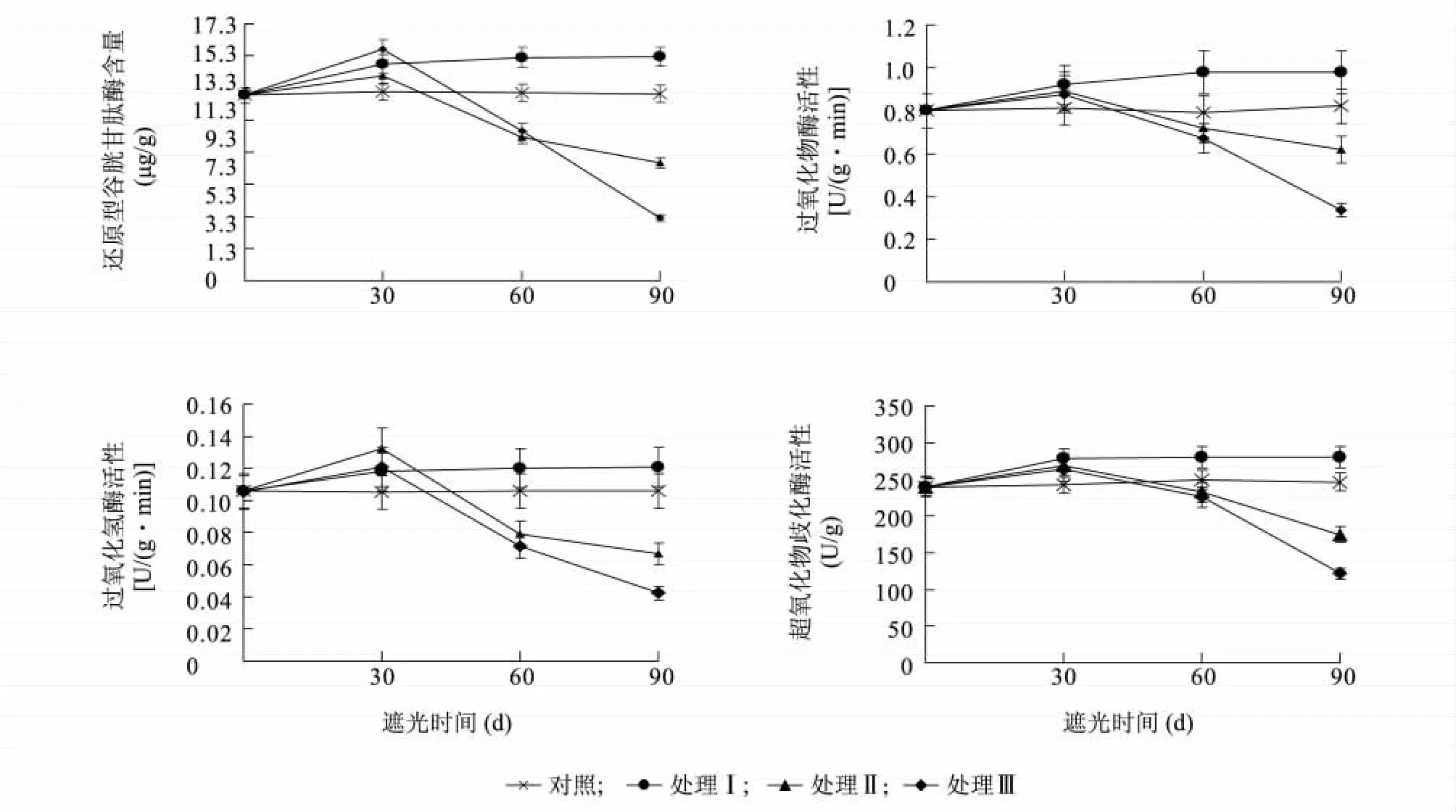
图4 遮阴处理对樟叶槭容器苗叶片保护酶的影响Fig.4 Effects of shading on the protective enzyme activities in container seedling leaves
光合作用是植物生长和产量形成的重要基础,而叶绿素是植物进行光合作用的主要色素,其合成和降解处于动态平衡,其含量的大小可以表明植物在弱光胁迫下光合作用的强弱[11-12]。叶绿素a 的功能主要是将汇聚的光能转变为化学能进行光化学反应,而叶绿素b 则主要是收集光能[13]。在本研究中,1 层遮阴处理叶绿素总量、Chl. a 均显著升高,2层和3 层遮阴处理叶绿素总量、Chl.a、Chl.b 均显著下降,可能是由于夏季光照度较高导致了叶绿素分解,而适当的遮阴有利于樟叶槭容器苗叶绿体基粒的形成,这与吴正锋[14]等人对于花生的研究结果一致。不同光环境中,植物通常会通过改变这2 种光合色素的比例适应环境因子的变化,叶绿素a/b 是植物耐荫性的重要指标之一[15]。在本研究中,1 层遮阴处理Chl.a/Chl.b显著升高,而2 层和3 层遮阴处理Chl.a/Chl.b 显著下降,可能是由于弱光胁迫下,Chl.a 比Chl.b 更敏感。
光合作用是植物最基本的生命活动,是植物合成有机质和获取能量的根本来源,是对逆境胁迫响应最为敏感的生理过程之一,常常被用来快速鉴定植物的抗逆性[16-19]。净光合速率是植株光合作用的重要指标之一,而净光合速率的下降受气孔限制和非气孔限制两个因素影响[20]。在本研究中,Gs和Tr的变化基本与Pn一致,表明弱光胁迫下气孔限制是导致樟叶槭容器苗净光合速率降低的主要原因之一,这与前人对于高粱的研究结果[21]基本一致。但弱光胁迫后期(胁迫后90 d 时)Ci有所升高,表明在胁迫后期,非气孔限制占了主导因素,可能是由于随着胁迫加重,叶肉细胞中叶绿体结构受到破坏[22]。
弱光胁迫后樟叶槭容器苗叶片的生理生化过程发生了一系列变化。丙二醛是生物膜系统脂质过氧化作用的主要产物之一,其含量的高低常被作为反映细胞膜脂过氧化作用强弱和质膜被破坏程度的一个重要指标[23]。在植物细胞遭受逆境胁迫时,细胞膜发生氧化分解,MDA 大量积累,其含量越高表明植物抗逆境能力越差[24]。在本研究中,1 层遮阴处理的叶片MDA 含量最低,而随着遮阴强度的增加,MDA 含量显著升高,可能是由于光照过强或过弱都会引起植物细胞膜透性增大,胞内电解质外渗,同时出现膜脂过氧化,进而导致MDA 含量升高,而夏季适当的遮阴可以避免光照过强对叶片细胞生物膜的损害。
植物体内存在着一套抗氧化系统,负责清除活性氧的产生,其清除能力是衡量植物抗逆性的关键指标之一[25-27]。过氧化物酶(POD)、过氧化氢酶(CAT)和超氧化物歧化酶(SOD)是植物体内清除活性氧自由基的3 种关键酶[28]。SOD 是植物抗氧化系统的第一道防线,它可以使Mehler 反应中产生的活性氧转化成H2O2,然后通过CAT、POD 等将H2O2转化为H2O 和O2,从而减少细胞膜的伤害[29]。普遍存在于植物体内的谷胱甘肽酶有利于维持组织的抗氧化特性,此外,在调节对氧化还原敏感的信号传导中也起着关键性的作用。还原性谷胱甘肽酶(GSH)含量与植物对各种生物异源物质及非生物环境胁迫的忍耐密切相关,是胞内代谢过程和植物遭受氧化胁迫时产生的过氧化物的最有效的清洁剂之一[11]。在本研究中,1 层遮阴处理樟叶槭容器苗GSH、POD、CAT、SOD 活性均显著升高,而2 层和3层遮阴处理樟叶槭容器苗GSH、POD、CAT、SOD 活性均先升高后快速下降,可能是由于夏季适当的遮阴提高了植物抗氧化能力,而光照度过低直接损害了植物抗氧化系统。
综合以上研究结果发现,1 层遮阴条件下,樟叶槭容器苗根系和叶片生长都优于对照,过度遮阴使其生长受迫。因此,在中国南方地区,夏季可以对樟叶槭容器苗进行适当的遮阴以促进其生长。
[1] 吴月燕,项锡娜,王忠华,等. 光胁迫对容器幼苗生长和生理生化特性的影响[J]. 植物生理学报,2013,49 (5):469-476.
[2] 刘 萍,李明军. 植物生理学实验技术[M]. 北京:科学出版社,2007:39-42,125-130.
[3] 李 玲. 植物生理学实验指导[M]. 北京:科学出版社,2009:80-82,100-102,98-99.
[4] 郑柄松. 现代植物生理生化研究技术[M]. 北京:气象出版社,2006:41-42.
[5] 孙三杰,李建明,宗建伟,等. 亚低温与干旱胁迫对番茄幼苗根系形态及叶片结构的影响[J]. 应用生态学报,2012,23(11):3027-3032.
[6] 季 杨,张新全,彭 燕,等. 干旱胁迫对鸭茅幼苗根系生长及光合特性的影响[J]. 应用生态学报,2013,24(10):2763-2769.
[7] 乔俊卿,夏彦飞,刘邮洲,等.Bacillus subtilis PTS-394 对番茄根系及根围微生态的影响[J]. 江苏农业学报,2014,30(6):1304-1308.
[8] 崔世钢,杨莉莉,吴兴利,等.图像分析法测量植物生长柜中的根系形态[J].江苏农业科学,2014,42(10):383-385.
[9] 郭 瑾,薛永来,杜道林. 植物激素调控拟南芥根系发育的研究进展[J].江苏农业科学,2014,42(5):7-10.
[10] 孙 璐,周宇飞,李丰先,等. 盐胁迫对高粱幼苗光合作用和荧光特性的影响[J]. 中国农业科学,2012,45(16):3265-3272.
[11] 吴月燕,崔 鹏,李 波. 薄膜覆盖对葡萄生长和生理特性的影响[J]. 果树学报,2011,28(6):991-997.
[12] 富 军,赵长星,闫萌萌,等. 栽培方式对夏直播花生叶片光合特性及产量的影响[J]. 应用生态学报,2013,24(3):747-752.
[13] 王建华,任士福,史宝胜,等. 遮荫对连翘光合特性和叶绿素荧光参数的影响[J]. 生态学报,2011,31(7):1811-1817.
[14] 李应旺,吴正锋,万书波,等. 弱光胁迫对花生生长发育和生理特性的影响[J]. 花生学报,2009,38(3):41-45.
[15] 张 云,夏国华,马 凯,等. 遮阴对堇叶紫金牛光合特性和叶绿素荧光参数的影响[J]. 应用生态学报,2014,25(7):1940-1948.
[16] MASSACCI A,NABIV S M,PIETROSANTI L,et al. Response of photosynthesis apparatus of cotton to the onset of drought stress under field conditions by gas change analysis and chlorophyll fluorescence imaging[J]. Plant Physiol Biochem,2008,46:189-195.
[17] 薛惠云,张永江,刘连涛,等. 干旱胁迫与复水对棉花叶片光谱、光合和荧光参数的影响[J]. 中国农业科学,2013,46(11):2386-2393.
[18] FLOWERS M D,FISCUS E L,BURKEY K O,et al. Photosynthesis,chlorophyll fluorescence,and yield of snap bean (Phaseolus vulgaris L.)genotypes differing in sensitivity to ozone[J]. Environ Exp Bot,2007,61:190-198.
[19] NAUMANN J C,YOUNG D R,ANDERSON J E. Linking leaf chlorophyll fluorescence properties to physiological responses for detection of salt and drought stress in coastal plant species[J].Physiol Plant,2007,131:422-433.
[20] SINGH S K,REDDY K R. Regulation of photosynthesis,fiuorescence,stomatal conductance and water-use efficiency of cowpea(Vigna unguiculata L.)under drought[J]. Journal of Photochemistry and Photobiology B:Biology,2011,105(1):40-50.
[21] 王 鑫,李志强,谷卫彬,等. 盐胁迫下高粱新生叶片结构和光合特性的系统调控[J]. 作物学报,2010,36(11):1941-1949.
[22] 秦玉芝,邢 铮,邹剑锋,等. 持续弱光胁迫对马铃薯苗期生长和光合特性的影响[J]. 中国农业科学,2014,47(3):537-545.
[23] 张智猛,戴良香,宋文武,等. 干旱处理对花生品种叶片保护酶活性和渗透物质含量的影响[J]. 作物学报,2013,39(1):133-141.
[24] 周曙光,孔祥生,张妙霞,等. 遮荫对牡丹光合及其他生理生化特性的影响[J]. 林业科学,2010,46(2):56-60.
[25] 尹承苗,张先富,胡艳丽,等. 不同浓度有机物料发酵流体对连作苹果幼树叶片光合荧光参数和根系抗氧化酶活性的影响[J]. 中国农业科学,2014,47(9):1847-1857.
[26] 崔豫川,张文辉,李志萍. 干旱和复水对栓皮栎幼苗生长和生理特性的影响[J]. 林业科学,2014,50(7):66-73.
[27] 曹永慧,周本智,陈双林. 弱光下水分胁迫对不同产地披针叶茴香幼苗生理特性的影响[J]. 生态学报,2014,34(4):814-822.
[28] AHMAD P,JALEEL C A,SALEM M A,et al. Roles of enzymatic and nonenzymatic antioxidants in plants during abiotic stress[J]. Critical Reviews in Biotechnology,2010,30(3):161-175.
[29] 刘 伟,艾希珍,梁文娟,等. 低温弱光下水杨酸对黄瓜幼苗光合作用及抗氧化酶活性的影响[J]. 应用生态学报,2009,20(2):441-445.
