下肢缺血再灌注对糖尿病大鼠坐骨神经的影响❋
2015-04-13黄达李鸣镝郑亚琳王秋虹林兰
黄达,李鸣镝,郑亚琳,王秋虹,林兰
(中国中医科学院广安门医院,北京100053)
下肢缺血再灌注对糖尿病大鼠坐骨神经的影响❋
黄达,李鸣镝,郑亚琳,王秋虹,林兰△
(中国中医科学院广安门医院,北京100053)
目的:观察下肢缺血再灌注对糖尿病大鼠坐骨神经的影响。方法:24只清洁级SD雄性大鼠分为正常组(n=6)和糖尿病组(n=18),糖尿病组采用链脲佐菌素造模。饲养1个月后,选择部分糖尿病大鼠(n=9)作为缺血再灌注组,暂时阻断腹主动脉、髂总动脉和股动脉3个h,再灌注7 d后测量各组大鼠坐骨神经传导速度和动作电位波幅,光镜、电镜下观察坐骨神经形态学变化。结果:糖尿病缺血再灌注大鼠坐骨神经传导速度和动作电位波幅均明显下降,并出现神经内膜水肿、神经纤维密度下降、异常神经纤维数目增多、髓鞘肿胀、裂解、轴索萎缩等变化。结论:下肢缺血再灌注可以造成糖尿病大鼠坐骨神经严重损伤,采用此方法可以在短期内建立糖尿病周围神经病变动物模型。
糖尿病周围神经病变;缺血再灌注;神经传导速度;形态学
糖尿病周围神经病变(Diabetic peripheral neuropathy,DPN)是糖尿病最常见的慢性并发症之一,也是目前的研究热点,其动物模型多从糖尿病动物中获得,随着成模时间的延长可逐渐观察到神经纤维功能和形态学变化[1-3]。国外报道糖尿病大鼠模型早期的生化和电生理改变与人类DPN相似,而周围神经病理形态学变化则较轻微[4]。在DPN新药研发过程中,考虑到实验周期以及动物死亡率等因素,多数实验在糖尿病模型建立后即开始给药,此时周围神经病变尚未形成,实验结果不能确切反映药物的治疗作用。本实验通过暂时阻断右侧坐骨神经的血液供应,以了解下肢缺血再灌注对糖尿病大鼠坐骨神经的损伤情况,并在此基础上探讨短期内建立DPN动物模型的方法。
1 材料与方法
1.1 实验材料
清洁级SD雄性大鼠24只,体质量290~310 g (北京华阜康生物科技股份有限公司);链脲佐菌素(Sigma公司);BL-420F生物机能实验系统(成都泰盟科技股份有限公司);DM-3000生物显微镜(Leica公司);EM UC7超薄切片机(Leica公司);JEM-1400透射电子显微镜(日本电子株式会社)。
1.2 动物模型制备
1.2.1 糖尿病模型制备适应性饲养1周后,从24只SD雄性大鼠中随机选择6只大鼠作为正常对照组,其余18只大鼠禁食不禁水12 h,次日使用,pH=4.2的柠檬酸盐缓冲液配制浓度为2%的链脲菌素(STZ)溶液,按60 mg/kg剂量一次性腹腔注射,72 h后使用罗氏血糖仪测量大鼠尾尖血糖,以血糖持续大于16.7 mmol/L作为糖尿病大鼠成模标准。3只大鼠血糖值不达标予以剔除,成功造模15只。
1.2.2 缺血再灌注模型制备糖尿病大鼠饲养1个月后,从中选择6只作为糖尿病对照组,剩余9只糖尿病大鼠作为缺血再灌注组,使用3%戊巴比妥钠按60 mg/kg剂量腹腔注射麻醉大鼠,仰卧位固定,消毒备皮后,沿腹壁正中线切开长约3 cm切口,钝性剥离腹主动脉和右侧髂总动脉,使用动脉夹分别于髂腰动脉水平下0.5 cm夹闭腹主动脉,于髂总动脉分叉处下1 cm夹闭右侧髂总动脉,盐水纱布保护切口,60 W小台灯照射保温。另沿右侧腹股沟韧带剪开长约2 cm切口,钝性剥离股动脉,使用动脉夹于腹股沟水平处夹闭股动脉,计时3 h后打开动脉夹恢复血供,逐层缝合肌肉和皮肤。手术过程中2只大鼠死亡,7只造模成功。
1.3 实验指标检测
1.3.1 电生理测定手术7 d后,全部大鼠使用3%的戊巴比妥钠麻醉,俯卧位固定,沿坐骨神经走向纵向切开大鼠右下肢皮肤、肌肉,钝性剥离坐骨神经,37℃液态石蜡油保湿,使用厂家提供的电极钩(共7个电极钩,等间距固定,7个电极钩从前到后依次与BL-420仪器中刺激电极正极、刺激电极负极、参考电极、第一记录电极负极、第一记录电极正极、第二记录电极负极、第二记录电极正极相连)钩住坐骨神经。打开电脑软件,选择神经干兴奋传导速度测定,使用系统默认参数(刺激波为方波、刺激强度1 v),输入2个记录电极之间的距离0.8 cm后,测量坐骨神经传导速度和动作电位波幅。
1.3.2 形态学观察电生理检测后,截取一段坐骨神经放入3%的戊二醛中固定1周,然后放入1%的四氧化锇中固定1.5 h,经50%~100%酒精逐级脱水、环氧树脂和丙酮混合液中浸透、环氧树脂812+815包埋后,超薄切片机制作半薄切片(1~3 um)和超薄切片(50~70 nm)。半薄切片使用甲苯胺蓝染色,光镜下观察坐骨神经形态,使用Leica Qwin Plus图像采集系统采集图片,采用Adobe Photoshop Cs4图像分析软件进行形态学测量分析;超薄切片使用铀-铅染色,透射电镜下观察坐骨神经的超微结构。
1.4 统计学方法
采用SPSS 16.0统计软件进行统计分析,实验结果采用均数±标准差(±s)表示。首先检验各组数据的正态性和方差齐性,结果显示各组数据均满足正态性,其中2组数据不满足方差齐性。使用单因素方差分析进行组间比较,对于满足方差齐性的数据两两比较采用LSD检验,对于不满足方差齐性的数据两两比较采用Dunnett’s T3检验,显著性水平设定为α=0.05。
2 测量结果
2.1 电生理测定
表1显示,糖尿病缺血再灌注大鼠坐骨传导速度、坐骨神经动作电位波幅与糖尿病大鼠和正常大鼠比较均明显下降(P<0.01);糖尿病大鼠坐骨神经传导速度、坐骨神经动作电位波幅与正常大鼠比较下降(P<0.01)。
表1 各组大鼠坐骨神经传导速度和动作电位波幅(±s)

表1 各组大鼠坐骨神经传导速度和动作电位波幅(±s)
注:与正常组比较:**P<0.01,与糖尿病组比较:##P<0.01
组别鼠数(n)神经传导速度(m/s)动作电位波幅(mv) 648.97±6.3711.59±1.63糖尿病组639.17±4.77**9.31±0.90**缺血再灌注组726.53±3.85**##6.86±0.75**##正常组
2.2 坐骨神经形态学观察
表2图1显示,光镜下观察并与正常大鼠比较,糖尿病缺血再灌注大鼠坐骨神经有髓神经纤维密度明显下降(P<0.01),异常有髓神经纤维密度、异常有髓神经纤维所占比率、有髓神经纤维髓鞘平均横截面积均明显上升(P<0.01)。与糖尿病大鼠比较,糖尿病缺血再灌注大鼠坐骨神经有髓神经纤维密度下降(P<0.05),有髓神经纤维髓鞘平均横截面积上升(P<0.01)。
表2 各组大鼠坐骨神经形态学测量分析(±s)
表2 各组大鼠坐骨神经形态学测量分析(±s)
注:与正常组比较:*P<0.05,**P<0.01,与糖尿病组比较:#P<0.05,##P<0.01。
组别鼠数(n)有髓神经纤维密度(条/mm2)异常有髓神经纤维密度(条/mm2)异常有髓神经纤维所占比率(%)有髓神经纤维髓鞘平均横截面积(um2)正常组611881.9±892.6375.0±166.73.1±1.426.6±2.4糖尿病组610020.8±1156.4**916.7±225.2**9.5±3.4*32.6±3.2**缺血再灌注组78601.2±1143.0**#1261.9±461.3**14.5±4.7**39.9±4.5**##
图2显示,电镜下观察并与正常大鼠和糖尿病大鼠比较,糖尿病缺血再灌注大鼠神经纤维密度明显下降,分布不均匀,神经内膜明显水肿,髓鞘增厚、迂曲、裂解、脱落,且呈波浪状或气泡状,轴索萎缩,无髓神经明显减少。
3 讨论
糖尿病周围神经病变属于糖尿病慢性并发症,糖尿病患者在血糖控制不佳的情况下,往往需要5~10年左右才能够形成明显的周围神经病变。目前广泛使用链脲佐菌素诱导的糖尿病动物作为DPN研究的主要动物模型,其缺点是周围神经损伤程度较轻。由于实验周期的限制,多数药理实验在DPN尚未完全形成时即开始给药,实验结果只能反映药物的预防性治疗作用。国外研究发现[4-5],缺血可以引起糖尿病大鼠周围神经病变,缺血再灌注能够进一步加重神经细胞轴索变性并导致雪旺细胞凋亡。在骨外科,缺血再灌注损伤是常见的临床问题[6],由于DPN患者常常合并周围血管病变等多种并发症,缺血再灌注对DPN患者周围神经的损伤会更严重,往往可以引起严重的周围神经病变。本实验通过暂时阻断糖尿病大鼠腹主动脉、髂总动脉和股动脉,造成大鼠坐骨神经缺血再灌注损伤,希望在短期内建立损伤程度较重的DPN动物模型。
目前大鼠下肢缺血再灌注模型建立主要采用止血带法和动脉结扎法。止血带法的优点是创伤小、易操作、无需手术,但由于捆绑力度不易控制,使得各实验组在缺血程度、造模成功等方面难以取得一致,且其只是对缺血再灌注损伤的简单复制,缺血再灌注损伤的发生缺乏客观性、真实性。动脉结扎法可以很好地避免上述缺点,但是需要手术,会增加动物的死亡率。由于大鼠下肢侧枝循环丰富,结扎一条血管不能造成坐骨神经明显缺血,而结扎全部血管,会明显增加手术难度和动物的死亡率。本实验在熟悉大鼠下肢解剖结构基础上参考多篇文献[5-11],最终选择腹主动脉、髂总动脉和股动脉3条血管,这些血管是营养坐骨神经的主要血管,且管径较粗,易分离结扎,可以明显降低手术难度和手术时间,提高手术成功率。实验结果表明,采用此方法可以在短期内造成糖尿病大鼠严重的周围神经病变,为DPN研究提供了一种新的动物模型。

图1 大鼠坐骨神经甲苯胺蓝染色(×400)
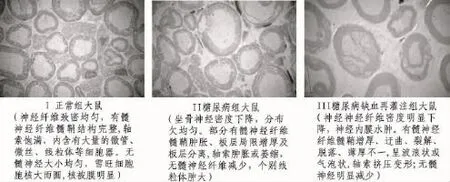
图2 大鼠坐骨神经超微结构(×5000)
[1]杨薇,吴江,孙世博,等.实验性糖尿病大鼠坐骨神经病理形态学的动态变化[J].中风与神经疾病杂志,2010,27 (4):304-307.
[2]孙世博,刘宗武.糖尿病大鼠周围神经传导速度变化与病程相关性研究[J].中国医药指南,2013,11(7):91-92.
[3]陈伟,陆勤,任荣亮,等.糖尿病大鼠周围神经形态、功能及电生理指标的动态变化[J].国际神经病学神经外科学杂志,2010,37(5):400-404.
[4]Wang Y,Schmelzer JD,Schmeichel A,Iida H,Low PA. Ischemia-reperfusion injury of peripheral nerve in experimental diabetic neuropathy[J].J Neurol Sci,2004,227(1):101-107.
[5]Nukada H,Lynch CD,McMorran PD.Aggravated reperfusion injury in STZ-diabetic nerve[J].J Peripher Nerv Syst,2002,7 (1):37-43.
[6]柯铁,陈文昌.MK-801对大鼠坐骨神经缺血再灌注损伤保护作用的实验研究[J].福建医药杂志,2012,34(01):64-67.
[7]Gholami MR,Abolhassani F,Pasbakhsh P,et al.The effects of simvastatin on ischemia-reperfusion injury of sciatic nerve in adult rats[J].Eur J Pharmacol,2008,590(1-3):111-114.
[8]Rahimian R,Fakhfouri G,Rasouli MR,et al.Effect of pioglitazone on sciatic nerve ischemia/reperfusion injury in rats[J].Pediatr Neurosurg,2009,45(2):126-131.
[9]Nouri M,Rahimian R,Fakhfouri G,et al.Ipsilateral common iliac artery plus femoral artery clamping for inducing sciatic nerve ischemia/reperfusion injury in rats:a reliable and simple method[J].J Brachial Plex Peripher Nerve Inj,2008,3:27.
[10]Alipour M,Gholami MR,Jafari AI,Sohrabi D,Tajki J,Pourheidar M.Intraperitoneal aminoguanidine improves sciatic nerve ischemia-reperfusion injury in male sprague-dawley rats[J].Cell Mol Neurobiol,2011,31(5):765-773.
[11]Rinker B,Fink BF,Stoker AR,Milan ME,Nelson PT.Calcium channel blockers reduce the effects of cigarette smoking on peripheral nerve ischemia/reperfusion injury[J].Ann Plast Surg,2013,70(2):222-226.
Effect of sciatic nerve with limb ischemia reperfusion in diabetic rats
HUANG Da,LI Ming-di,ZHENG Ya-lin,WANG Qiu-hong,LIN Lan△
(Guang’anmen Hospital,China Academy of Chinese Medical Sciences,Beijing 100053,China)
Objective:To investigate the effects of lower limb ischemia-reperfusion on sciatic nerve in diabetic rats. Methods:Twenty-four male SD rats were divided into two groups:normal control group(n=6)and diabetic group(n=18),and the model rats suffering from diabetes were induced by streptozotocin.After feeding for one month,choose part of the model rats suffering from diabetes(n=9)as the ischemia-reperfusion group,and keep their abdominal aorta,common iliac artery and femoral artery blocked for 3 hours.After 7-day perfusion,measure the sciatic nerve conduction velocity and action potential amplitude,and observe sciatic morphological changes by light microscopy,electron microscopy.Results: For the diabetic rats from ischemia-reperfusion group,their sciatic nerve conduction velocity and action potential amplitude decreased obviously,along with the endoneurial edema,nerve fiber density decreasing,the number of abnormal nerve fibers increasing,myelin swelling,axonal atrophy and other changes.Conclusion:Lower limb ischemia-reperfusion can cause serious injury to the sciatic nerve in diabetic rats,and this method can establish diabetic peripheral neuropathy animal model in a short term.
Diabetic peripheral neuropathy;Ischemia-reperfusion;Nerve conduction velocity;Morphology
R587.1
:B
:1006-3250(2015)05-0517-03
2015-01-14
国家自然科学基金资助项目-从ICAM-1介导的神经细胞凋亡探讨中药干预糖尿病周围神经病变机制(81173445)
黄达(1983-),男,河北唐山人,在读博士,从事糖尿病及其并发症的临床与实验研究。
△通讯作者:林兰(1938-),女,主任医师,博士研究生导师,中国中医科学院首席研究员,从事糖尿病、甲状腺等内分泌疾病的中西医结合临床与研究,E-mail:linlan05@163.com。
