超声波辅助复合酶法提取枸杞多糖工艺研究
2015-04-12王杉杉马韵升刘圣鹏虞凤慧
王杉杉,马韵升,姚 刚,刘圣鹏,虞凤慧,魏 征*
(1.黄河三角洲京博化工研究院有限公司,山东 滨州 256500;2.山东京博控股股份有限公司,山东 滨州 256500)
枸杞(Lycium barbarum)子为茄科植物枸杞的干燥成熟果实[1],能滋补肝肾、益精明目,用于腰膝酸痛、眩晕耳鸣[2]。枸杞的营养价值很高,关于其营养成分的报道[2-3]也很多,枸杞多糖(Lycium barbarumpolysaccharide,LBP)是枸杞中的主要活性成分之一,是一种水溶性蛋白多糖,已经被研究证实具有提高免疫力、抗癌、抗肿瘤、抗氧化、抗衰老、降血脂、抗脂肪肝等功效[4-8],具有很好的发展前景。
目前,枸杞多糖的提取主要采用热水浸提法,该方法比较简单,易于操作,但提取效率低,且较高的温度容易破坏多糖结构,降低其生物活性[9]。酶法可以分解植物细胞壁及细胞膜的成分,从而促进胞内有效成分的溶出[10-12];超声辅助浸提则可利用超声波的空化效应及机械剪切作用来破坏细胞壁结构,同时强化传质,以达到提高有效成分收率的目的[13-14]。这两种方法因其提取条件温和、提取效率高、提取时间短及绿色环保等优势受到越来越多的关注。如果将二者结合,一方面可利用超声增强复合酶的活性,提高其破壁效率;另一方面可通过超声强化传质过程,促进多糖溶解,有效缩短浸提时间,提高多糖得率[15-18]。
本试验采用超声波辅助复合酶法对枸杞多糖提取工艺进行研究,在单因素试验的基础上,采用正交设计对枸杞多糖的料液比、提取温度、超声时间、复合酶添加量进行优化,旨在获得一个得率高、品质好的枸杞多糖提取条件,从而为枸杞多糖的工业生产、开发应用提供科学的理论依据。
1 材料与方法
1.1 材料与试剂
枸杞:宁夏;脂肪酶(200000U/g)、果胶酶(200000U/g):苏柯汉潍坊生物工程有限公司;蛋白酶(200 000 U/g):南宁庞博生物工程有限公司;纤维素酶(20 000 U/g):实验室自制(毕赤酵母工程菌发酵);无水乙醇、葡萄糖、苯酚、硫酸(分析纯):莱阳经济技术开发区精细化工厂。
1.2 仪器与设备
DL-6M大型低速离心机:长沙湘仪离心机科技有限公司;752N-紫外可见分光光度计:上海精密科学仪器有限公司;RE-2000B旋转蒸发仪:上海亚荣生化仪器厂;FD-1A-50型冷冻干燥机:北京博医康有限公司;KQ-250B超声波清洗器:昆山市超声仪器有限公司;HH-1型数显恒温水浴锅:江苏省金坛市融化仪器制造有限公司;JJ-1精密增力电动搅拌器:上海浦东物理光学仪器销售部。
1.3 实验方法
1.3.1 枸杞多糖提取工艺流程
枸杞粉末→乙醇脱脂→超声波辅助复合酶浸提→沸水浴灭酶→离心→Sevage法除蛋白→浓缩→冷冻干燥→枸杞多糖粗品
1.3.2 枸杞多糖提取操作要点
缓冲溶液的配制:分别配制0.1 mol/L的柠檬酸及柠檬酸钠溶液,并按比例配成pH 4.6的缓冲溶液。
复合酶液配制:称取等质量的脂肪酶、蛋白酶、纤维素酶和果胶酶,加入10倍体积的缓冲溶液,40 ℃水浴活化20 min。
将枸杞置于阴凉处,自然晾干,将其粉碎。精确称取粉碎的枸杞粉末30 g,加入10倍体积分数80%的乙醇,于80 ℃水浴脱脂1 h,冷却、离心、收集滤饼备用。按照不同的料液比、提取温度、提取时间、复合酶(脂肪酶/蛋白酶/纤维素酶/果胶酶1∶1∶1∶1)添加量设计试验,在180 W超声功率条件下进行超声波辅助复合酶提取,沸水浴灭酶10 min,在4 000 r/min条件下离心10 min,过滤,Sevage法除蛋白,上清液进行减压浓缩至原体积的1/5,冷冻干燥得到枸杞多糖粗品。
1.3.3 葡萄糖标准曲线的绘制
葡萄糖标准溶液的配制:准确称取在105 ℃干燥至质量恒定的葡萄糖标准品0.100 0 g,置于50 mL烧杯中加蒸馏水溶解,并全部转移至100 mL容量瓶中,稀释至刻度,另取10 mL该溶液于100 mL容量瓶中,稀释至刻度,配成质量浓度0.1 mg/mL的葡萄糖标准溶液。
葡萄糖标准曲线的绘制:精密吸取0.1 mg/mL的葡萄糖标准使用液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL,分别置于25 mL比色管中,准确补充水至2.0 mL,加入5%苯酚溶液1.0 mL,在旋转混匀器上混匀,小心加入浓硫酸5.0 mL,在旋转均匀器上小心混匀,冷却后,用分光光度计在波长490 nm处,以试剂空白溶液为参比,1 cm比色皿测吸光度值,制得标准曲线。
1.3.4 样品多糖含量测定
取干燥枸杞多糖供试品,按实际实验结果,将其稀释至合适倍数,精确吸取待测液2 mL置于25 mL比色管,按照方法1.3.3显色,用分光光度计在波长490 nm处测定吸光度值。从标准曲线回归方程计算葡萄糖的质量,计算样品中多糖含量。多糖含量的计算公式如下:

式中:C为供试液中葡萄糖的质量浓度,μg/mL;D为样品液的稀释因素:F为换算因子;m为样品的质量,g。
1.3.5 多糖得率的计算
枸杞多糖的得率计算公式如下:
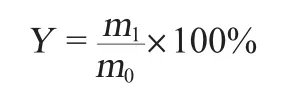
式中:Y为枸杞多糖得率,%;m1为枸杞多糖质量,g;m0为粗多糖质量,g。
1.3.6 单因素试验设计
料液比的确定:分别设定料液比为1∶10、1∶20、1∶30、1∶40、1∶50(g∶mL),在超声功率180 W,提取温度为55 ℃,复合酶添加量0.2%条件下提取40 min,考察不同料液比对多糖得率的影响。
提取温度的确定:分别设定提取温度为35 ℃、45 ℃、55 ℃、65 ℃、75 ℃,在超声功率180 W,料液比为1∶40(g∶mL),复合酶添加量0.2%条件下提取40 min,考察不同提取温度对多糖得率的影响。
超声时间的确定:分别设定提取时间为30 min、40 min、50 min、60 min、70 min,在超声功率180 W,料液比为1∶40(g∶mL),提取温度为55 ℃,复合酶添加量0.2%条件下提取,考察不同超声时间对多糖得率的影响。
复合酶添加量:分别设定复合酶(脂肪酶/蛋白酶/纤维素酶/果胶酶1∶1∶1∶1)添加量为0.2%、0.4%、0.6%、0.8%、1.0%,在超声功率180 W,料液比为1∶40(g∶mL),提取温度为55 ℃条件下提取50 min,考察不同复合酶添加量对多糖得率的影响。
1.3.7 正交试验设计
根据单因素试验结果,选取料液比(A)、超声时间(B)、提取温度(C)和复合酶添加量(D)4个因素,进行L9(34)正交试验,以枸杞多糖得率为评价指标,最终确定枸杞多糖提取的最优工艺条件。正交试验设计因素与水平见表1。

表1 枸杞多糖提取条件优化正交试验因素与水平Table 1 Factors and levels of orthogonal experiments for polysaccharide from Lycium barbarum extraction conditions optimization
2 结果与分析
2.1 葡萄糖标准曲线
采用硫酸-苯酚法测定不同质量的葡萄糖在波长490 nm处的吸光度值,以葡萄糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制出葡萄糖标准曲线,结果如图1所示。
由图1可知,在葡萄糖含量0~0.12 mg范围内,标准曲线线性回归方程为y=8.002 1x-0.015 5,拟合系数R2=0.998 1,表明葡萄糖含量与吸光度值呈良好的线性关系。

图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
2.2 各单因素对枸杞多糖提取效果的影响
2.2.1 料液比对提取效果的影响
不同料液比条件下的枸杞多糖得率结果如图2所示。

图2 料液比对枸杞多糖得率的影响Fig.2 Effect of solid liquid ratio on the yield of polysaccharide from Lycium barbarum
从图2可以看出,当料液比<1∶40(g∶mL)时,枸杞多糖得率随着料液比的升高而升高,可能是当料液比较低时,溶液黏稠度较大,超声波处理时,不易形成空化现象;当料液比为1∶40(g∶mL)时,枸杞多糖得率达到31.132%;之后随着料液比的升高反而会使枸杞多糖得率降低,可能是随着溶剂用量的增大,溶液中底物与酶的质量浓度也随之下降,有效反应碰撞减少。因此,选择料液比1∶40(g∶mL)最佳。
2.2.2 提取温度对提取效果的影响
不同提取温度条件下的枸杞多糖得率结果如图3所示。
从图3可以看出,枸杞多糖得率随着温度的升高而升高;当温度为55 ℃时,枸杞多糖得率达到42.621%;之后随着温度继续升高,枸杞多糖得率显著降低。温度影响酶的活性,适当的升高温度可以提高酶的活性,提高枸杞多糖得率,但当温度过高时,酶结构发生变化,活性急速下降,而使枸杞多糖得率降低。因此,选择提取温度为55 ℃最佳。

图3 温度对枸杞多糖得率的影响Fig.3 Effect of temperature on the yield of polysaccharide from Lycium barbarum
2.2.3 超声时间对提取效果的影响
不同超声时间条件下的枸杞多糖得率结果如图4所示。
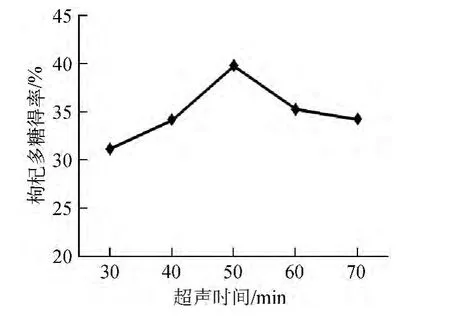
图4 超声时间对枸杞多糖得率的影响Fig.4 Effect of ultrasonic treatment time on the yield of polysaccharide from Lycium barbarum
从图4可以看出,超声时间<50 min时,枸杞多糖随着超声时间的延长而增大;超声时间为50 min时,枸杞多糖得率39.742%;当>50 min时,枸杞多糖得率反而下降,可能因为超声时间较长,超声波提供的能量过高,此条件下多糖结构遭到破坏,得率降低。因此,选择超声时间为50 min。
2.2.4 复合酶添加量对提取效果的影响
不同复合酶添加量条件下的枸杞多糖得率结果如图5所示。
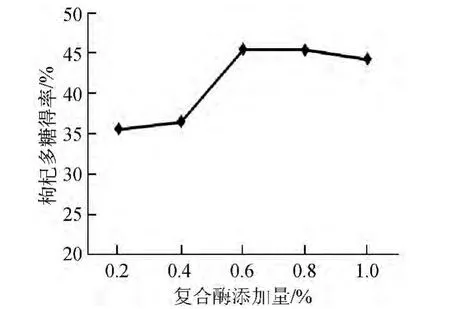
图5 复合酶添加量对枸杞多糖得率的影响Fig.5 Effect of compound enzymes addition on the yield of polysaccharide from Lycium barbarum
由图5可以看出,枸杞多糖得率随着酶添加量的增加而增大;当酶添加量为0.6%时,枸杞多糖得率达到45.362%;当酶添加量>0.6%时,随着酶添加量的增大而变得缓慢,可能因为此时酶用量在底物质量浓度一定时达到饱和。因此,选择复合酶添加量为0.6%。
2.3 提取枸杞多糖的最佳工艺确定
在单因素试验的基础上,以多糖得率为评价指标,对料液比、浸提时间、提取温度、复合酶添加量进行L9(34)正交试验,试验结果与分析见表2,方差分析见表3。
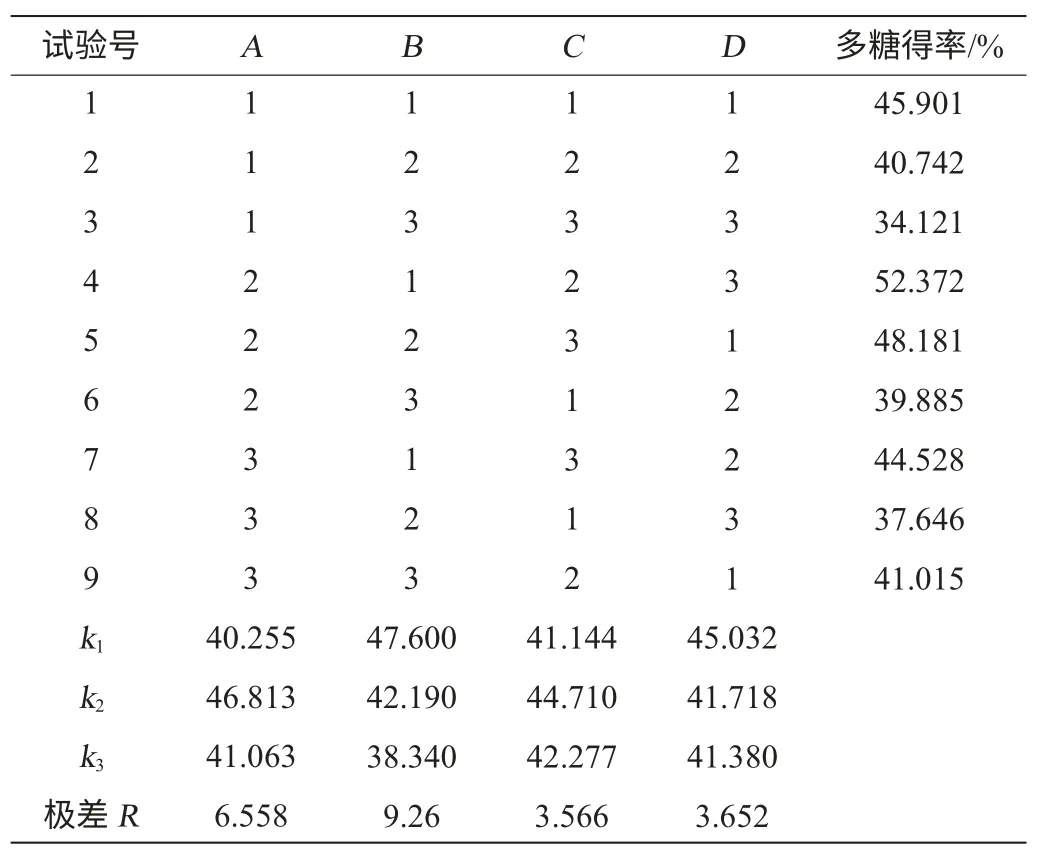
表2 枸杞多糖提取条件优化正交试验结果与分析Table 2 Results and analysis of orthogonal experiments for polysaccharide from Lycium barbarum extraction conditions optimization
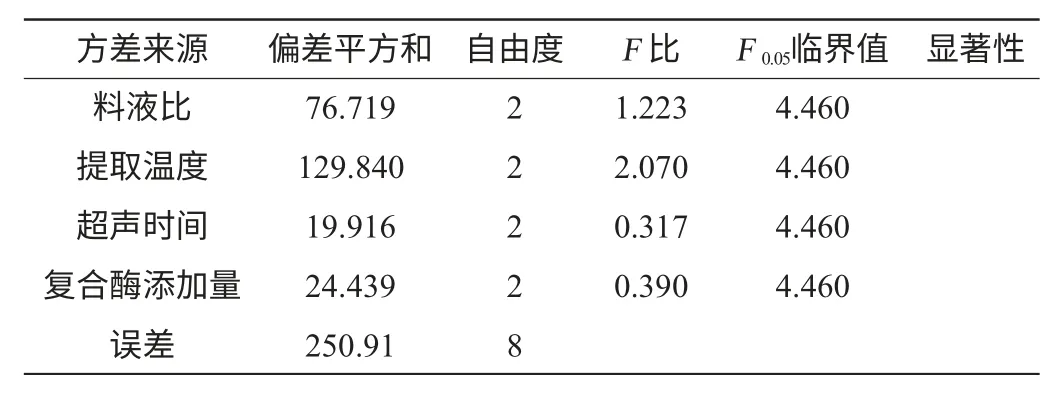
表3 正交实验结果方差分析Table 3 Variance analysis of orthogonal experiments results
由表2可知,各因素影响枸杞多糖得率得主次关系顺序为提取温度(B)>料液比(A)>复合酶添加量(D)>超声时间(C)。最佳工艺条件为A2B1C2D1,即料液比为1∶40(g∶mL),提取温度50 ℃,超声时间50 min,复合酶添加量0.5%。并在此最优提取条件下进行验证试验,枸杞多糖得率达到58.910%,高于正交试验表中最大多糖得率52.372%,故可以认为该组合为超声波辅助热水浸提法提取枸杞多糖的最佳提取工艺。由表3可知,各因素对结果影响均不显著。
3 结论
单因素试验结果表明,宁夏枸杞多糖的提取受料液比,提取温度,超声时间,复合酶添加量4个因素影响较大,且各因素水平数据之间存在一定的梯度差。正交试验结果表明,枸杞多糖最佳提取工艺条件为料液比1∶40(g∶mL),浸提温度50 ℃,超声时间50 min,复合酶添加量0.5%。在此最佳条件下,枸杞多糖平均得率为58.910%。
利用超声辅助复合酶法提取枸杞多糖具有节约时间、能耗低、提取效率高等优点,可为大规模工业化生产枸杞多糖提供理论依据。
[1]张惠玲.枸杞的营养与功效[J].农业科学研究,2011,32(3):59-62.
[2]陈吉生,吕剑豪.枸杞多糖提取工艺研究[J].医药导报,2010,29(5):649-652.
[3]王金童,王秀娟.枸杞子的化学成分和药理研究概况[J].天津药学,1999,11(3):14-16.
[4]孙桂菊,左平国.枸杞多糖功效研究及应用进展[J].东南大学学报:医学版,2010,29(2):209-215.
[5]翁艳英,张贞发.枸杞多糖提取工艺优化方法的研究进展[J].科技信息,2012,39(11):19.
[6]张静丽,王宏勋,张 雯,等.灵芝、枸杞多糖复合抗氧化作用[J].食品与机械,2004,20(6):11-13.
[7]魏永祥,商希礼.枸杞多糖的研究进展[J].安徽农业科学,2010,38(11):5834-5836.
[8]张慧玲.枸杞的功效和综合利用[M].银川:宁夏人民出版社,2007.
[9]王华芳,吉仙枝.枸杞子多糖提取工艺研究进展[J].安徽农学通报,2014,20(8):166-168.
[10]刘 杰,杜方岭,王文亮,等.纤维素酶法提取花生粕中多糖的研究[J].中国酿造,2011,30(11):30-33.
[11]梁 敏,邹东恢,郭建华.酶法提取枸杞多糖工艺研究[J].食品工程,2010(3):104-106.
[12]YOU Q H,YIN X L,ZHAO Y P,et al.Enzyme assisted extraction of polysaccharidesfrom the fruit ofCornusofficinalis[J].Carbohyd Polym,2013,98(1):607-610.
[13]李文谦,茅燕勇.响应面法超声波提取枸杞多糖工艺优化[J].中国酿造,2011,30(10):122-126.
[14]杨秀芳,伍发云,陈 梅.超声波法提取花菇多糖的研究[J].中国酿造,2009,28(11):72-74.
[15]ZHANG Q A,ZHANG Z Q,YUE X F,et al.Response surface optimization of ultrasound-assisted oil extraction from autoclaved almond powder[J].Food Chem,2009,116(17):513-518.
[16]戴少庆,李高阳,唐汉军,等.超声波辅助复合酶提取椪柑皮果胶的工艺优化[J].食品工业科技,2014,35(11):193-197.
[17]范三红,李 静,王亚云,等.超声波辅助复合酶提取菊糖工艺优化[J].食品科学,2015,36(4):23-28.
[18]HUANG W,XUE A,NIU H,et al.Optimised ultrasonic-assisted extraction of flavonoids fromFolium eucommiaeand evaluation of antioxidant activityin multi-text systemsin vitro[J].Food Chem,2009,114(10):1147-1154.
