灵芝多糖的超声辅助碱提工艺优化
2015-04-12罗丽兰张秀清
王 锋,罗丽兰,张秀清*
(中国农业大学 食品科学与营养工程学院,北京 100083)
灵芝(Ganoderma lucidum)是食药两用真菌,在中国被称为“仙草”,大量的药理学研究与临床实践进一步证实灵芝的具有重要的药理作用。灵芝多糖作为灵芝的主要成分之一,研究表明其具有抗肿瘤[1-4]、免疫调节[5-7]、抗氧化抗衰老[8-10]及降血糖血脂[11]等生物活性。
灵芝多糖有多种提取方式,包括水提醇沉法、碱提法、酶法、超声及微波辅助提取法等[12-15]。传统的方法是用热水浸提法,该方法虽然操作简单,但是多糖的提取效率和生产效率都比较低;另一种应用较多的灵芝多糖提取方法是碱提法,许多研究结果表明,碱提法与水提法比较,能够极大的提高灵芝多糖得率[16]。超声提取法作为一种辅助手段经常被应用到溶剂提取法中增加提取效果,大量的实验结果表明,若在提取过程中加入超声进行辅助,可以极大的提高灵芝多糖的产率[17-18]。
本实验的目的是得到一种能够显著提高灵芝多糖提取率的提取方法,对超声辅助碱提灵芝多糖的工艺进行了优化,并将该工艺应用到灵芝子实体多糖的提取中,与传统水提法结果进行比较,以确定该方法的高效性。
1 材料与方法
1.1 材料与试剂
灵芝菌种:采自四川、安徽、东北、浙江四个地区;无水乙醇、苯酚、浓硫酸等(分析纯):北京化工厂。
1.2 仪器与设备
KQ3200DE 数控超声波清洗器:昆山市超声仪器有限公司;TU-1901 双光束紫外可见分光光度计:北京普析通用仪器厂;TG 16-WS台式高速离心机:长沙湘仪离心机有限公司;PB-10酸度计:德国Sartourius公司。
1.3 方法
1.3.1 灵芝多糖超声辅助碱提工艺优化
(1)灵芝多糖超声辅助碱提工艺流程
灵芝菌丝体→粉碎→过60目筛→加入5%的NaOH溶液→超声提取→热水浴浸提→离心分离(4 000 r/min、15 min)→取上清液,调节pH值至7左右(6.8~7.2)→加入4倍体积无水乙醇→4 ℃中保存过夜→离心(4 000 r/min、15 min)→弃去上清液→沉淀挥发干燥→复溶于水→定容→多糖提取液
(2)葡萄糖标准曲线的绘制及样品多糖含量的测定
采用苯酚硫酸法进行测定[19],标曲绘制方法:准确称取105 ℃干燥至质量恒定的葡萄糖1.000 g,用蒸馏水定容至100 mL,取出1 mL该溶液定容至100 mL,配成0.1 mg/mL的葡萄糖标准溶液。准确吸取标准溶液0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL,分别置于比色管中,各加蒸馏水使体积为2.0 mL。再各加入6%的苯酚1.0 mL,摇匀,迅速加入浓硫酸5.0 mL。静置10 min后,摇匀,待反应液完全冷却后,于波长490 nm条件下测定其吸光度值,以蒸馏水作为空白。
准确吸取灵芝多糖提取液1 mL,按照标准曲线绘制的方法操作。以空白试剂作参比,在波长490 nm处测定吸光度值,按照标准曲线回归方程计算样品中多糖含量。多糖含量按如下公式计算:

式中:w为多糖含量,mg/g;m1为从标准曲线上查到的样品测定液的葡萄糖含量,mg;V1为样品定容体积,mL;m2为样品的质量,g;V2为比色时所移取样品测定液的体积,mL。
(3)灵芝多糖超声辅助碱提工艺的单因素试验
对碱提灵芝多糖过程中料液比、超声时间、超声功率、水浴热提温度、水浴热提时间5个因素进行单因素设计。料液比选择1∶10、1∶20、1∶30、1∶40、1∶50、1∶60(g∶mL);超声功率选择60 W、75 W、90 W、105 W、120 W、135 W、150 W;超声时间选择10 min、20 min、30 min、40 min、50 min、60 min、70 min;水浴热提取温度选择40 ℃、50 ℃、60 ℃、70 ℃、80 ℃、90 ℃、100 ℃;水浴热提时间选择40 min、50 min、60 min、70 min、80 min、90 min。分别考察料液比、超声时间、超声功率、水浴热提温度、水浴热提时间对多糖含量的影响。
(4)灵芝多糖超声辅助碱提工艺的正交优化试验
在单因素试验的基础上,对料液比、超声功率、超声时间、水浴提取温度和水浴提取时间这5个因素分别选择4个水平,进行正交试验,因素与水平见表1。

表1 多糖提取工艺优化正交试验因素与水平Table 1 Factors and levels of orthogonal tests for polysaccharides extraction technology optimization
1.3.2 灵芝多糖传统热水提取工艺
参照文献[20]的方法,对其稍作修改:称取0.5 g粉碎后过60目筛的样品粉末置于50 mL具塞离心管内,用5 mL水浸润样品,缓慢加入20 mL无水乙醇,混匀后将样品置于超声提取器中(90 W)提取30 min后,4 000 r/min离心10 min,弃去上清,不溶物用10 mL体积分数为80%的乙醇洗涤离心,用水将上述不溶物转移至圆底烧瓶,加入50 mL 蒸馏水,装上磨口的空气冷凝管,于沸水浴中提取2 h后冷却至室温,过滤,将上清移至100 mL容量瓶中,洗涤残渣2~3次,用蒸馏水水定容。
1.3.3 灵芝多糖超声辅助碱提优化工艺的应用
对四川、安徽、东北和浙江4个产地的灵芝子实体多糖分别利用1.3.1中得到的优化工艺和1.3.2的传统水提方法进行提取,比较两种工艺对灵芝子实体多糖提取率的差异。
2 结果与分析
2.1 葡萄糖标准曲线的建立
以多糖含量(x)为横坐标,吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,结果如图1所示。
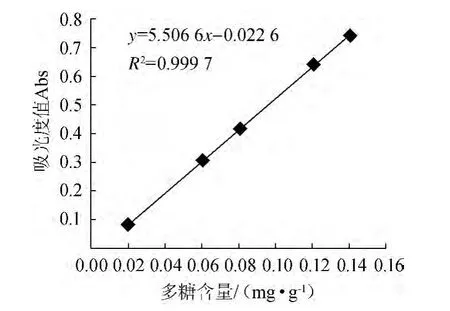
图1 葡萄糖标准曲线Fig.1 Standard curve of glucose
由图1可知,葡萄糖标准曲线方程为y=5.506 6x-0.022 6,相关系数R2为0.999 7,表明二者线性关系良好。
2.2 料液比对多糖提取的影响

图2 料液比对多糖含量的影响Fig.2 Effect of solid-liquid ratio on polysaccharides content
由图2可知,不同的料液比对灵芝多糖的含量之间存在显著性差异。多糖提取率随料液比的增加而上升,料液比为1∶50(g∶mL)时多糖含量达到最高,为67.5 mg/g,之后多糖的提取率趋于稳定。由此可得出料液比为1∶50(g∶mL)时,多糖含量最高。
2.3 超声功率对多糖提取的影响
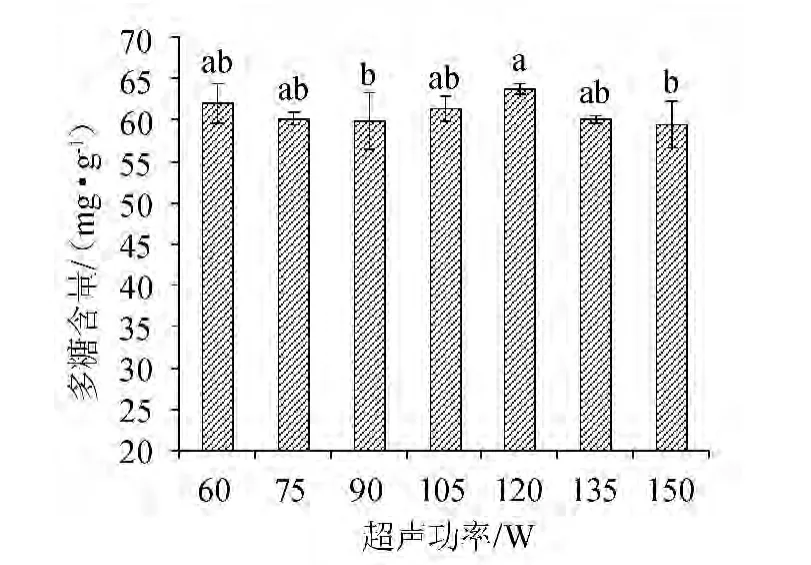
图3 超声功率对多糖含量的影响Fig.3 Effect of ultrasonic power on polysaccharides content
由图3可知,碱提取灵芝菌丝体多糖含量随着超声功率的上升呈现波浪形的趋势,不同的超声功率所得到的多糖含量差异不显著。在超声功率为120 W时,多糖含量最大,为64.0 mg/g。由此可得,超声功率120 W时对灵芝多糖的提取效果最佳。
2.4 超声时间对多糖提取的影响
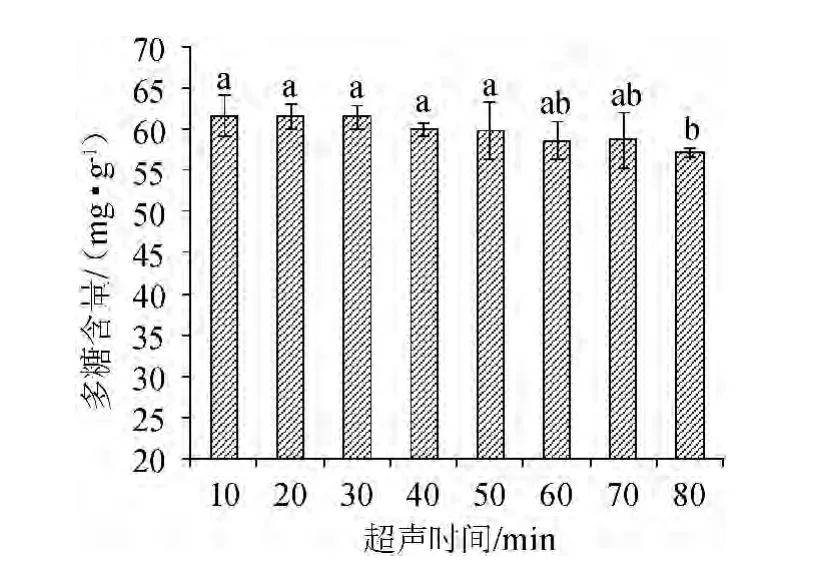
图4 超声时间对多糖含量的影响Fig.4 Effect of ultrasonic time on polysaccharides content
由图4可知,超声时间对碱提取灵芝菌丝体多糖的影响不明显,提取时间为20 min时,多糖含量最大,为61.7 mg/g。随着超声时间的延长,灵芝菌丝体多糖含量有所下降。由此可得,超声时间20 min对灵芝多糖的提取效果最佳。
2.5 水浴热提取温度对多糖提取的影响
由图5可知,灵芝菌丝体多糖提取量随水浴温度的上升而上升,水浴提取温度对灵芝菌丝体多糖的影响程度较大。提取温度为100 ℃时多糖提取量达到最大值63.5 mg/g。因此,从经济角度考虑,可以选择80 ℃提取灵芝菌丝体多糖。
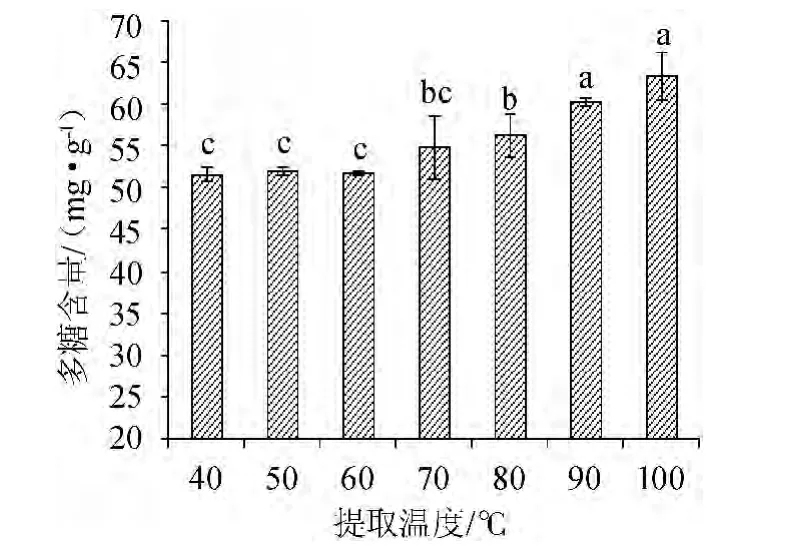
图5 提取温度对多糖含量的影响Fig.5 Effect of extraction temperature on polysaccharides content
2.6 水浴热提取时间对多糖提取的影响

图6 提取时间对多糖含量的影响Fig.6 Effect of extraction time on polysaccharides content
由图6可知,热提取时间对碱提灵芝菌丝体多糖的影响较大,随着提取时间的增加,灵芝菌丝体多糖的提取量上升。在水浴提取80 min时达到最大值,菌丝体多糖的提取量为60.5 mg/g,之后有所下降。由此可得,选择水浴提取80 min提取灵芝菌丝体多糖为宜。
2.7 灵芝多糖超声辅助碱提工艺正交优化试验
根据单因素试验结果,各因素分别选择4个水平进行正交试验。结果与分析见表2,方差分析结果见表3。
由表2可知,对灵芝菌丝体多糖提取的影响因素主次顺序为E>D>C>B>A,即热提温度>热提时间>超声时间>超声功率>料液比,最优灵芝菌丝体提取灵芝多糖的组合是A2B3C1D3E4,即料液比为1∶40(g∶mL),超声功率105 W,超声时间20 min,水浴温度100 ℃,水浴提取时间80 min。在此最佳工艺条件下,多糖含量为67.8 mg/g。
由表3可知,影响超声辅助碱提取灵芝多糖含量的5个因素中,热提取时间和热提取温度影响极显著,超声时间和超声功率影响显著,料液比对其影响不显著。
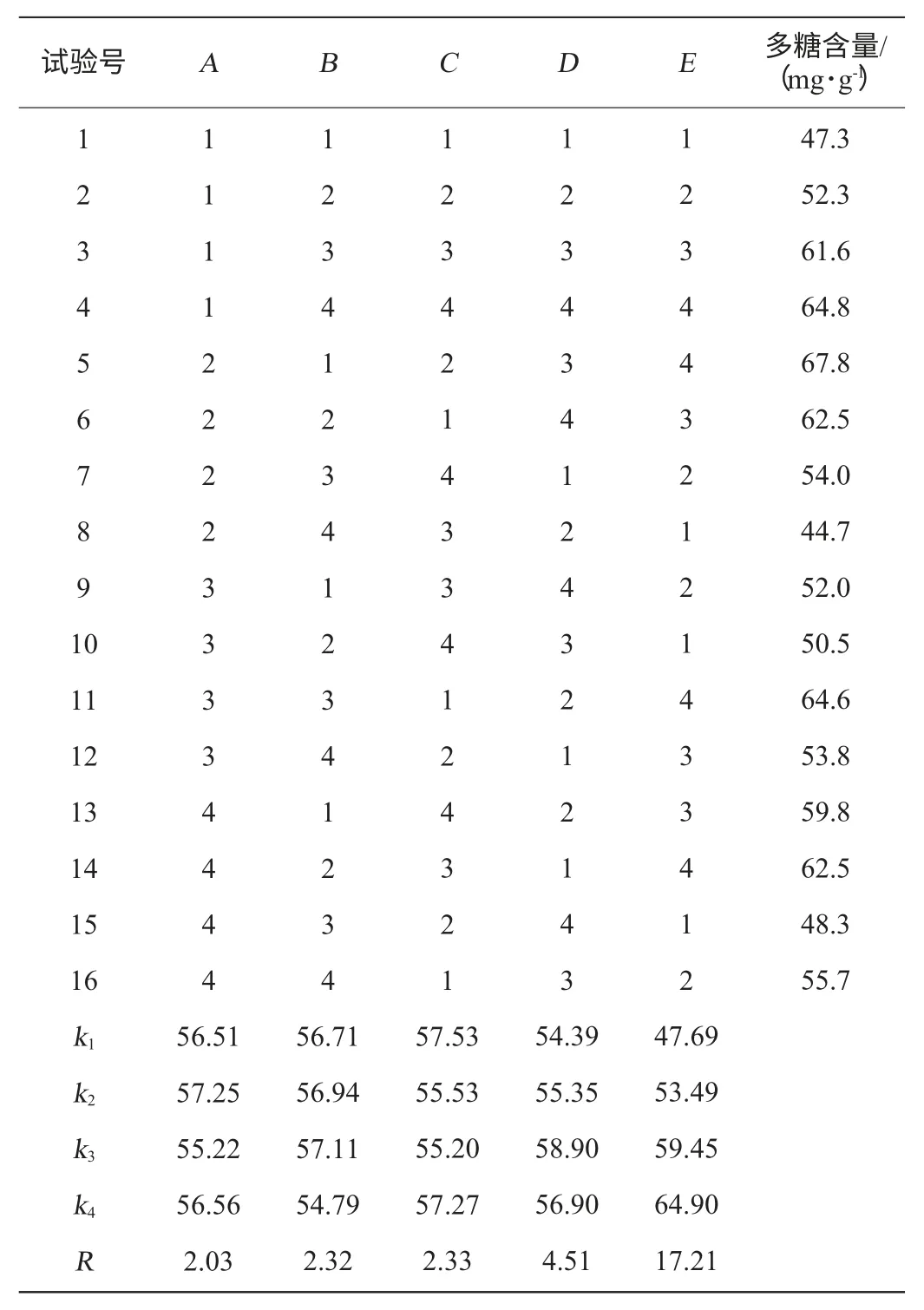
表2 多糖提取工艺优化正交试验结果与分析Table 2 Results and analysis of orthogonal tests for polysaccharides extraction technology optimization
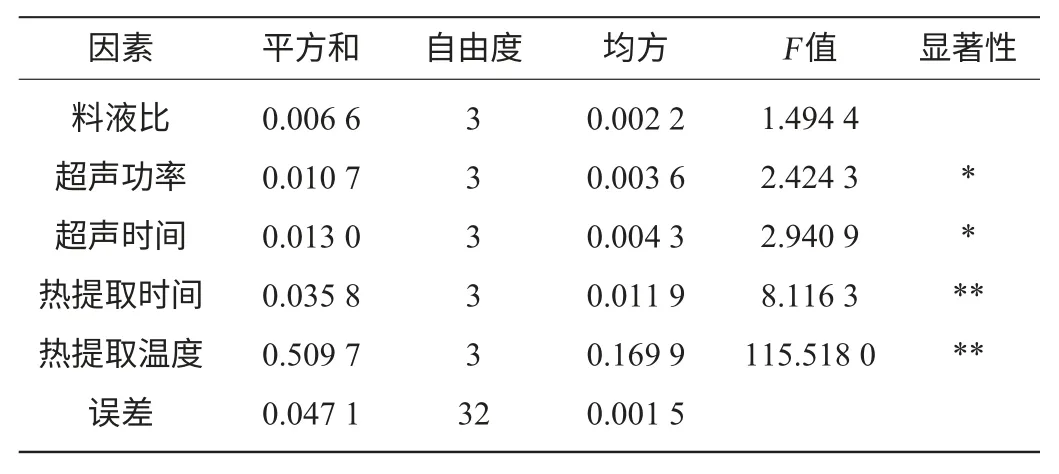
表3 正交试验结果方差分析Table 3 Variance analysis of orthogonal tests results
2.8 灵芝多糖超声辅助碱提优化工艺的应用
由图7可知,对于4个产地的灵芝子实体的多糖,采用优化得到的灵芝多糖超声辅助碱提工艺进行提取,其多糖含量均>60 mg/g,最高达90 mg/g以上;而采用传统的热水提取法,4个产地的样品中多糖含量均在30~40 mg/g之间。因此,实验得到的超声辅助碱提工艺能显著提高多糖含量。

图7 不同产地灵芝碱提与水提多糖含量对比Fig.7 Comparison of polysaccharides contents of Ganoderma lucidum from different regions by alkaline extraction and water extraction
3 结论
灵芝多糖作为一种具有多种生理活性的物质,研究提高其提取率的方法具有重要的价值。本研究通过单因素试验和正交试验,对超声辅助碱提取灵芝多糖的工艺进行了优化,得到最佳的提取工艺为料液比为1∶40(g∶mL),超声功率105 W,超声时间20 min,水浴提取温度100 ℃,水浴提取时间80 min,该工艺得到的多糖含量达到了67.8 mg/g。并确定水浴提取时间和水浴提取温度为极显著性因素,超声时间和超声功率为显著性因素,料液比为不显著因素。随后将该工艺应用到灵芝子实体多糖的提取中,对浙江、东北、四川以及安徽四个地区采集到的灵芝子实体中的多糖分别用碱提法和水提法进行测定,结果显示该优化工艺的多糖提取率是水提法的1.5~3.0倍。本试验得到的灵芝多糖超声辅助碱提工艺能显著提高灵芝多糖的提取率,对现实生产具有一定的指导意义。
[1]郝瑞芳,李荣春.灵芝多糖的药理和保健作用及应用前景[J].食用菌学报,2004,11(4):57-62.
[2]MA C W,FENG M Y,ZHAI X F,et al.Optimization for the extraction of polysaccharides fromGanoderma lucidumand their antioxidant and antiproliferative activities[J].J Taiwan Inst Chem E,2013,44(6):886-894.
[3]JOSEPH S,SABULAL B,GEROGE V,et al.Antitumor and anti-inflammatory activities of polysaccharides isolated fromGanoderma lucidum[J].Acta Pharmaceut,2011,61(3):335-342.
[4]ZHAO L Y,DONG Y H,CHEN G T,et al.Extraction,purification,characterization and antitumor activity of polysaccharides fromGanoderma lucidum[J].Carbohyd Polym,2010,80(3):783-789.
[5]CAO L Z,LIN Z B.Comparison of the effects of polysaccharides from wood-cultured and bag-culturedGanoderma lucidumon murine spleen lymphocyte proliferationin vitro[J].Acta Pharm Sin,2003,38(2):92-97.
[6]ZHU L N,LUO X,TANG Q J,et al.Isolation,purification,and immunological activities of a low-molecular-weight polysaccharide from the Lingzhi or Reishi medicinal mushroomGanoderma lucidum(higher Basidiomycetes)[J].Int J Med Mushrooms,2013,15(4):407-414.
[7]PAN K,JIANG Q G,LIU G Q,et al.Optimization extraction ofGanoderma lucidumpolysaccharides and its immunity and antioxidant activities[J].Int J Biol Macromol,2013,55(1):301-306.
[8]盖玉红.灵芝多糖抗氧化活性研究[D].吉林:吉林农业大学硕士论文,2007.
[9]CHEN T Q,WU Y B,WU J G,et al.Efficient extraction technology of antioxidant crude polysaccharides fromGanoderma lucidum(Lingzhi),ultrasonic-circulating extraction integrating with superfine-pulverization[J].J Taiwan Inst Chem E,2014,45(1):57-62.
[10]ZHU X Y,CHEN X,XIE J,et al.Mechanochemical-assisted extraction and antioxidant activity of polysaccharides fromGanoderma lucidumspores[J].Int J Food Sci Tech,2012,47(5):927-932.
[11]HIKINO H,KONNO C,MIRIN Y,et al.Isolation and hypoglycemic activity of ganoderma A and B,glycans ofGanoderma lucidumfruit bodies[J].Plant Medica,1985,51(4):339-340.
[12]朱 影.雪灵芝多糖的分离纯化、结构鉴定及其生物活性研究[D].武汉:华中农业大学硕士论文,2009.
[13]董玉玮,苗敬芝,曹泽虹,等.酶法提取灵芝多糖的工艺研究[J].食品科技,2009,34(6):217-219.
[14]蒋世云,黄世吉,叶 军,等.超声波法提取灵芝多糖及其萨氏法(Somogyi)测定[J].中国酿造,2008,27(14):87-89.
[15]黄生权,李进伟,宁正祥.微波-超声协同辅助提取灵芝多糖工艺[J].食品科学,2010,31(16):52-55.
[16]黄生权.赤灵芝多糖的提取分离、结构分析与生物活性研究[D].广州:华南理工大学博士论文,2010.
[17]周海华.云芝多糖的超声辅助提取及抗氧化活性研究[D].镇江:江苏大学硕士论文,2007.
[18]孙小梅,戴 军,陈尚卫,等.灵芝子实体多糖提取方法优化及不同来源赤芝子实体的多糖分子质量比较[J].中国食品学报,2014,14(3):40-46.
[19]DUBOIS M,GILLES K,HAMILTON J K,et al.A colorimetric method for the determination of sugars[J].Nature,1951,168(4265):167.
[20]农业部食用菌产品质量监督检测测试中心,上海市农业科学院食用菌研究所.NY/T 1676—2008 食用菌中粗多糖含量的测定[S].北京:中国标准出版社,2008.
