不同预处理方法对成年大鼠心肌保护效果的对比研究
2015-04-10唐文帅赵树林廖祥丽钟前进胡义杰许红霞第三军医大学大坪医院野战外科研究所营养科重庆40004第三军医大学大坪医院野战外科研究所心血管外科重庆40004
唐文帅,廖 丽,赵树林,廖祥丽,钟前进,胡义杰,许红霞 (.第三军医大学大坪医院野战外科研究所营养科,重庆40004;.第三军医大学大坪医院野战外科研究所心血管外科,重庆40004)
体外循环心脏手术虽然采用了温度控制、高钾心脏停搏液等多种方式来减轻心肌损伤,但心肌缺血再灌注损伤是体外循环心脏手术后发生心功能衰竭的重要的原因之一[1]。JAK/STAT 信号通路调控以及自噬途径的调节是心肌缺血再灌注损伤各种机制研究的关键点。尽管已有研究报道了多种预处理措施来改善心肌缺血再灌注损伤,如心肌缺血预处理、AG490 调节JAK/STAT 信号通路、雷帕霉素(rapamycin)上调心肌细胞自噬等[2],但仍有诸多问题尚需阐明。一方面,这些不同机制的预处理措施心肌保护效果的差异尚未见文献报道,且多种保护机制之间是否存在相互作用尚无定论。另一方面,关于JAK/STAT 信号通路抑制剂AG490 的作用效果文献报道不一,是否可能存在其他非JAK/STAT 的信号通路机制参与其作用未见报道。本研究拟在成年SD 大鼠Langendorff 离体心脏灌注模型中比较不同预处理措施的心肌保护效果,进而比较各组JAK/STAT 信号通路和心肌自噬相关蛋白水平,探讨不同心肌保护措施时JAK/STAT 和心肌自噬间可能作用的复杂机制。
1 材料与方法
1.1 Langendorff 离体心脏灌注模型
由第三军医大学野战外科研究所实验动物中心提供6 月龄清洁级SD 大鼠,雌雄不限,体质量200 ~250 g。SD 大鼠腹腔注射3%戊巴比妥钠(1 mg/kg)麻醉后,固定于动物台上开腹并经下腔静脉注射肝素生理盐水(3 mg/kg)后,迅速开胸切取心脏,并将其置于95%O2和5%CO2混合气体平衡过的无钙冷灌流液(Krebs-Henseleit,KH)中。经主动脉插管逆行灌注于Langendorff 离体灌注装置(埃德公司,澳大利亚)上,以10 mL/min流量的KH 液行离体心脏灌注,灌注压力60 mmHg 以上。离体心脏平衡灌注20 min 后,心率(heart rate,HR)超过200 次/分,且左室收缩压大于60 mmHg,方能行后续心脏缺血再灌注实验,未满足上述条件的心脏应舍弃不用。
1.2 实验分组
20 只SD 大鼠根据不同预处理方式随机分为4 组(图1):对照组、缺血预处理组、AG490 预处理组和Rapamycin 预处理组。①对照组(5 只):SD 大鼠先以已平衡过的KH 液灌注30 min,停灌30 min,再恢复KH 液灌注30 min,模拟心肌缺血再灌注过程。②缺血预处理组(5 只):SD 大鼠先以已平衡过KH 液灌注20 min,然后停灌注5 min,复灌5 min,重复3 次,模拟缺血预处理。再停灌30 min,再恢复KH 液灌注30 min。③AG490预处理组(5 只):SD 大鼠先用已平衡过的KH 液灌注20 min,再给予KH 液+AG490(5 uM,Sigama 公司,美国)灌注10 min,停灌30 min,再恢复KH 液灌注30 min。④Rapamcin 预处理组(5 只):SD 大鼠先用已平衡过的KH 液灌注20 min,再给予KH 液+Rapamycin(终浓度200 nM,汉恒生物公司)灌注10 min,停灌30 min,再恢复KH 液灌注30 min。
Langendorff 离体心脏灌流系统自带的Powerlab 系统记录心脏功能相关数据。与本研究相关的心脏缺血再灌注后心脏功能相关指标包括:左心室发展压(left ventricular developed pressure,LVDP)、等容收缩期左心室内压上升最大变化速率(Max Dp/dt)、等容舒张期左心室内压下降最大变化速率(Min Dp/dt)。心脏缺血再灌注过程结束后,一部分心脏标本立即冻存于液氮,备后续蛋白分析;另一部分心脏标本采用10%中性甲醛固定并石蜡包埋,备后续的组织损伤评价。

图1 预处理干预的Langendorff 离体心脏灌注流程
1.3 心肌组织损伤评价
用TUNEL(TdT-mediated dUTP nick end labeling)细胞凋亡检测试剂盒(TUNEL Apoptosis Assay Kit,Roche,美国)检测心肌组织凋亡水平。采用Image Pro Plus 7.0 软件记录DAPI 细胞核染色和TUNEL 阳性细胞的数量。取3 个随机视野的平均值来计算心肌细胞凋亡的比例。
1.4 Western-blot 检测相关蛋白水平
抽提心肌组织的总蛋白后,BCA 法检测总蛋白浓度。10%SDS-PAGE 胶电泳,电转PVDF 膜,封闭后加anti-STAT3 抗体、anti-p-STAT3 抗体、anti-LC3 抗体和anti-LAMP2 抗体及对应的二抗免疫印迹检测相应蛋白的表达,内参采用β-actin。
1.5 统计学处理
采用SPSS 18.0 统计软件进行分析,计量资料以均数±标准差表示,采用单因素方差分析比较组间差异,以P <0.05为差异具有统计学意义。
2 结果
2.1 各预处理措施后心脏血液动力学表现比较
缺血预处理组、AG490 预处理组、Rapamycin 预处理组的LVDP、Max Dp/dt、Min Dp/dt 均显著优于对照组,差异有统计学意义(P <0.05)。3 种预处理措施之间比较,AG490 预处理组与Rapamycin 预处理组的Max Dp/dt 和Min Dp/dt 比较差异有统计学意义(P <0.05),但AG490 预处理组与缺血预处理、Rapamycin 预处理与缺血预处理之间无显著差异(表1)。提示3种预处理措施均有改善心肌缺血再灌注损伤的效果,AG490 预处理组效果与缺血预处理组相当,但优于Rapamycin 预处理组。
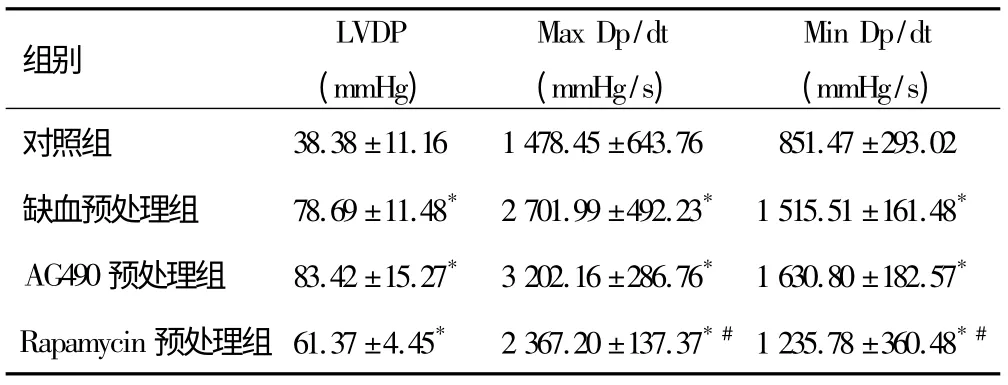
表1 各组预处理措施后心脏血液动力学表现比较
2.2 各预处理措施后心肌损伤程度比较
各预处理措施后心肌组织的平均凋亡率:对照组47%、缺血预处理组18%、AG490 预处理组24%和Rapamycin 预处理组20%(图2),提示缺血预处理组、AG490 预处理组和Rapamycin预处理组心肌组织凋亡水平均低于对照组。3 种预处理措施在心肌凋亡方面差异无统计学意义。
2.3 各预处理后STAT3 及其磷酸化水平、自噬相关蛋白水平的比较
考虑到JAK/STAT3 信号通路中STAT3 及其磷酸化水平、自噬水平的在预处理机制中的重要作用,我们比较了上述2 种机制的相关蛋白水平。从JAK/STAT 信号通路方面来看,缺血预处理组STAT3 水平最高,AG490 组和Rapamycin 组其次,但均高于对照组水平;AG490 组p-STAT3 水平明显低于缺血预处理组和Rapamycin 预处理组,接近对照组(图3),提示AG490预处理后STAT3 的磷酸化水平并不高于对照组,其发挥心肌保护作用的机制可能并非通过经典的JAK/STAT信号作用途径实现。从心肌自噬角度来看,Rapamycin 组LC3 水平最高,缺血预处理组和AG490 组接近,但均显著高于对照组。而代表心肌自噬溶酶体功能的LAMP2 水平,在缺血预处理组最强,Rapamycin 预处理和AG490 预处理组其次,但均显著高于对照组(图3),提示AG490 预处理提高了心肌的自噬水平,部分自噬标志物水平与缺血预处理和Rapamycin 预处理组接近。
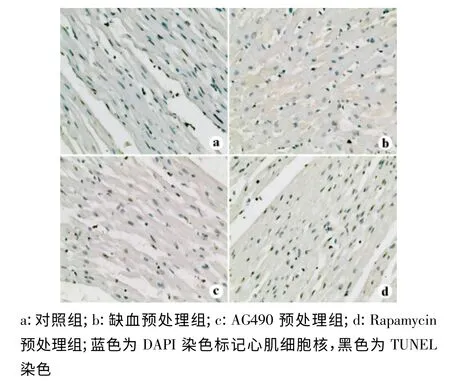
图2 各组预处理措施后心肌细胞凋亡分析(×400)

图3 各组预处理措施后心肌组织蛋白水平分析
3 讨论
既往研究认为,JAK/STAT3 信号通路在心肌缺血再灌注损伤机制中发挥重要作用[3-5]。在缺血阶段,STAT3 通过磷酸化而活化;在再灌注阶段,STAT3 的磷酸化进一步增加;STAT3 的磷酸化能减轻心肌细胞的死亡。目前公认能有效减轻心肌缺血再灌注损伤的措施——缺血预处理或缺血后处理,其发挥保护作用的机制,必须依赖STAT3 且其效果与STAT3 磷酸化水平有关。活化的STAT3 不仅可以减轻缺血再灌注对线粒体的损伤,减少氧自由基的释放[6],也能影响其下游的多个发挥心肌保护作用靶基因表达,特别是发挥清除氧自由基作用的锰超氧化物岐化酶表达[7-8]。各种预处理措施对JAK/STAT3 信号通路的影响不同,其心肌保护效果可能存在差异。
事实上,JAK 特异性酪氨酸激酶抑制剂AG490,作为预处理措施时,其效果和可能的作用机制目前尚存争议。AG490 能有效抑制STAT3 磷酸化,常常作为JAK/STAT3 信号通路在心肌缺血再灌注损伤机制研究的干预措施;其阻断STAT3 会导致心肌细胞凋亡水平增加[9]。但Hwang 等[10]和我们的研究均显示AG490 预处理能有效减轻心肌缺血再灌注损伤;且其离体心脏保护效果接近Rapamycin 和缺血预处理。此外,当AG490 和缺血预处理同时给予时,缺血预处理的效果也消失[11]。我们的研究也发现,AG490 预处理后,STAT3 磷酸化水平显著低于缺血预处理和Rapamycin 预处理,与正常对照组相当。这些现象提示AG490 预处理发挥作用的机制可能并非通过经典的JAK/STAT 信号作用途径实现。
基于这一特殊现象,我们对与JAK/STAT 信号通路相关,且在心肌缺血再灌注损伤中发挥重要作用的自噬过程进行了进一步的对比观察和机制分析。观察到AG490 预处理能影响发挥心肌保护作用的另一重要过程——心肌自噬[12],部分自噬标志物水平与缺血预处理和Rapamycin 预处理组接近。其可能机制包括:一方面,非致命性的AG490 损害激发心肌细胞动员其他机制诱导了自噬等预处理保护作用。其作用方式类似于缺血预处理措施,但我们的结果显示其效果不亚于缺血预处理。有研究认为,抑制STAT3 能通过电子呼吸链复合物Ⅰ降低线粒体ATP 产生从而刺激ROS 的生成,促进自噬的发生;且增高的ROS 却可以活化STAT3,形成STAT3 的自反馈机制[13]。另一方面,最新研究显示抑制STAT3 能上调细胞自噬。Shen等[14]和Jonchere 等[15]发现细胞浆内STAT3 能通过抑制PKR 活性来抑制自噬;而抑制STAT3 能刺激自噬流的水平。因此,类似于缺血后处理在不同模型、不同干预阶段而存在不同调节机制的现象[16],AG490 预处理能减轻后续的心肌缺血再灌注损伤,但其发挥心肌保护作用的具体机制可能与具体的干预环节有关系。
总之,本研究通过比较缺血预处理、AG490 预处理和Rapamycin 预处理3 种措施,发现AG490 预处理对成年大鼠心肌保护效果与缺血预处理、Rapamycin预处理相当,其机制可能并非通过经典的JAK/STAT信号作用途径实现,而可能与其诱导的保护性自噬相关。
[1]Ibanez B,Heusch G,Ovize M,et al.Evolving therapies for myocardial ischemia/reperfusion injury[J].J Am Coll Cardiol,2015,65(14):1454 -1471.
[2]沈 诚,陈建明,胡义杰,等.STAT3 介导缺血后处理心肌保护作用的研究[J].局解手术学杂志,2013,22(6):631 -634.
[3]Zhuo C,Wang Y,Wang X,et al.Cardioprotection by ischemic postconditioning is abolished in depressed rats:role of Akt and signal transducer and activator of transcription-3[J].Mol Cell Biochem,2011,346(1 -2):39 -47.
[4]Boengler K,Buechert A,Heinen Y,et al.Cardioprotection by ischemic postconditioning is lost in aged and STAT3-deficient mice[J].Circ Res,2008,102(1):131 -135.
[5]Bolli R,Dawn B,Xuan YT.Role of the JAK-STAT pathway in protection against myocardial ischemia/reperfusion injury[J].Trends Cardiovasc Med,2003,13(2):72 -79.
[6]Yang Y,Duan W,Jin Z,et al.JAK2/STAT3 activation by melatonin attenuates the mitochondrial oxidative damage induced by myocardial ischemia/reperfusion injury[J].J Pineal Res,2013,55(3):275 -286.
[7]Barry SP,Townsend PA,Latchman DS,et al.Role of the JAK-STAT pathway in myocardial injury[J].Trends Mol Med,2007,13(2):82 -89.
[8]Goodman MD,Koch SE,Afzal MR,et al.STAT subtype specificity and ischemic preconditioning in mice:is STAT-3 enough?[J].Am J Physiol Heart Circ Physiol,2011,300(2):522 -526.
[9]Kunisada K,Negoro S,Tone E,et al.Signal transducer and activator of transcription 3 in the heart transduces not only a hypertrophic signal but a protective signal against doxorubicin-induced cardiomyopathy[J].Proc Natl Acad Sci USA,2000,97(1):315 -319.
[10]Hwang YC,Shaw S,Kaneko M,et al.Aldose reductase pathway mediates JAK-STAT signaling:a novel axis in myocardial ischemic injury[J].FASEB J,2005,19(7):795 -797.
[11]Hattori R,Maulik N,Otani H,et al.Role of STAT3 in ischemic preconditioning[J].J Mol Cell Cardiol,2001,33(11):1929 -1936.
[12]Gatica D,Chiong M,Lavandero S,et al.Molecular mechanisms of autophagy in the cardiovascular system[J].Circ Res,2015,116(3):456 -467.
[13]Boengler K,Ungefug E,Heusch G,et al.The STAT3 inhibitor stattic impairs cardiomyocyte mitochondrial function through increased reactive oxygen species formation[J].Curr Pharm Des,2013,19(39):6890 -6895.
[14]Shen S,Niso-Santano M,Adjemian S,et al.Cytoplasmic STAT3 represses autophagy by inhibiting PKR activity[J].Mol Cell,2012,48(5):667 -680.
[15]Jonchere B,Belanger A,Guette C,et al.STAT3 as a new autophagy regulator[J].JAKSTAT,2013,2(3):e24353.
[16]Barsukevich V,Basalay M,Sanchez J,et al.Distinct cardioprotective mechanisms of immediate,early and delayed ischaemic postconditioning[J].Basic Res Cardiol,2015,110(1):452.
