大黄鱼(Larimichthys crocea)补体调节因子CFH和CFHR2基因的分子特征及表达分析*
2015-04-10郭宝英祁鹏志张建设毋玉婷吴常文
郭宝英 张 川 祁鹏志 张建设 管 奥 陈 宇 毋玉婷 吴常文
(浙江海洋学院 国家海洋设施养殖工程技术研究中心 舟山 316022)
大黄鱼(Larimichthys crocea),隶属鲈形目、石首鱼科(Sciaenidae),俗称黄花鱼,曾广泛分布于中国东海、南海以及黄海南部。大黄鱼肉质细嫩、味道鲜美,是我国沿海传统“四大海产”之一。由于野生资源衰竭,大黄鱼人工养殖业发展迅速,养殖主要集中于浙江、广东和福建等沿海地区。大黄鱼现已发展成为我国海水网箱养殖量最大的鱼种,经济效益巨大(张彩兰等,2002;Zheng et al,2006)。近年来,由弧菌属细菌引起弧菌病呈爆发趋势。该病发病迅速、传播速度快、流行时间长、死亡率高(金珊等,2005),对大黄鱼养殖业造成严重冲击。实际生产中,常用抗生素及化学药物来预防治疗该病,虽然防治效果明显,但会导致耐药性增加,药物残留等一系列不良效果。近年来研究人员试图通过提高大黄鱼自身免疫力来防御病害侵袭,而这需要在深入阐释大黄鱼免疫调控机制的基础上进行。目前,已有相当数量的大黄鱼免疫相关基因被发现,其参与疾病发生的响应模式也被陆续鉴定(Wang et al,2009;Tian et al,2010;Qian et al,2013;Li et al,2014;Zhou et al,2014),大黄鱼基因组测序也已完成(Wu et al,2014;Ao et al,2015)。这些研究为最终阐释大黄鱼响应疾病发生的免疫调节机制提供了理论基础。
补体是鱼类免疫系统重要的组分,在免疫组织中,约有二分之一的补体成分是作为调节因子存在的,而其中大部分都存在于血清和细胞表面中。当受到病原体刺激后,补体各成分依赖于一系列丝氨酸蛋白酶的酶解级联反应被活化,产生具有生物活性的多肽片段,聚合形成具有酶活性的复合体,发挥识别和消除外来病原体,辅助吞噬、裂解细胞,免疫调节等作用。同哺乳动物类似,鱼类补体系统可通过经典途径、旁路途径、凝集素途径被激活,3条途径既相对独立又相互联系(Boshra et al,2006)。哺乳动物中补体系统的活化是由许多与膜结合的可溶性补体调节蛋白来调节的,这些补体调节蛋白可以避免自身组织由于过度激活而造成损伤(Molina et al,2004)。补体调节因子CFH属于RCA家族,是单链血清糖蛋白,在替代途径中可与细胞膜结合膜蛋白发挥作用,也可以以可溶性状态发挥作用。CFH可以通过和 C3b的结合加速C3转化酶的分解,同时作为CFI的辅因子,提高了CFI与C3b的亲和力,促进丝氨酸蛋白酶切割C3b分子。研究表明各种补体效应分子能够与多种调控蛋白质相结合,形成复合物,进而识别补体受体,形成补体质膜穿孔复合物,杀伤靶细胞(Buresova et al,2011)。除了CFH以外,已经有5种CFH家族补体调节因子 CFHR1-5在人类中被鉴定克隆出来。它们彼此之间具有高度的同源性,由数量不等的短的重复SCRs序列复制而成,每一个SCR结构域包含约 60个进化上高度保守的氨基酸(Hourcade et al,1989)。CFH和CFHR基因已经在老鼠(Demberg et al,2002)、猪(Hegasy et al,2003)、斑马鱼(sun et al,2010)等生物中被鉴定。虽然补体系统在鱼类机体免疫中发挥至关重要作用,但有关大黄鱼补体研究的报道较少,仅本团队前期对大黄鱼补体分子C3/C4进行了分子鉴定及表达分析,但对于补体调节因子的研究依然空白。本文鉴定了大黄鱼补体调节因子 CFH和CFHR2,并分析了其组织表达特异性及响应溶藻弧菌感染的表达特征。本文研究成果可望为大黄鱼响应溶藻弧菌感染的免疫调节机制的最终阐释提供资料支撑。
1 材料与方法
1.1 材料
实验用 200条健康大黄鱼均取自浙江海洋学院福建苍南养殖基地,均约 500g/尾。实验前将大黄鱼养殖在恒温养殖池内,温度控制在 24°C,投喂商业饲料。
两周后随机选取健康大黄鱼6尾,用致死剂量的MS-222处死。迅速解剖,取脑、肌肉、心脏、鳃、肠、肝脏、脾脏和肾脏等8种组织,置于RNA保存液中,–80°C 保存备用。
将实验室保存的溶藻弧菌(Vibrio alginolyticus)菌种活化,扩大培养,然后稀释菌液到 108CFU/mL备用。随机选取100条健康大黄鱼,等分为实验组和对照组,每组 50尾。实验组采用腹腔注射法每尾注射200μL 溶藻弧菌悬液,对照组每尾注射200μL PBS。分别于注射后0h,6h,12h,24h,36h 和 48h采样。每次取样4尾,取肝、脾、肾3种组织,–80°C保存备用。用Trizol (Invitrogen)提取总RNA,试剂盒(Fermentas)逆转录成cDNA,用于大黄鱼CFH和CFHR2基因的克隆扩增及表达检测。
1.2 Lc-cfh和Lc-cfhr2基因克隆及全长cDNA的获得
分析本实验室测序的大黄鱼全基因组序列,获取大黄鱼CFH和CFHR2的基因全长。在起始密码子区和终止密码子区设计特异性引物P1和P2,PCR扩增获得大黄鱼 CFH和 CFHR2基因(Lc-cfh和Lc-cfhr2)ORF区全长。
1.3 序列分析
采用NCBI数据库中ORF finder程序预测Lc-cfh和Lc-cfhr2氨基酸序列,并进行同源序列比对。采用SMART (http: //smart.embl-heidelberg.de/)和SignalP 4.0 程序(http: //www.cbs.dtu.dk/services/ SignaIP/)分别进行结构域分析和信号肽预测。利用 CLUSTALX软件进行氨基酸序列的多重比对。采用邻接法(Neighbour-joining)构建系统发育树,通过自举分析(bootstrap)进行置信度检测,重复次数为1000次。
1.4 Lc-cfh和Lc-cfhr2特异性表达分析
根据Lc-cfh和Lc-cfhr2基因的cDNA序列跨内含子区设计一对特异性引物P3和P4,用于荧光定量分析(qPCR),选取 β-actin作为内参基因(黄左安等,2011)。
荧光定量检测试剂采用 SYBR定量检测试剂盒(TaKaRa),qPCR 采用 10μL反应体系,含 SYBR Premix ExTaq (2×)缓冲液 5μL,正向和反向引物(10μmol/L)各 0.6μL,cDNA 模板 0.5μL,灭菌水补足至10μL。扩增反应在Applied Biosystems 7500P 荧光定量 PCR 仪上进行,95 °C变性120 s后,按以下程序进行 40 个循环: 95°C 15s,59°C 45s,72°C 30s。实验结束时采用熔解曲线分析,流程为95°C 30s,72°C 60s,95°C 30s,每样品重复 3 次。采用 2–ΔΔCt(Livak et al,2001)分析相对定量结果,显著性水平采用SPSS18.0软件中的单因素方差分析(One-way ANOVA)进行统计,P<0.05为差异显著。

表1 PCR引物序列Tab.1 Primers used for PCR amplification
2 结果与分析
2.1 Lc-cfh和Lc-cfhr2基因cDNA序列分析
Lc-cfh基因 cDNA 序列全长 1332bp个核苷酸(GenBank登录号: KP710858),编码一个由443个氨基酸组成的前体蛋白,其预测的相对分子质量为49.96 kDa,等电点为6.66。前体蛋白N端24个氨基酸为信号肽序列。利用SMART数据库对结构域检测分析显示,Lc-cfh蛋白包含5个CCP结构域(图1a)。序列存在1个潜在的N-糖基化位点(Asn237)。Lc-cfhr2基因cDNA序列全长1170bp个核苷酸(GenBank登录号: KP710859),编码一个由389个氨基酸组成的前体蛋白,相对分子质量 43.53 kDa等电点为5.61,前体蛋白N端32个氨基酸为信号肽序列,包含4个CCP结构域(图1b)。序列存在 3个潜在的 N-糖基化位点(Asn90,Asn112,Asn148)。虽然在两个基因中,糖基化位点数不同,但是它们都处于CCP结构中。同样人的CFH基因发现与肝素的三个结合位点分别位于SCRs7,SCRs13,SCRs20 上(Krushal et al,1998)。
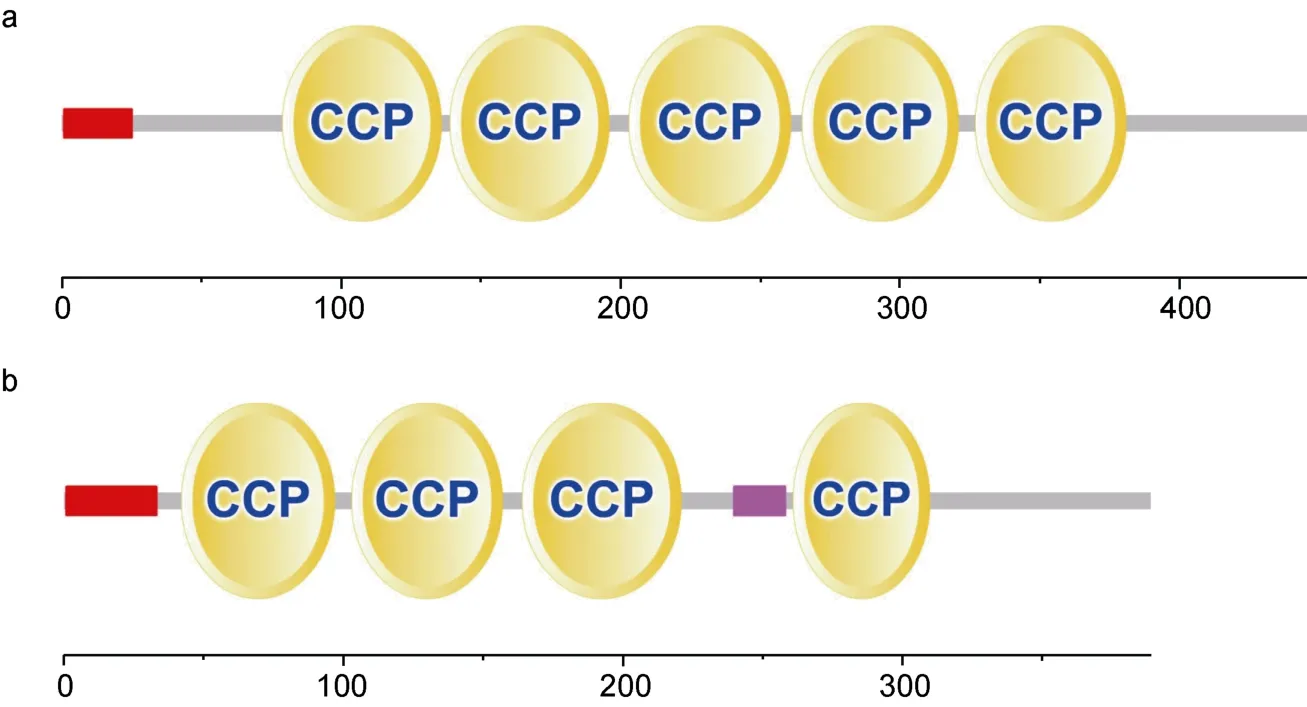
图1 大黄鱼Lc-cfh和Lc-cfhr2结构域Fig.1 Structural domains of Lc-cfh and Lc-cfhr2 putative amino acids sequences a.Lc-cfh结构域;b.Lc-cfhr2结构域
比对 Lc-cfh、Lc-cfhr2、Hs-cfh及 Hs-cfhr2 CCP结构序列,发现半胱氨酸(Cys)残基具有高保守性,所有CCPs均包含4个Cys残基,且排列位置大致相同。同时,脯氨酸、天冬氨酸以及甘氨酸残基也相对保守(图2)。
为了研究Lc-cfh、Lc-cfhr2在进化过程中所处的位置,构建以金仓鼠(Mesocricetus auratus)和半滑舌鳎(Cynoglossus semilaevis)CFI基因为外群的系统发育树。如图3所示,Lc-cfh、Lc-cfhr2分别和其它鱼类CFHs及 CFHR2s聚合成单独分支,然后再与哺乳类相关同源物聚成一大类,聚类结果符合传统的分类方法。总体来看,CFH和CFHR2基因在进化树中聚合成独立的大支,独立于外群CFI基因,表明两个补体调节因子较近的亲缘关系。

图2 Lc-cfh、Lc-cfhr2、Hs-cfh及Hs-cfhr2 CCP结构序列比对图Fig.2 CCP alignment of Lc-cfh,Lc-cfhr2,Hs-cfh and Hs-cfhr2
2.2 Lc-cfh和Lc-cfhr2组织表达特征
如图4所示,在所检测的大黄鱼脾脏、肾、肠、脑、心脏、肌肉、鳃、肝脏等8种组织中,Lc-cfh和Lc-cfhr2均有表达,二者均发现在肝脏中表达量最高,显著高于其它组织,而在脑中的二者表达量均最低。除肝脏外,Lc-cfh在肠道中也检测到较高表达量,显著高于其它组织,而Lc-cfhr2依次在肾脏、鳃和肠中呈现显著表达。
2.3 溶藻弧菌感染后,Lc-cfh和Lc-cfhr2表达特征分析
检测了溶藻弧菌感染后,Lc-cfh和Lc-cfhr2在肝脏、脾脏、肾脏三种组织中的表达情况。如图5所示,溶藻弧菌感染后,Lc-cfh和Lc-cfhr2在肝、脾、肾中的表达量都呈现不同程度上升。在肝脏中,溶藻弧菌感染后 6h,Lc-cfh表达量出现显著升高,感染后 24h达到峰值,为正常表达量的11.4倍,此后Lc-cfh表达量呈逐渐下降趋势。而Lc-cfhr2表达量在弧菌感染后呈现温和上升,与 Lc-cfh相似,Lc-cfhr2也在弧菌感染后 24h达到峰值,但仅为正常表达量的 4.3倍(图5a)。在肾脏中,溶藻弧菌感染后,Lc-cfh和 Lc-cfhr2表达量均呈现明显变化。感染后6h,两基因表达量开始显著升高,并呈现温和上升趋势,Lc-cfh表达量在36h时达到峰值,为正常表达量3.5倍,而Lc-cfhr2在48h时达到峰值,为正常表达量的 6.1倍。除感染后12h外,在其它各时间点,Lc-cfhr2表达量明显高于Lc-cfh,表明在肾脏组织中,受弧菌刺激后,Lc-cfhr2相比 Lc-cfh具有更高的响应效率(图5b)。在脾脏中,弧菌刺激后,Lc-cfh表达量温和上升,感染后 24h表达量显著上升,感染后48h达到峰值,为正常量的8.4倍,而Lc-cfhr2在感染后24h即达到峰值,为正常值4.6倍,后逐渐降低。暗示受到溶藻弧菌感染,脾脏组织中感染前期Lc-cfhr2发挥主导作用,而感染24h后,Lc-cfh开始发挥主要作用(图5c)。
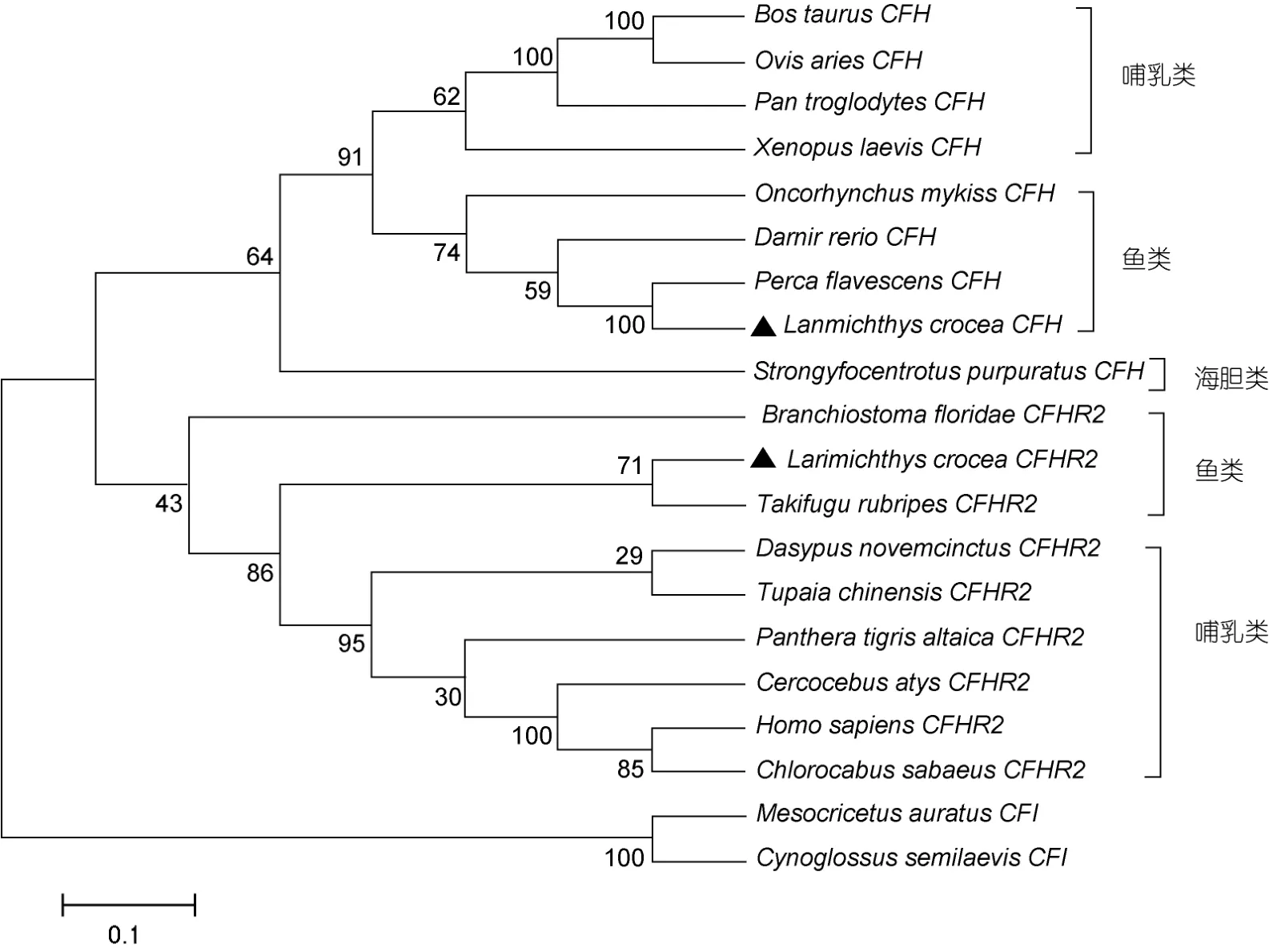
图3 基于邻近法的CFH和CFHR2系统发育树Fig.3 The phylogenetic tree of CFH and CFHR2 based on neighbor-joining method
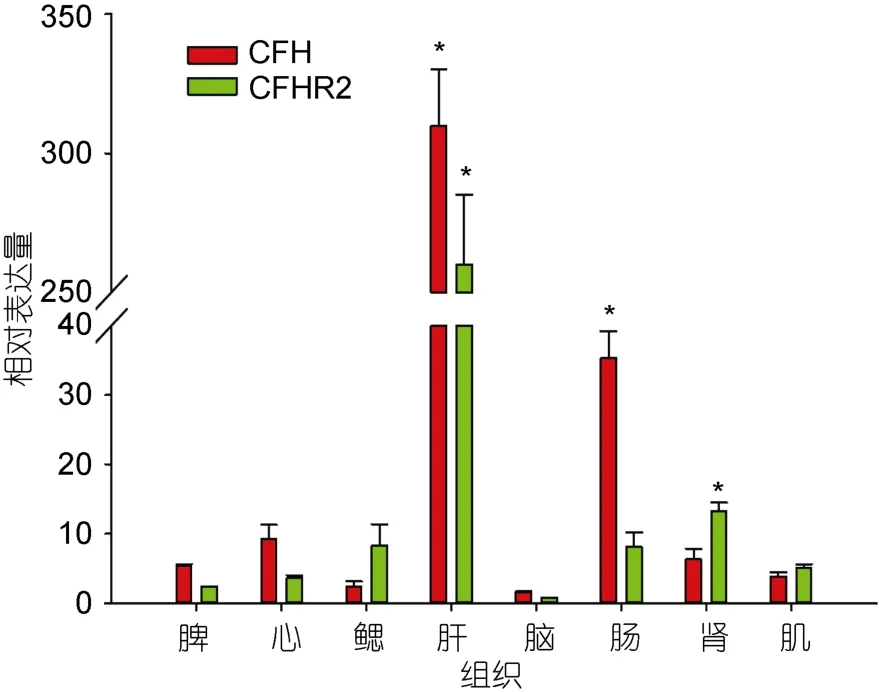
图4 Lc-cfh和Lc-cfhr2基因组织表达特征分析Fig.4 Tissue distributions of Lc-cfh and Lc-cfhr2
3 讨论
3.1 Lc-cfh和Lc-cfhr2分子特征
本文利用大黄鱼基因组数据库,获得了大黄鱼补体调节蛋白CFH和CFHR2的全长cDNA序列,在ORF区设计特异引物,获得了Lc-cfh和Lc-cfhr2 ORF全序列(GenBank: KP710858.1,KP710859.1)。序列分析表明,Lc-cfh和Lc-cfhr2包含多个保守的CCPs序列(补体控制蛋白),含有CCP结构域的蛋白质一般分为两类,即补体激活调节蛋白质(regulators of complement activation,RCA)和非补体激活调节蛋白质(non-RCA)(Zipfel et al,2009)。CCP结构域大约包含60个氨基酸残基,结构分析表明,CCP结构域具有“Cys-Cys-Cys-Trp-Cys”基序(LHR),这一序列与其功能直接相关(Soares et al,2005)。Lc-cfh和 Lc-cfhr2 CCP结构域均具有 4个高度保守的 Cys残基,具有RCA蛋白家族的典型特征。CFH是一种补体激活途径的抑制因子,它在C3b的表面有多个结合位点,能够有效地抑制FB与C3b结合形成C3转化酶,也可以作为CFI的辅因子加速C3转化酶的衰变(Yates et al,2007)。C3b与CFH的1—4个CCP结构域形成的复合物会改变其结构,使得C3b的第一个键暴露在外,易于被CFI切割,而其它的键是随着构象的改变而被切割(Janssen et al,2006;Wu et al,2009)。高度保守的半胱氨酸残基之间可以形成二硫键,使得 SCR成为一个空间环状结构(Hourcade et al,1989)。并且在CCPs序列中分布若干数量不等的糖基化位点,而糖基化普遍被认为和免疫作用相关(Van Kooyk et al,2008)。尽管所有物种SCRs结构相对保守,但不同物种 CFH及 CFHRs包含的 CCP数量却有较大差异,CFH差异更为明显。大黄鱼CFH含有5个CCP结构域,而哺乳动物CFH一般含有20个CCP结构域,非洲爪蟾(Xenopus laevis)含有7个CCP机构,而硬骨鱼中的斑马鱼(Danio rerio)含有 15个 CCPs,黄金鲈(Perca flavescens)则含有4个CCP结构,文昌鱼含有2个SCRs结构域(Cai et al,2014),这可能是补体调节因子相关功能区在进化过程中对调控需求不同造成的。系统发育图显示鱼类和哺乳类的 CFH、CFHR2分别形成个不同的支系,然后再聚成一大类,基本符合传统分类法。整体上看,CFH和CFHR2具有较近的亲缘关系。CFH和其相关蛋白 CFHRs(CFHR1-5)共同组成 CFH基因家族,它们彼此之间具有高度的同源性,由数量不等的短的重复SCRs序列复制而成(Skerka et al,2013)。通过比对Lc-cfh和Lc-cfhr2的CCP结构,发现所有CCPs在N端和C端都具有高度保守性,CFH1和 CFHR21具有 55.1%的相似度,CFH1和 CFHR23具有 47.6%的相似度,CFH2和CFHR21也有 49%的相似度。这些序列同源性也表明,补体调节蛋白功能的正常发挥与这些短的同源序列紧密相关。
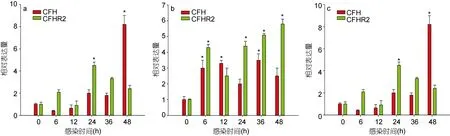
图5 溶藻弧菌感染后,Lc-cfh和Lc-cfhr2在肝(a)、肾(b)、脾(c)中表达量变化Fig.5 Expression characteristic analysis of Lc-cfh and Lc-cfhr2 in croaker liver (a),kidney (b)and spleen(c)induced by V.alginolyticus
3.2 大黄鱼CFH和CFHR2基因表达特性分析
组织表达特异性显示,健康大黄鱼 CFH基因和CFHR2在肝中表达量最高。在斑马鱼(sun et al,2010)和鼠(Hellwage et al,2006)的肝脏组织中,CFH基因mRNA表达量也显著高于其它组织。肝脏作为主要的解毒器官,在机体受到外界病原体侵染时对机体免疫起重要作用。同时,肝脏也是许多免疫因子尤其是各补体成分的主要发生器官(Zipfel et al,2002;Wang et al,2008b)。肝脏作为补体调节因子的主要合成器官,也已经在斑马鱼(Sun et al,2010)和虹鳟(Anastasiou et al,2011)上得到了证明。但同时应注意到在不同物种中,肝脏并不作为补体因子的唯一发生器官,这可能与蛋白在每个物种中的特异性功能有关。
溶藻弧菌感染后,Lc-cfh和 Lc-cfhr2 mRNA在肝、脾、肾中的表达量都呈现一个上升趋势。肝脏中CFH的mRNA表达量在6h和24h达到峰值,表达量明显高于对照组。肾脏中CFH的mRNA表达量水平在受到感染后6h增加到对照组的3倍,并且一直维持这个水平直到48h。在肝、肾中CFHR2 mRNA表达量水平增长同样明显,在24h和48h达到峰值,分别是对照组的4.6倍和6.2倍。说明受到病原体侵袭后,鱼类免疫器官能迅速对此作出免疫应答,大量合成补体调节因子避免补体分子过度激活,从而有效的保护机体不受伤害。此外,CFH作为一种粘附蛋白,通过细胞表面与 CR3受体结合,清除凋亡细胞、保护细胞对抗慢性炎症(Boshra et al,2006)。在脾脏中CFH mRNA表达量在6h下降到低于对照组的水平,直到24h又高于对照组,而CFHR2 mRNA在6h的表达量显著高于对照组水平。这说明补体调节因子在免疫途径中的调节有可能是多方面的,CFHR2的表达量水平可能会对CFH造成影响,作为同源基因共同在替代途径中发挥调节作用。在溶藻弧菌侵染后6h,CFHR2的mRNA表达量在三种免疫组织中都显著增加,说明大黄鱼CFHR2分子具有重要的免疫调节作用,但其具体的调节机制还需要更加深入的研究。
综上所述,本文报道了大黄鱼补体调节因子CFH和CFHR2的分子特征,并对其组织表达特异性以及感染溶藻弧菌的大黄鱼肝、脾、肾中的表达量变化进行了相关研究,为大黄鱼抗弧菌免疫的深入研究奠定了基础。
张彩兰,刘家富,李雅璀等,2002.福建省大黄鱼养殖现状分析与对策.上海水产大学学报,11(1): 77—83
金 珊,王国良,赵青松等,2005.海水网箱养殖大黄鱼弧菌病的流行病学研究.水产科学,24(1): 17—19
黄左安,陈 炯,陆新江等,2011.香鱼凝血因子X基因表达与鳗利斯顿菌感染的相关性.动物学研究,32(5): 492—498
Anastasiou V,Mikrou A,Papanastasiou A D et al,2011.The molecular identification of factor H and factor I molecules in rainbow trout provides insights into complement C3 regulation.Fish Shellfish Immunol,3: 491—499
Ao J,Mu Y,Xiang L X et al,2015.Genome sequencing of the perciform fish Larimichthys crocea provides insights into molecular and genetic mechanisms of stress adaptation.PLoS Genetics,11(4): 100—118
Boshra H,Li J,Sunyer J O,2006.Recent advances on the complement system of teleost fish.Fish Shellfish Immunol,20: 239—262
Buresova V,Hajdusek O,Franta Z et al,2011.Function algenomics of tick thioester-containing proteins reveal the ancient origin of the complement system.J Innate Immun,3(6): 623—630
Demberg T,Pollok-Kopp B,Gerke D et al,2002.Rat complement factor H: molecular cloning,sequencing and quantification with a newly established ELISA.Scand J Immuno,l56: 149—160
Hegasy G A,Willhoeft U,Majno S A et al,2003.Pig complement regulator factor H: molecular cloning and functional characterization.Immunogenetics,55: 462—471 Hellwage J,Eberle F,Babuke T et al,2006.Two factor H-related proteins from the mouse: expression analysis and functional characterization.Immunogenetics,58: 883—893
Hourcade D,Holers V M,Atkinson J P,1989.The regulators of complement activation (RCA)gene cluster.Adv Immunol,45: 381—416
Janssen B J,Christodoulidou A,McCarthy A et al,2006.Structure of C3b reveals conformational changes that underlie complement activity.Nature,444: 213—216
Krushal J,Kemper C,Gigli I,1998.Ancient origin of human complement factor H.J Mol Evol,47: 625—630
Li C H,Chen J,2013.Molecular cloning,characterization and expression analysis of a novel wap65-1 gene from Plecoglossus altivelis.Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology,165(2): 144—152
Livak K J,Schmittgen T D,2001.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod.Methods,25(4): 402—408
Lu Cai,Jiu Zhu,Denghua Yin et al,2014.Identification and characterization of complement factor H in Branchiostoma belcheri.Gene,553: 42—48
Molina H,2004.Complement and immunity.Rheum Dis Clin North Am,30: 175—191
Qian T,Wang K,Mu Y et al,2013.Molecular characterization and expression analysis of TLR 7 and TLR 8 homologs in large yellow croaker (Pseudosciaena crocea).Fish and Shellfish Immunology,35(3): 671—679
Rodriguez de Cordoba S,Esparza-Gordillo J,Goicoechea de Jorge et al,2004.The human complement factor H:functional roles,genetic variations and disease associations.Mol Immunol,41: 355—367
Skerka C,Chen Q,Fremeaux-Bacchi V et al,2013.Complement factor H related proteins (CFHRs).Molecular Immunology,56: 170—180
Soares D C,Gerloff D L,Syme N R et al,2005.Largescale modeling as a route to multiple surface comparisons of the CCP module family.Protein Eng Des Sel,18: 379—388
Sun G,Li H,Wang Y et al,2010.Zebrafish complement factor H and its related genes: identification,evolution,and expression.Funct Integr Genomics,10: 577—587
Tian C,Chen Y,Ao J et al,2010.Molecular characterization and bioactivity of a CXCL13 chemokine in large yellow croaker Pseudosciaena crocea.Fish and Shellfish Immunology,28(3): 445—452
Van Kooyk,Y,Rabinovich G A,2008.Protein-glycan interactions in the control of innate and adaptive immune responses.Nat Immunol,9: 593—601
Wang K J,Cai J J,Cai L et al,2009.Cloning and expression of a hepcidin gene from a marine fish (Pseudosciaena crocea)and the antimicrobial activity of its synthetic peptide.Peptides,30(4): 638—646
Wang Z,Zhang S,Wang G,2008.Response of complement expression to challenge with lipopolysaccharide in embryos larvae of zebrafish Danio rerio: acquisition of immunology competent complement.Fish Shellfish Immunology,25:264—270
Wu J,Wu Y Q,Ricklin D et al,2009.Structure of complement fragment C3b-factor H and implications for host protection by complement regulators.Nat Immunol,10: 728—733
Zheng W B,Liu G Z,Ao J Q et al,2006.Expression analysis of immune-relevant genes in the spleen of large yellow croaker(Pseudosciaena crocea)stimulated with poly (I: C).Fish Shellfish Immunol,21: 414—430
Zhou Q J,Su Y Q,Niu S F et al,2014.Discovery and molecular cloning of piscidin-5-like gene from the large yellow croaker(Larimichthys crocea).Fish and Shellfish Immunology,41(2): 417—420
Zipfel P F,Skerka C,2009.Complement regulators and inhibitory proteins.Nat Rev Immunol,9: 729—740
Zipfel P F,Skerka C,Hellwage J et al,2002.Factor H family proteins: on complement,microbes and human diseases.Biochem Soc Trans 30: 971—978
