WO3/γ-Bi2MoO6异质结的制备及其光催化性能
2015-04-10左广玲叶红勇李入林
左广玲,叶红勇,李入林
(南阳理工学院 生物与化学工程学院,河南 南阳 473004)
WO3/γ-Bi2MoO6异质结的制备及其光催化性能
左广玲,叶红勇,李入林
(南阳理工学院 生物与化学工程学院,河南 南阳 473004)
采用微波溶剂热法—浸渍法制备了WO3/γ-Bi2MoO6纳米异质结复合可见光催化剂(简称光催化剂),用XRD、SEM、XPS和UV-Vis分光光度法对其进行了表征。以甲基橙为目标降解物,考察了光催化剂的催化性能。表征结果显示:WO3分散在γ-Bi2MoO6晶体表面,未进入晶格内部;与WO3和γ-Bi2MoO6相比,WO3/γ-Bi2MoO6在紫外和可见光区的吸收强度均有所提高,且对光的吸收发生了明显的红移,禁带宽度变窄;二者形成的p-n型异质结能及时有效地促进光生电子-空穴对的分离,提高催化活性。实验结果表明:WO3/γ-Bi2MoO6的催化活性优于WO3和γ-Bi2MoO6;在甲基橙溶液初始质量浓度为10 mg/L、光催化剂WO3(1.0%)/γ-Bi2MoO6加入量为1 g/L时,反应3 h时甲基橙的降解率最高(达97.48%),甲基橙溶液中TOC的去除率也最高(为92.0%)。
氧化钨;γ-钼酸铋;异质结;复合光催化剂;甲基橙
钼酸铋是一种新型的光催化材料,在光化学和光催化领域具有潜在的应用前景[1]。常见的钼酸铋有α-Bi2Mo3O12,β-Bi2Mo2O9,γ-Bi2MoO63种晶型[2]。其中,γ-Bi2MoO6是简单的Aurivillius类化合物,属于钙钛矿型复合氧化物[3],禁带宽度约为2.7 eV,能被可见光激发,被认为是一种具有可见光响应的新型复合氧化物[4]。但由于纯γ-Bi2MoO6晶体内的光生载流子迁移困难,光生电子-空穴对易复合,造成纯γ-Bi2MoO6的可见光催化活性不高[5]。因此,如何有效分离电荷,降低光生载流子的复合率,已成为当前活跃的研究课题[6]。大量研究结果表明,能带匹配的两种半导体耦合在一起形成的异质结可以利用两种半导体能级结构的互补性,促进光生载流子的快速迁移[7];且光生电子从一种半导体注入到另一种半导体,能有效阻隔电子与空穴的复合通路,抑制光生电子-空穴对的复合,提高量子效率,进而提高光催化性能[8-9]。
本工作采用微波溶剂热法制备γ-Bi2MoO6纳米粉体,并通过浸渍法制备了WO3/γ-Bi2MoO6纳米异质结复合可见光催化剂(简称光催化剂);探讨了WO3/γ-Bi2MoO6的晶体结构、光吸收性质和可见光响应机理;并以甲基橙为目标降解物,考察了光催化剂对其的降解性能。
1 实验部分
1.1 试剂和仪器
Bi(NO3)3·5H2O、(NH4)6Mo7O24·4H2O、乙二醇甲醚、硝酸、NaOH、(NH4)6H2W12O40·nH2O、甲基橙:分析纯。
光催化反应装置:自制,光源为碘钨灯(工作波长325~800 nm),紫外/红外滤光片(通带420~700 nm)。
XRD-6000型X射线粉末衍射仪:岛津公司;JSM-5600LV型扫描电子显微镜:日本电子公司;UV-2550型UV-Vis分光光度计:岛津公司;ESCALAB MK2型X射线光电子能谱仪:英国VG公司;HTY-DI1000型TOC分析仪:杭州泰林生物技术设备有限公司;MKG-M1UC型微波常压水热合成仪:青岛迈可威微波应用技术有限公司;JY92-II型超声波细胞粉碎机:宁波科生仪器厂;TG16-WS型台式高速离心机:湖南湘仪实验室仪器开发有限公司。
1.2 光催化剂的制备
1.2.1 γ-Bi2MoO6的制备
取1 mmol (NH4)6Mo7O24·4H2O,溶于80 mL去离子水与乙二醇甲醚的混合溶液中(去离子水与乙二醇甲醚的体积比为2∶3)。再取5 mmol Bi(NO3)3·5H2O溶于20 mL 1.5 mol/L的硝酸溶液中。在磁力搅拌下,将Bi(NO3)3溶液逐滴加入到(NH4)6Mo7O24混合溶液中,用2 mol/L NaOH溶液调节混合溶液pH至适当值。将混合溶液转入反应釜中,将反应釜置于装有回流管的微波常压水热合成仪中,控制温度160 ℃,反应12 h。自然冷却,离心分离,固体经去离子水多次洗涤和无水乙醇洗涤后于80 ℃下干燥8 h,即得黄色粉状γ-Bi2MoO6。1.2.2 WO3/γ-Bi2MoO6的制备
取0.5 g γ-Bi2MoO6粉体,在超声振荡作用下均匀分散在20 mL去离子水中。加入适量的0.01 mol/L(NH4)6H2W12O40溶液,于85 ℃水浴中搅拌反应至水分蒸干,经无水乙醇洗涤、过滤、80 ℃烘干、400 ℃煅烧4 h后,得到WO3/γ-Bi2MoO6光催化剂。所得试样记为WO3(w)/γ-Bi2MoO6,其中,w代表光催化剂中WO3的质量分数,分别为0.5%,1.0%,1.5%,2.0%。
1.3 光催化降解实验
光催化降解实验在自制的光催化反应装置中进行,以甲基橙为目标降解物。光催化剂加入量为1 g/L,暗室中与100 mL 10 mg/L的甲基橙溶液混合,磁力搅拌60 min至吸附平衡,然后置于光催化反应器中,每隔30 min取样5 mL,高速离心分离,取上层清液于波长612 nm处测定其吸光度。
1.4 分析方法
分别采用XRD,SEM,XPS技术对制得的光催化剂进行表征。采用UV-Vis分光光度法测定甲基橙溶液的吸光度,计算甲基橙的降解率。采用TOC分析仪考察光催化降解过程中TOC的变化。
2 结果与讨论
2.1 光催化剂的表征
2.1.1 XRD表征结果
光催化剂的XRD谱图见图1。
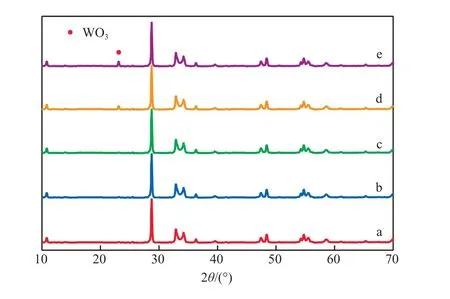
图1 光催化剂的XRD谱图
由图1可见,不同试样的XRD谱图的峰值和峰位均与JCPDS卡片21-0102一一对应,说明试样均为正交结构的γ-Bi2MoO6[10],WO3的复合并没有改变γ-Bi2MoO6的晶体结构;只是当WO3质量分数高于1.5%时,在2θ=23.09°处出现弱小的杂质峰,该峰可归属于WO3的特征峰(JCPDS:20-1324)[11]。同时这也说明,W以WO3的形式与γ-Bi2MoO6进行复合。另外,随WO3质量分数的增加,γ-Bi2MoO6的特征峰位没有发生移动,表明WO3物相并没有进入γ-Bi2MoO6的晶格内部,而是独立存在于其外表面。
2.1.2 SEM表征结果
γ-Bi2MoO6和WO3(1.0%)/γ-Bi2MoO6试样的SEM照片见图2。由图2a可见,γ-Bi2MoO6颗粒表面光滑,基本呈球形,平均粒径小于100 nm,分散性较好。由图2b可见:WO3(1.0%)/γ-Bi2MoO6的微观结构发生了明显改变,颗粒尺寸增大,呈近似球形,但团聚现象有所增加,这可能是浸渍后400 ℃煅烧时烧结所致;另外,颗粒表面存在一些40~60 nm的颗粒,这应该是复合在γ-Bi2MoO6表面的WO3。

图2 γ-Bi2MoO6(a)和WO3(1.0%)/γ-Bi2MoO6(b)试样的SEM照片
2.1.3 XPS表征结果
为进一步了解光催化剂中WO3和γ-Bi2MoO6的存在状态,对其进行了XPS表征,WO3(1.0%)/ γ-Bi2MoO6试样的XPS谱图见图3。由图3a可见,结合能为164.2 eV和158.9 eV的特征峰分别对应于Bi 4f5/2和Bi 4f7/2的内层电子,这预示着试样中Bi元素的价态为+3价[12],也证明试样中Bi以Bi2MoO6的形式存在。由图3b可见,结合能为235.7 eV和232.7 eV的特征峰对应于Mo 3d3/2和Mo 3d5/2的内层电子,说明Mo的价态是+6价[13],证明试样中的Mo主要以Bi2MoO6形式存在。由图3c可见,结合能为37.42 eV和35.42 eV的特征峰分别对应于W 4f5/2和W 4f7/2[14],证明试样中的W以WO3的形式存在。结合XRD的结果分析,可以断定WO3以单独物相的形式均匀地存在于γ-Bi2MoO6的表面上。
2.1.4 UV-Vis表征结果
光催化剂的UV-Vis吸收光谱见图4。由图4可见, WO3和γ-Bi2MoO6的吸收边(即光吸收阈值λg)分别在459 nm和467 nm附近,根据禁带宽度(Eg)计算公式Eg=1240/λg,可算出它们的禁带宽度分别为2.70 eV和2.66 eV,说明WO3和γ-Bi2MoO6本身都具有一定的可见光吸收性能。对比γ-Bi2MoO6,WO3(1.0%)/γ-Bi2MoO6在紫外和可见光区的吸收强度均有所提高,且对光的吸收发生了明显的红移现象,这是WO3和γ-Bi2MoO6协同光敏化作用的结果。WO3(1.0%)/γ-Bi2MoO6的吸收边为490 nm,对应的禁带宽度为2.53 eV,较γ-Bi2MoO6窄了0.13 eV,说明WO3的复合能增强γ-Bi2MoO6的可见光吸收能力,提高光生电子-空穴对的产生率,增强了催化剂的可见光催化活性。
2.2 光催化剂的活性
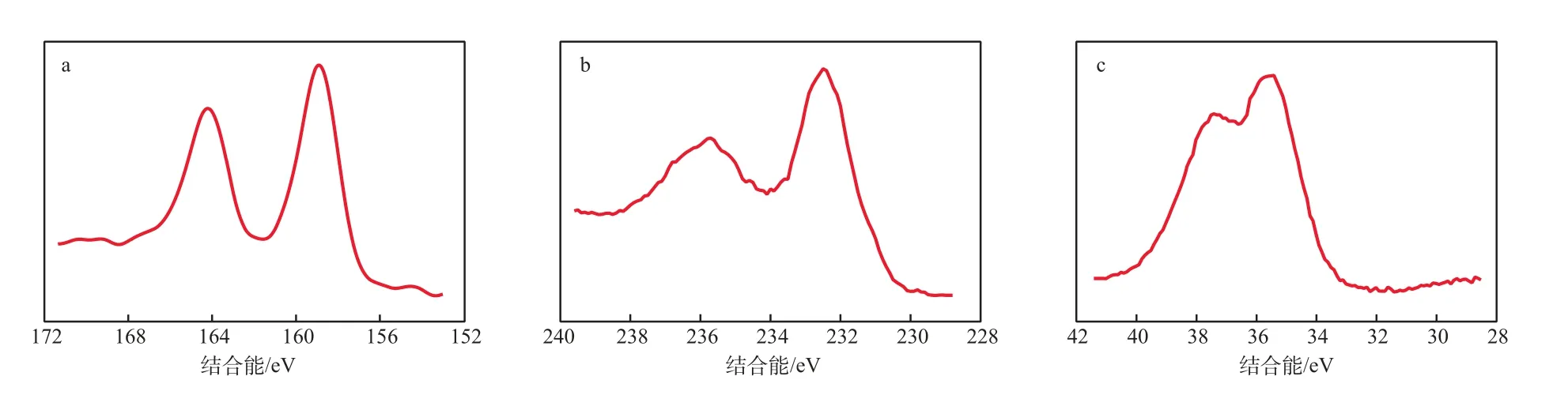
图3 WO3(1.0%)/γ-Bi2MoO6试样的XPS谱图
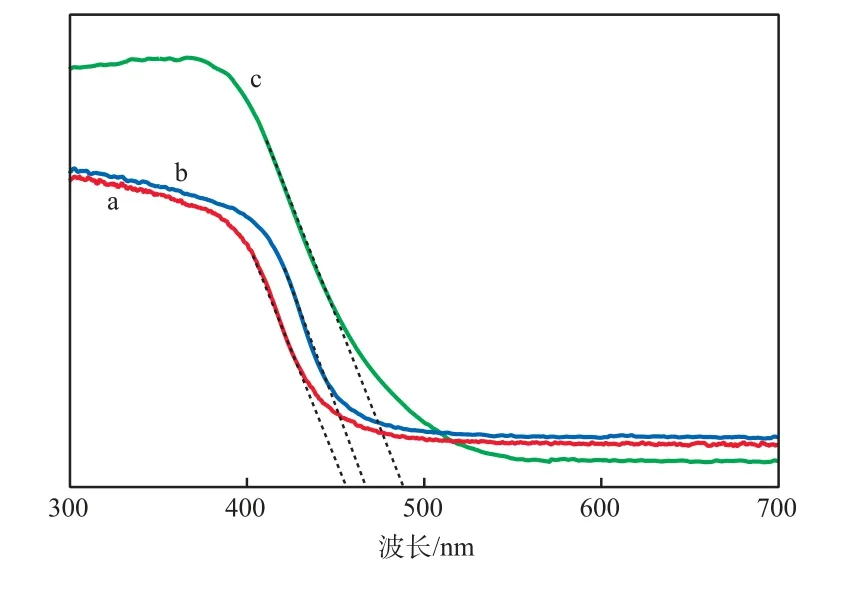
图4 光催化剂的UV-Vis吸收光谱光催化剂:a WO3;b γ-Bi2MoO6;c WO3(1.0%)/γ-Bi2MoO6
在甲基橙溶液初始质量浓度为10 mg/L、光催化剂加入量为1 g/L的条件下,光催化剂种类对甲基橙降解率的影响见图5。由图5可见: WO3和γ-Bi2MoO6在可见光辐照下,对甲基橙都有一定的降解作用,但降解效果不好,反应3 h时甲基橙的降解率均不超过50%; WO3(1.0%)/γ-Bi2MoO6对甲基橙的降解效果明显优于WO3和γ-Bi2MoO6,且降解率随WO3质量分数的增加先增加后降低;在WO3质量分数为1.0%时,反应3 h时甲基橙的降解率最高,达97.48%;继续增加WO3质量分数至1.5%时,甲基橙的降解率反而下降,反应3 h时甲基橙发降解率仅为91.32%。这是因为,当WO3质量分数过高时,γ-Bi2MoO6颗粒表面完全被WO3包裹,阻碍了γ-Bi2MoO6对可见光的吸收,致使WO3和γ-Bi2MoO6的光敏协同性部分失效,光催化剂的活性降低。因此,光催化剂WO3(1.0%)/γ-Bi2MoO6中WO3的最佳质量分数为1.0%。
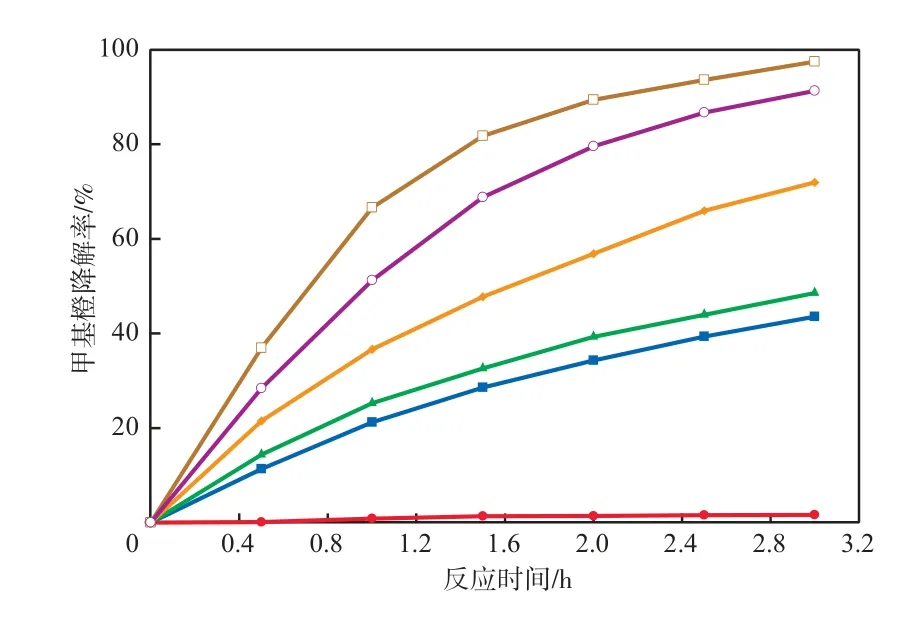
图5 光催化剂种类对甲基橙降解率的影响
在甲基橙初始质量浓度为10 mg/L、光催化剂加入量为1 g/L的条件下,光催化剂种类对甲基橙溶液中TOC去除率的影响见图6。由图6可见,WO3、γ-Bi2MoO6、WO3(0.5%)/γ-Bi2MoO6、WO3(1.0%)/ γ-Bi2MoO6和WO3(1.5%)/γ-Bi2MoO6分别作催化剂时,光催化降解3 h,TOC的去除率分别为26.3%,31.9%,55.4%,92.0%,82.6%。由此可看出,WO3(1.0%)/γ-Bi2MoO6对TOC的去除率最高。
2.3 光催化剂的催化机理
光催化剂对光催化反应的增强原理可通过能带调节方式进行解释。催化剂半导体的能带位置可通过公式EVB=X- Ec+0.5Eg计算[15]。式中,EVB是价带电位,eV ;X是Mulliken绝对电负性值,Ec为氢气的自由电子能(4.5 eV)。计算可得,WO3和γ-Bi2MoO6的EVB分别为3.44 eV和3.13 eV,导带电位(ECB)分别为0.74 eV和0.47 eV。光催化剂WO3/γ-Bi2MoO6的能带结构示意图见图7。由图7可见:由于WO3是典型的n型半导体[16],当WO3和γ-Bi2MoO6在界面上紧密复合后,便形成p-n型异质结;由于γ-Bi2MoO6的导带位置与WO3相比更负,因此被激发到γ-Bi2MoO6导带上的电子很容易通过催化剂的表面转移到WO3的导带上,光生空穴则因为静电势从WO3的价带转移到γ-Bi2MoO6的价带上,这样光生电子与光生空穴就得到了及时有效的分离,提高了催化剂的量子效率;聚集在WO3导带上的自由电子与O2结合生成O2-,最后转化成强氧化性的羟基自由基;而聚集在γ-Bi2MoO6价带上的空穴具有更强的氧化能力,能直接将有机物直接氧化分解为CO2和H2O。因此,WO3和γ-Bi2MoO6的p-n型异质结的形成,是促进光催化剂优异催化性能的根本原因。
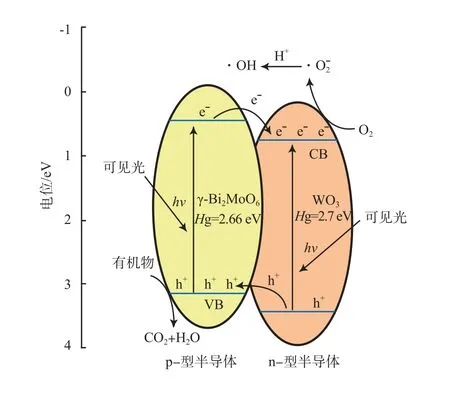
图7 光催化剂WO3/γ-Bi2MoO6的能带结构示意图
3 结论
a)利用微波溶剂热法—浸渍法成功制备出WO3/γ-Bi2MoO6纳米异质结复合光催化剂。XRD和XPS分析结果显示, WO3分散在γ-Bi2MoO6晶体表面,并未进入晶格内部。
b)与WO3和γ-Bi2MoO6相比,WO3(1.0%)/ γ-Bi2MoO6在紫外和可见光区的吸收强度均有所提高,且对光的吸收发生了明显的红移,禁带宽度变窄。
c)与WO3和γ-Bi2MoO6相比, WO3/γ-Bi2MoO6的可见光催化活性大幅提高;在甲基橙溶液初始质量浓度为10 mg/L、光催化剂加入量为1 g/L、WO3质量分数为1.0%时,反应3 h时甲基橙的降解率最高(达97.48%),甲基橙溶液中TOC的去除率也最高(为92.0%)。
d)WO3和γ-Bi2MoO6的能带相互匹配,形成的p-n型异质结能及时有效地促进电子和空穴的分离,提高光催化剂的活性。
[1] Long Jinlin,Wang Shuchao,Chang Hongjin,et al. Bi2MoO6Anobelts for Crystal Facet-Enhanced Photocatalysis[J]. Small,2014,10(14):2791 - 2795.
[2] Zhou Lin,Wang Wenhong,Zhang Lisha. Ultrasonic-Assisted Synthesis of Visible-Light-Induced Bi2MO6(M = W,Mo) Photocatalysts[J]. J Mol Catal A:Chem,2007,268(1/2):195 - 200.
[3] 陈渊,杨家添,谢祖芳,等. 乙二胺四乙酸辅助水热法制备钼酸铋及其可见光催化活性[J]. 硅酸盐学报,2014,42(1):80 - 88.
[4] Xie Lijin,Ma Junfeng,Xu Gaojie. Preparation of a Novel Bi2MoO6Flake-Like Nanophotocatalyst by Molten Salt Method and Evaluation for Photocatalytic Decomposition of Rhodamine B[J]. Mater Chem Phys,2008,110(2/3):197 - 200.
[5] Amy D,Prashant V K. Semiconductor-Metal Nanocomposites Photoinduced Fusion and Photocatalysis of Gold-Capped TiO2(TiO2/Gold) Nanoparticles[J].J Phys Chem B,2001,105(5):960 - 966.
[6] 杨自嵘,彭杰庭,韩玉琦,等. 表面Cu2O纳米颗粒修饰高效促进γ-Bi2MoO6的可见光催化活性[J]. 物理化学学报,2013,29(4):812 - 820.
[7] Liotta L F,Gruttadauria M,Carlo G D. Heterogeneous Catalytic Degradation of Phenolic Substrates:Catalysts Activity[J]. J Hazard Mater,2009,162(2/3):588 -606.
[8] Cozzle P D,Comparelli R,Fanizza E,et al. Photocatalytic Synthesis of Silver Nanoparticles Stabilized by TiO2Nanorods:A Semiconductor/Metal Nanocomposite in Homogeneous Nonpolar Solution[J]. J Am Chem Soc,2004,126(12):3868 - 3879.
[9] Shibata H,Ohkubo T,Kohno H,et al. Preparation and Photocatalytic Activity of Titania Particulate Film with Mesostructured Silica as Binder[J]. J Photochem Photobiol A,2006,181(2/3):357 - 362.
[10] Chanapa K,Rachel C,Sylvain C,et al. A Comprehensive Scenario of the Crystal Growth of γ-Bi2MoO6Catalyst During Hydrothermal Synthesis[J]. Cryst Growth Des,2012,12(12):5994 - 6003.
[11] Murata Akiyo,Oka N,Nakamura S,et al. Visiblelight Active Photocatalytic WO3Films Loaded with Pt Nanoparticles Deposited by Sputtering[J]. J Nanosci Nanotechnol,2012,12(6):5082 - 5086.
[12] Ge Ming,Li Yafei,Liu Lu,et al. Bi2O3-Bi2WO6Composite Microspheres:Hydrothermal Synthesis and Photocatalytic Performances[J]. J Phys Chem C,2011,115(13):5220 - 5225.
[13] Li Chunxiang,Zhang Di,Jiang Zhaohua,et al. Mo-Doped Titania Films:Preparation,Characterization and Application for Splitting Water[J]. New J Chem,2011,35(2):423 - 429.
[14] Jin Tao,Diao Peng,Wu Qingyong,et al. WO3Nanoneedles/α-Fe2O3/Cobalt Phosphate Composite Photoanode for Efficient Photoelectrochemical Water Splitting[J]. Appl Catal B:Environ,2014,148/149:304 - 310.
[15] Xu Yong,Schoonen M A A. The Absolute Energy Positions of Conduction and Valence Bands of Selected Semiconducting Minerals[J]. Amer Mineral,2000,85(3/4):543 - 556.
[16] Yang Zhouyong,Ni Xiuyuan. Photovoltaic Hybrid Films with Polythiophene Growing on Monoclinic WO3Semiconductor Substrates[J]. Langmuir,2012,28 (10):4829 - 4834.
(编辑 祖国红)
Preparation of WO3/γ-Bi2MoO6Heterojunction and Its Photocatalytic Activity
Zuo Guangling,Ye Hongyong,Li Rulin
(School of Biological and chemical Engineering,Nanyang Institute of Technology,Nanyang Henan 473004,China)
The composite visible-light responsive photocatalyst,WO3/γ-Bi2MoO6heterojunction,was prepard by microwave solvothermal technique and impregnation method,and characterized by XRD,SEM,XPS and UV-Vis spectrophotometry. Its photocatalytic activity was investigated using methyl orange as target degradation material. The characterization results show that:WO3disperses on the surface of γ-Bi2MoO6crystal,instead of into the crystal lattice;Compared with WO3and γ-Bi2MoO6,both of UV- and Vis- absorption intensities of WO3/γ-Bi2MoO6are improved,the spectrum migrates toward red and the band gap is narrowed;The p-n type heterojunction formed by WO3and γ-Bi2MoO6can effectively promote the separation of photo-induced electron-hole pair and increase the visible-light photocatalytic activity. The experimental results show that:The photocatalytic activity of WO3/γ-Bi2MoO6is much better than those of WO3and γ-Bi2MoO6;When the initial mass concentration of the methyl orange solution is 10 mg/L,the dosage of WO3(1.0%)/γ-Bi2MoO6is 1 g/L and the reaction time is 3 h,the degradation rates of methyl orange and TOC are the highest(97.48% and 92.0% respectively).
tungsten oxide;γ-bismuth molybdate;heterojunction;composite photocatalyst;methyl orange
TQ135.1
A
1006 - 1878(2015)03 - 0312 - 06
2015 - 01 - 30;
2015 - 02 - 13。
左广玲(1979—),女,河南省南阳市人,硕士,讲师,电话 18237762610,电邮 zuoguangling2009@163.com。
河南省科技厅重点科技攻关项目(142102210026)。
