新疆北疆猪伪狂犬病毒野毒的PCR检测
2015-04-10窦立静齐向涛
窦立静,齐向涛
(1.新疆石河子市兽医卫生检疫所,新疆 石河子 832003;2.石河子大学动物科技学院 新疆 石河子 832003)
新疆北疆猪伪狂犬病毒野毒的PCR检测
窦立静1,齐向涛2
(1.新疆石河子市兽医卫生检疫所,新疆 石河子 832003;2.石河子大学动物科技学院 新疆 石河子 832003)
根据猪伪狂犬病毒(PrV)非必需糖蛋白gE基因特异引物,建立了针对PrV野毒的PCR检测方法。利用该方法对采自北疆地区部分规模化猪场的92份疑似病料进行了检测,PrV检出率为40.2%(37/92),表明该检测方法敏感性、特异性较高,最低病毒检出量约为0.25pg,可用于PrV野毒感染的快速诊断和流行病学调查。对阳性病料PrV gE基因的特异性序列进行对比分析发现有15个病料发生变异,经DNAMAN分析其同源性高达98.3%,初步判断这些野毒株仍属于同一个基因型。实验结果为了解新疆北疆地区猪伪狂犬病病毒的流行情况提供了理论依据。
伪狂犬病毒;PCR;gE基因;猪
伪狂犬病是家畜和野生动物感染伪狂犬病毒(Pseudorabies virus,PrV)后引发的的一种以发热、奇痒(猪除外)和脑脊髓炎为特征的急性传染病[1]。该病对养猪业的危害十分严重,在猪群多呈爆发性流行,对妊娠母猪、初生仔猪、育肥猪和种猪均造成严重伤害[4,5]。该病目前已成为我国集约化猪场母猪繁殖障碍、仔猪死亡率高的主要病因之一[4,5],严重影响了生产和良种繁育,给养猪业造成巨大的经济损失。但是由于PrV存在潜伏感染和不定期散毒等特点,处于PrV潜伏感染期的猪没有临床表现,但可终身带毒并排毒[2,3],给该病的有效防治带来一定困难,因此加强对PrV潜伏感染猪的筛查至关重要[6]。
gE基因是PrV的主要毒力基因,同时也是PrV体外感染和复制的非必需糖蛋白基因[1,7]。研究发现gE基因的缺失能够降低病毒的嗜神经毒性,但不影响免疫原性,是研制和开发PrV基因缺失疫苗的理想靶基因。目前,gE基因缺失弱毒苗的免疫接种已成为伪狂犬病有效防控的重要手段,英国、丹麦、荷兰、比利时和美国等欧美等发达国家通过使用该疫苗并结合相应的监测技术和管理措施,已基本实现了猪伪狂犬病的净化[8]。我国自上世纪70年代中期开始广泛使用gE基因缺失弱毒疫苗,有效减少了伪狂犬病给养猪业带来的经济损失,但该疫苗的使用也给PrV的野毒监测带来一定干扰,迫切需要建立一套敏感特异的能够鉴别野毒和疫苗株的诊断方法,以保证及时发现和减少PrV的潜伏感染[9]。
通过对1200多个伪狂犬病野毒株的研究发现,gE基因普遍存在于这些野毒株中并稳定表达,所以gE基因也是鉴别和诊断伪狂犬病毒野毒株和疫苗株的理想基因。目前国内外已经建立了针对gE基因的PCR和核酸探针等分子诊断方法[10]。本文基于gE基因序列特异引物,建立了针对PrV野毒的PCR检测方法,并对北疆地区部分规模化猪场的伪狂犬病疑似病料进行了检测,实现了PrV野毒感染的快速鉴别诊断;在此基础上对阳性病料的gE基因序列进行了测序分析,为了解目前流行于北疆地区的伪狂犬病毒基因型,有效预防和控制猪伪狂犬病流行提供了科学依据。
1 材料与方法
1.1 材料
1.1.1 实验材料
分别采自新疆石河子(21份)、乌鲁木齐(17份)、哈密(15份)、克拉玛依(15份)、奎屯(12份)和昌吉(12份)等北疆地区规模化猪场疑似猪伪狂犬病样组织共96份。猪伪狂犬病毒(PrV)、猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)、猪细小病毒(PPV)阳性病料由石河子大学动物科技学院预防兽医实验室提供。
1.1.2 主要试剂
组织基因组DNA提取试剂盒购自上海捷瑞生物技术有限公司;反转录试剂盒、TRIZOL、PGEM-T Easy Vector购自Promega公司;DNA凝胶回收试剂盒、质粒小提试剂盒、Taq DNA聚合酶、10×PCR Buffer、dNTPs、100 bp Ladder Marker购自天根生物公司。
1.2 方法
1.2.1 引物的设计(见表1)
猪伪狂犬病毒gE基因序列特异引物参考文献[12]设计合成。根据GenBank公布的猪瘟病毒(CSFV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪圆环病毒2型(PCV2)和猪细小病毒(PPV)基因序列,利用Primer 5.0设计特异性引物并由上海生工合成。

表1 引物序列
1.2.2 病毒DNA和cDNA模板的制备
病毒基因组DNA提取:利用组织基因组DNA提取试剂盒分别提取猪伪狂犬病毒、猪圆环病毒2型、猪细小病毒病料DNA,用微量分光光度计(NanoDrop 2000)测定DNA浓度。
病毒总RNA提取及cDNA合成:利用TRIZOL法分别提取猪瘟病毒、猪繁殖与呼吸综合征病毒病料RNA,通过1%甲醛变性琼脂糖凝胶电泳检测其完整性。用微量分光光度计(NanoDrop 2000)测定总RNA的OD260和OD280值,计算OD260/OD280比值以鉴定其纯度,并进行浓度测算。利用Promega反转录试剂盒分别合成cDNA第一链。
1.2.3 猪伪狂犬病病毒PCR扩增条件优化
在PCR反应体系中,选取DNA模板浓度和引物浓度为变化常量,其他因素不变进行体系的优化。PCR反应条件的优化主要是通过梯度PCR筛选最适退火温度。
1.2.4 PCR扩增及目的条带的回收测序
PCR产物经2%琼脂糖凝胶电泳检测合格后,切胶回收,通过连接、转化,克隆入pMD18-T载体。通过菌落PCR检测,挑选阳性重组质粒送交送交北京六合华大基因公司测序,并将测序结果进行分析比对。
1.2.5 PCR敏感性测定
测定所提取病料DNA的含量,进行10-1~10-9的10倍系列稀释,在扩增条件和扩增体系不变的情况下,分别以不同稀释度的基因组DNA为模板进行PCR扩增。通过琼脂糖凝胶电泳检测PCR产物的检出情况。
1.2.6 PCR特异性测定
利用PCV2、PPV、PRRSV和CSFV特异引物,分别以PCV2、PPV阳性病料基因组DNA和PRRSV、CSFV阳性病料的cDNA为模板,进行PCR扩增,验证模板DNA特异性。在此基础上,利用设计的PrV gE基因引物分别对PrV、PCV2、PPV阳性病料的DNA和PRRSV、CSFV阳性病料的cDNA进行PCR扩增,检测引物的特异性。
2 结 果
2.1 猪伪狂犬病毒PCR扩增条件优化
经PCR反应体系和反应条件的摸索和琼脂糖凝胶电泳检测,确定最适反应体系为:DNA模板2 μL,10×PCR buffer 2.5 μL,上下游引物(10 μM)各1 μl,Taq DNA聚合酶(2.5 U/μL)1 μL,灭菌蒸馏水补充至25 μL。最佳反应条件为:95℃预变性5 min;94℃30 s,61℃40 s,72℃30 s,35个循环;72℃延伸10 min。PCR扩增得到一条大小为298 bp(图1)的特异性条带,与预期大小相符。

图1 猪伪狂犬病毒gE基因片段的PCR结果
2.2 PCR检测的敏感性
分别取不同稀释度的PrV DNA 2 uL,按2.1所述最适反应体系和反应条件进行PCR扩增,结果显示,以10-1~10-9稀释的核酸产物作为模板进行PCR,均能扩增出目的条带(298 bp),但亮度随着稀释倍数的增加而递减。经测算,gE基因的DNA最低检出量为0.25 pg(图2)。
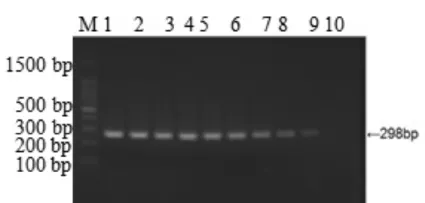
图2 猪伪狂犬病毒gE基因PCR的敏感性检测
2.3 PCR检测的特异性
使用PCV2、PPV、PRRSV和CSFV基因特异引物分别对PCV2、PPV感染病料DNA和PRRSV、CSFV感染病料cDNA进行PCR和测序,结果分别扩增出与预期一致的特异性条带 (图3),其大小分别为424bp、250bp、460bp和325bp,表明这些模板具有特异性。随后,利用PrV gE基因特异引物分别对PrV、PCV2、PPV阳性病料DNA和PRRSV、CSFV阳性病料的cDNA进行PCR,电泳结果表明除PrV阳性病料DNA中扩增出特异条带外(图4),其他均无条带,引物特异性强。

图3 PCV2、PPV的DNA和PRRSV、CSF扩增

图4 PrV、PCV2、PPV的DNA和PRRSV、CSF引物特异性检验
2.4 92份疑似猪伪狂犬病样PCR扩增
利用猪伪狂犬病毒gE基因特异引物对92份疑似猪伪狂犬病样进行PCR检测,结果显示37份为阳性的病料,病料的阳性率分别为40.2%(图5)。

图5 疑似猪伪狂犬病样的PCR检测
2.5 测序结果与分析
将37份PCR检测阳性病样的gE序列的测序结果与NCBI登陆的PrV gE基因序列进行对比,发现有15份病样序列存在碱基突变,用DNAMAN软件对这15个突变序列进行同源性比对,同源性高达98.3%(图6),说明从这些来自北疆不同地区病料中检测到的PrV仍属于一个基因型。
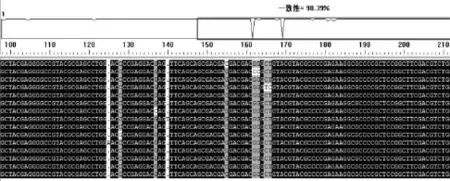
图6 基因序列对比
3 讨 论
猪伪狂犬在我国近年来感染趋势日益严重,该病在我国自1947年初次报道以来,在全国常有散发性的爆发,给我国养猪业带来了很大的危害,有的地区出现了猪伪狂犬病毒的变异,给该病的防控带来了很大的威胁。伪狂犬病病毒的毒力是多基因控制的,目前已经发现的PrV糖蛋白有gM、gH、gE、gK、gL、gl、gC、gB、gD、gG和gN共11种[11],不同的蛋白在病毒侵染过程中扮演了不同的角色,其中对病毒增殖来说非必需的糖蛋白有gM、gE、gl、gC和gG蛋白。 gE基因是PrV的主要毒力基因,对PrV在神经系统的侵袭和传播起重要作用,其编码的蛋白是病毒复制非必需糖蛋白[7]。由于gE基因在野毒株中能稳定表达,其本身变异性不大,不同毒株的gE基因同源性很好,同时目前使用的基因缺失苗中基本不含该基因,因此普遍将gE基因作为PrV野毒鉴别诊断的标记基因。本实验基于gE基因的PCR方法,用于伪狂犬病野毒的诊断经临床使用,效果较好。
PCR扩增的特异性与引物密切相关,通常影响扩增效率和目的条带的扩增。本研究以gE基因的保守序列设计特异性引物,对PCR条件进行优化,通过对北疆地区92份疑似病料组织基因组DNA进行扩增,得到37份阳性病料,同时对PCV2、PPV、PRRSV、CSF进行PCR扩增,结果均为阴性。证明了引物的特异性,同时保证了PCR扩增猪伪狂犬病病毒的可靠性。敏感性高,特异性好、快速简便的优点为PCR检测技术在病毒疾病的诊断奠定了基础。在 PrV模板 DNA的制备过程中,传统的核酸提取方法,操作复杂、周期较长,本试验应用组织基因DNA提取试剂盒制备的PrV模板DNA,扩增出预期298bp特异性片段。而且在进行敏感性测定时,PCR的最低病毒检出量约为0.25 pg。
[1]殷震,刘景华.动物病毒学[M].北京:科学出版社,1997:998-1909.
[2]Pasdeloup D1,Labetoulle M,Rixon FJ.Differing effects of herpes simplex virus 1 and pseudorabies virus infections on centrosomal function[J].J Virol,2013,87(12):7102-7112.
[3]杨睿,翟少钦,王孝友,等.重庆地区猪伪狂犬野毒株感染的流行病学调查[J].黑龙江畜牧兽医,2013,(1):96-97.
[4]陈磊,张普安,李岩,等.猪伪狂犬病研究进展[J].动物医学进展,2004,25(5):51-55.
[5]白文彬,于康震.动物传染病诊断学[M].北京:中国农业出版社,2002:407-414.
[6]Mahmoud HY,Suzuki K,Tsuji T,et al.Pseudorabies virus infection in wild boars in Japan[J].J Vet Med Sci,2011,73(11):1535-1537.
[7]王勤.猪伪狂犬病病毐gE基因的研究进展[J].畜牧与兽医,2002,34(10):42-43.
[8]马力,杨丽梅,徐倩倩,等.猪伪狂犬病病毒gE蛋白在野毒诊断中的应用进展[J].中国畜牧兽医,2014, 41(2):249-253.
[9]彭金美,安同庆,赵鸿远,等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35(1):1-4.
[10]吴斌,陈焕春,方六荣,等.聚合酶链式反应在猪伪狂犬病临床诊断中的应用[J].中国兽医科技,1998, 28(1):3-5.
[11]HELDWE1N E,KRUMMENACHER C.Entry of herpesviruses into mammalian cells[J].Cellular and molecular life sciences,2008,65(11):1653-68.
[12]蔺芳,尹双辉,尚佑军,等.多重PCR方法快速鉴别猪伪狂犬疫苗毒和野毒[J].安徽农业科学, 2009,37(13):5889-5891.
PCR Detection of Porcine Pseudorabies Virus Wild Strain in the Northern Xinjiang
DOU Li-jing,QI Xiang-tao
(1.Shihezi Veterinary Hygiene Quarantine Office,Shihezi 832003,China; 2.College of Animal Science&Technology,Shihezi University,Shihezi 832003,China.)
In present study,The PCR method focus on Pseudorabies Virus (PrV)wild virus was established based on the specific primers of PrV gE gene sequence.Using this method,92 suspected disease tissue collected from some large scale pig farms in the Northern Xinjiang were detected and the positive rate was 40.2% (37/92).The results show that this method is sensitive and specific,the lowest percentage of detection of PrV is 0.25pg,and can be used for rapid diagnosis and epidemiological investigation of PrV wild virus infection.Furtherly,the gE gene sequences of the PrV positive samples were blasted and analyzed,and the mutations were found in 15 samples.But the homology among the 15 sequences is higher up to 98.3%,which suggest that these wild virus strains still belong to a genetype.The study provide a theoretical basis to understand the epidemic status of the Porcine PrV in the Northern Xinjiang.
pseudorabies virus;PCR;gE gene;pig
S858.26
:A
:1003-6377(2015)05-0049-03
科技部公益性行业(农业)科研专项“边境地区动物疫病防控技术体系研究”(201103008)
窦立静(1975-),女,汉族,大学本科,兽医师,从事兽医临床检验工作。E-mail:dljww1170@sina.com
2015-07-13,
2015-07-20
