布鲁氏菌Ⅳ型分泌系统蛋白BMEI0580基因的原核表达
2015-04-10刘来珍孙志华史静雪陈创夫
刘来珍,孙志华,刘 娟,史静雪,陈创夫,张 辉
(石河子大学动物科技学院/动物疾病防控兵团重点实验室,新疆 石河子 832003)
布鲁氏菌Ⅳ型分泌系统蛋白BMEI0580基因的原核表达
刘来珍,孙志华,刘 娟,史静雪,陈创夫,张 辉*
(石河子大学动物科技学院/动物疾病防控兵团重点实验室,新疆 石河子 832003)
【目的】构建布鲁氏菌Ⅳ型分泌系统蛋白BMEI0580基因的原核表达载体,并进行免疫原性及其对人胚胎滋养层细胞(HPT-8)细胞因子表达量影响的分析。【方法】本研究从羊种布鲁氏菌(B.melitensis)标准株16M的基因组中克隆BMEI0580基因片段,亚克隆到pMD19-T载体中并测序,克隆至表达载体pET-28a,构建重组质粒 pET-28a-BMEI0580利用大肠杆菌进行表达,并进行Western-Blot检测,ELISA方法检测细胞因子的表达量。【结果】成功构建了pET-28a-BMEI0580原核表达载体,并在大肠杆菌中成功表达了BMEI0580基因,经过SDS-PAGE检测,重组蛋白的分子量大约是57kDa,Western-Blot检测其具有免疫特性。【结论】本实验成功表达了布鲁氏菌Ⅳ型分泌系统蛋白BMEI0580基因,为进一步研究其免疫性和保护性奠定了基础。
布鲁氏菌;BMEI0580基因;原核表达
布鲁氏菌病(Brucellosis)简称布病,是由一种古老细菌—布鲁氏菌(Brucella)引起的一种人畜共患动物源性传染病[1-2],患病牛、羊等牲畜是该病的主要传染源。该病主要引起怀孕母畜的流产和公畜睾丸的不对称性肿大,人的感染主要表现为波浪热和持续性感染等临床症状[3],严重影响畜牧业的发展和人类的健康[4]。目前即没有研制出能够有效预防和控制该病传播的疫苗,也没有能够治愈该病的有效方法。布鲁氏菌是一种革兰氏阴性胞内寄生菌,胞内寄生和复制是布鲁氏菌的主要毒力特征[5]。布鲁氏菌不仅可以通过消化道粘膜和呼吸道粘膜进入机体内,还可以通过皮肤、眼结膜等进入机体内,并被宿主体内的巨噬细胞吞噬[6],虽然布鲁氏菌可以在多数细胞内寄生,但是其仍具有宿主特异性,该菌主要寄生在巨噬细胞和胚胎滋养层细胞内[7]。有研究表明布鲁氏菌Ⅳ型分泌系统蛋白在布鲁氏菌侵入宿主细胞的过程中起着重要的作用,而且能够刺激机体产生较好的免疫学反应,因为其所特有的该特点,布鲁氏菌Ⅳ型分泌系统蛋白在该病的诊断和疫苗研制中有着重要的应用前景[8-9]。大多数的分泌蛋白在布鲁氏菌侵入宿主细胞的过程中都起着一定的作用,但是在布鲁氏菌侵染细胞过程中细菌蛋白是如何与细胞表面受体相互作用,又是如何帮助细菌侵入细胞内部的,其具体的分子作用机制目前还不清楚。本研究选取羊布鲁氏菌Ⅳ型分泌系统蛋白BMEI0580基因为研究对象,并构建其原核表达载体,通过Western-Blot检测其免疫特性,并通过ELISA方法检测其对三种细胞因子表达量的影响,以期为寻找布鲁氏菌的保护性抗原分子和布鲁氏菌的免疫诊断、基因疫苗和疾病防控等方面的研究提供理论依据。
1 材料与方法
1.1 细菌和细胞
羊种布鲁氏菌标准株16M、E.coli DH5α菌株、BL21(DE3)菌株、pET-28a载体菌株由石河子大学动物疾病防控兵团重点实验室保存;pMD19-T载体购自Promega公司;人胚胎滋养层细胞(HPT-8)由石河子大学动物科技学院/动物疾病防控兵团重点实验室保存。
1.2 主要试剂
羊布鲁氏菌阳性血清由石河子大学动物疾病防控兵团重点实验室保存;IPTG购自Merck公司;限制性内切酶(BamHⅠ/XhoⅠ)、DNA marker、T4连接酶购自大连宝生物工程有限公司;细菌质粒小提取试剂盒以及琼脂糖凝胶回收试剂盒从北京康为世纪生物科技有限责任公司购买;HRP标记的兔抗羊IgG、蛋白Marker、BCA蛋白质定量试剂盒购自天根生化科技(北京)有限公司。
1.3 目的基因扩增
根据GeneBank中羊种布鲁氏菌标准株16M的序列设计引物,由北京六合华大基因有限公司合成,序列见表1。
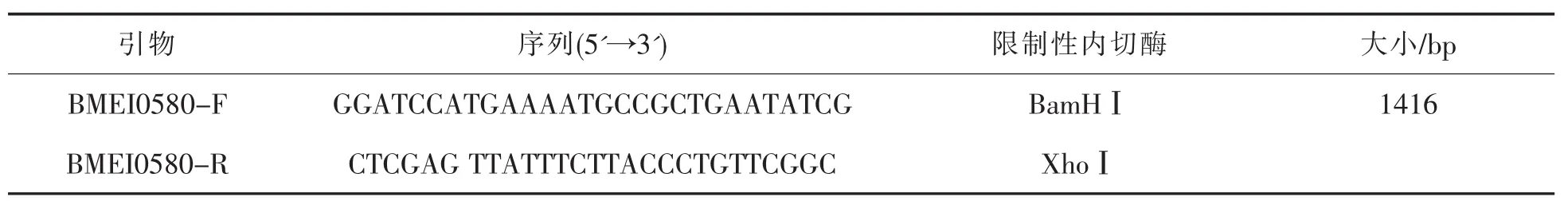
表1 PCR引物序列
以羊种布鲁氏菌标准株16 M的灭活菌液(100℃金属浴灭活1h)为模板,进行菌液PCR扩增,PCR的反应体系(20 μL)见表2,反应条件见表3。反应结束后,PCR产物4℃保存或直接进行1%琼脂糖凝胶电泳。回收目的基因片段,并将回收后的目的片段与pMD19-T载体在16℃水浴条件下进行连接,连接体系(10 μL)见表4,构建重组质粒pMD19-T-BMEI0580。重组质粒转化至E.coli DH5α感受态细胞,并在氨苄抗性的LB固体培养基上进行阳性筛选,通过菌液PCR和双酶切鉴定阳性克隆,并将提取的质粒送上海生物工程技术服务有限公司测序。

表2 PCR反应体系

表3 PCR反应条件

表4 连接体系
1.4 构建BMEI0580基因原核表达载体
将送公司测序正确的质粒pMD19-T-BMEI0580和pET-28a载体用限制性内切酶BamHⅠ和XhoⅠ进行双酶切,经琼脂糖凝胶回收试剂盒回收目的片段和酶切后的线性pET-28a载体。将目的片段和线性pET-28a载体在T4连接酶的作用下16℃水浴连接,连接产物转化至E.coli BL21(DE3)感受态细胞,经卡那抗性的LB固体培养基筛选阳性克隆,进行菌液PCR和酶切鉴定。
1.5 重组蛋白表达及表达条件的优化
将筛选出的阳性克隆菌在LB液体培养基中,37℃,200r/min摇床中培养过夜,将过夜菌按1∶100的比例接种至新鲜LB液体培养基中,37℃,200 r/min培养1 h左右使其OD值为0.4~0.6,在其他条件不变的情况下,按照不同的诱导剂浓度(终浓度为0.1 mM,0.2 mM,0.6 mM,1 mM)、诱导不同时间(0 h,4 h,6 h)后收集菌体。取1 mL菌液离心后,弃掉上清,并在离心管中加适量的经过稀释的1×SDS蛋白上样缓冲液,并在振荡器上震荡使菌体和蛋白上样液充分混匀,在金属加热器上100℃加热 10 min,取20 μL样品进行15%SDS蛋白电泳。观察电泳结果。筛选目的基因的最佳表达条件,并以最佳的诱导表达条件进行大量诱导表达,采用AKTA蛋白纯化系统纯化后进行SDS-PAGE电泳鉴定。
1.6 重组蛋白的Western-Blot检测
筛选出最佳表达条件后,以最佳诱导条件诱导重组蛋白表达,并对该蛋白进行纯化,经SDS-PAGE后,将蛋白转移到NC膜上,以200 mA的电流转膜1h。将膜放入预先用 TBST缓冲液洗涤后的杂交瓶中,37℃封闭1 h,用TBST缓冲液洗涤NC膜3次,每次10 min。加入1∶200比例稀释的经石河子大学动物疾病防控兵团重点实验室鉴定的羊种布鲁氏菌阳性血清,4℃过夜孵育,用TBST缓冲液洗涤NC膜3次,每次10 min,后加入1∶5000比例稀释的辣根过氧化氢酶标记的兔抗羊I gG,37℃孵育1 h,TBST缓冲液洗涤3次,每次10 min。ECL显色后拍照。
1.7 细胞因子的检测
将储存在液氮中的HPT-8细胞取出,使其在37℃温水中迅速融化,并转移至预先加有3 mL含10%胎牛血清的DMEM培养液中,800 r/min离心5 min,弃上清,并用含10%胎牛血清的DMEM培养液在37℃含5%CO2的恒温培养箱中培养。待细胞长至约90%时,将细胞传至六孔板中继续培养。待细胞长至对数生长期时,更换细胞培养液,并加入已纯化的蛋白至终浓度60 ug/mL,作用24 h后取上清[10],用酶标仪测定细胞因子IL-1、IL-10和TNF-α的含量,并用SPSS软件进行方差分析处理,绘制图形,每组实验重复3次。
2 结 果
2.1 目的基因的扩增及酶切鉴定
NCBI上羊种布鲁氏菌标准株16M的BMEI0580基因片段大别为1416bp,PCR扩增产物经1%琼脂糖凝胶电泳分析,与预期的大小一致,如图1所示。用相应的限制性内切酶(BamHⅠ/XhoⅠ)进行双酶切后,用1%琼脂糖凝胶电泳进行检测。结果显示,得到大小与预期结果相符的基因条带,表明羊种布鲁氏菌Ⅳ型分泌系统蛋白BMEI0580基因已成功插入pET-28a表达载体中,如图2所示。
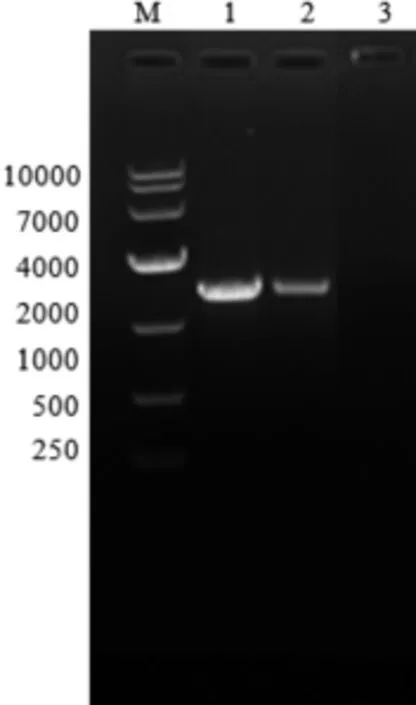
图1 PCR产物电泳图
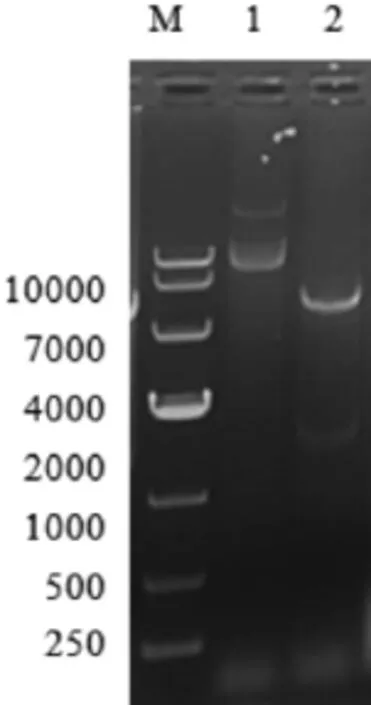
图2 重组质粒双酶切鉴定
2.2 重组蛋白表达条件的优化
为寻找重组蛋白表达的最佳诱导时间和诱导剂浓度,分别在诱导剂浓度不变的前提下,设置时间梯度筛选最佳诱导时间;在诱导时间不变的前体下,设置诱导剂浓度梯度,筛选最佳诱导剂浓度,进而筛选出最佳的诱导条件。结果显示诱导剂IPTG的终浓度为0.1 mmol/L诱导6 h时重组蛋白表达量最高,如图3所示。蛋白大量诱导表达后经AKTA蛋白纯化系统纯化,SDS-PAGE分析表明纯化后的蛋白条带清晰,杂带较少,表明纯化效果较好,结果如图4所示。
2.3 western-Blot检测
对诱导6 h后的重组蛋白纯化后进行Western-Blot检测,200 mA恒流电流下转膜1 h,观察结果,可见明显的阳性条带,结果表明,诱导得到的重组蛋白能被HRP标记的兔抗羊IgG抗体识别,且大小与pET-28分子质量加上目标分子蛋白质量的重组蛋白总分子质量相符,结果如图5所示。
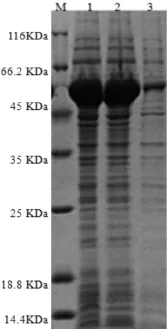
图3 重组蛋白在IPTG诱导不同时间的SDS-PAGE结果
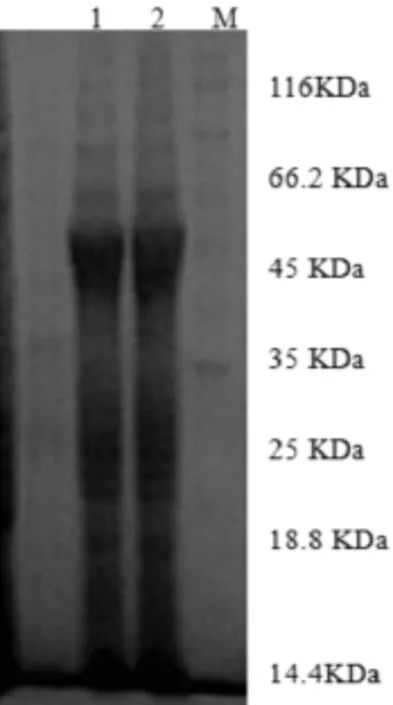
图4 SDS-PAGE电泳检测纯化后重组蛋白

图5 表达产物的Western blot分析
2.4 细胞因子的表达
细胞因子IL-1、IL-10和TNF-α的含量结果如图6所示,加入BMEI0580重组蛋白后IL-1、IL-10和TNF-α的表达与PBS对照组相比均无明显变化(P>0.05)。
3 讨 论
在我国,布鲁氏菌病被列为二类动物传染病,疫苗免疫预防和检疫净化是防控布鲁氏菌病的关键[4]。虽然目前国内现用的疫苗有一定的免疫效果,但是就其免疫效果来看,并未达到我们所期望的结果,而且,部分疫苗难以区分疫苗免疫和自然野毒株菌感染,为检疫净化带来诸多困难[11]。

图6 细胞因子分泌量
在布鲁氏菌侵染主要宿主细胞—巨噬细胞和胚胎滋养层细胞的过程中,粘附在细胞表面的绝大部分细菌被巨噬细胞和淋巴细胞杀死,然而进入细胞内的布鲁氏菌不仅可以逃过宿主细胞的免疫清除机制,而且还可以调控宿主细胞的自噬和抑制宿主细胞的凋亡,从而提高细菌在宿主细胞内的存活率,虽然目前有人正在研究布鲁氏菌侵染细胞过程中涉及到的各种作用机制,但是其具体的免疫逃逸机制目前仍不清楚。
自2002年羊种布鲁氏菌16M参考基因组测序完成以来,已经有300多株布鲁氏菌基因组完成了测序,其中有16株基因组已经完成了精细物理图谱的绘制[12]。虽然部分布鲁氏菌株的基因组序列测序已经完成,使我们在分子层面上对布鲁氏菌的致病机理有了进一步的认识,但是有关方面的研究相对较少。随着基因组学、转录组学和蛋白质组学等学科的产生和发展,我们对蛋白质的功能有了进一步的了解,但是大部分蛋白质的功能还不为人知。本文以布鲁氏菌的分泌蛋白BMEI0580为研究对象,研究其对细胞因子表达量的影响,为进一步解释布鲁氏菌蛋白质功能提供数据。
有研究表明IV型分泌系统(type IV secretion system,T4SS)在布鲁氏菌的侵入机体或细胞的过程中起着重要的作用。与细菌所具有的其他几种分泌系统相比,T4SS不但可以转运蛋白质,还可以转运一些核糖核蛋白复合物[13]。细菌的分泌系统能将部分蛋白转运到胞质外环境,从而有利于细菌的胞内生存。对于致病性细菌而言,分泌性的蛋白不仅能够在细菌粘附、定殖和侵入宿主细胞等过程中发挥重要的作用,而且能够调理宿主细胞的免疫活性,从而帮助细菌逃脱细胞的免疫杀伤作用[14]。在本研究中,布鲁氏菌重组蛋白感染细胞后,细胞因子IL-1、IL-10和TNF-α的表达量与PBS对照组相比都没有发生明显的变化。目前虽有关于T4SS、自噬和凋亡的研究,但是它们之间的相互关系还不清楚。本文选取布鲁氏菌的分泌蛋白BMEI0580,通过原核表达系统表达出了该蛋白并初步研究了免疫特性,测定了重组蛋白对三种细胞因子表达量的影响,为进一步研究IV型分泌系统蛋白在布鲁氏菌侵染细胞过程中的作用提供了参考。
参考文献:
[1]Qin Q M,Pei J,Ancona V,et al.RNAi screen of endoplasmic reticulum-associated host factors reveals a role for IRE1α in supporting Brucella replication[J].PLoS Pathol,2008,4(7):100-110.
[2]孙志华,刘良波,张豫,等.布鲁氏菌外膜蛋白VirB4在感染胚胎滋养层细胞中的作用分析[J].中国人兽共患病学报,2014,23(6):22-28.
[3]Boschiroli M L,Foulongne V,O’Callaghan D.Brucellosis:a worldwide zoonosis[J].Cur Opin Microbiol, 2001,4(1):58-64.
[4]宫晓伟,周继章.布鲁菌外膜蛋白OMP10表达及其抗原性的研究[J].动物医学进展,2009,30(12):25-29.
[5]王玉飞,曲勍,乔凤,等.羊布鲁氏菌的分泌蛋白质组分析[J].微生物学通报,2009,36(8):1150-1157.
[6]孙涛,赵宝,冉红志,等.布鲁氏菌病原学研究进展[J].家畜生态学报,2014,35(1):85-87.
[7]张沾,陈创夫,张辉,等.布鲁氏菌Ⅳ型分泌系统效应子VceC功能的初步研究[J].中国预防兽医学报, 2011,33(9):685-688.
[8]Cassataro J,Estein S M,Pasquevicn K A,et al.Vaccination with the recombinant Brucella outer membrance protein 31 or a derived 27-amino-acid synthetic peptide elicits a CD4+T helper 1 response that protects against Brucella melitensis infection[J].Infect Immun,2005,73(12):8079-8089.
[9]邢进,王金峰,赵宝华.布鲁疾病及其诊断方法研究进展[J].动物医学进展,2009,30(3):69-73.
[10]王震,张辉,张艳等.布鲁氏菌磷酸葡萄糖变位酶对胚胎滋养层细胞的致炎作用[J].微生物学报,2012,52(8):1040-1048.
[11]丁家波,毛开荣,程君生,等.布氏杆菌病疫苗的应用和研究现状[J].微生物学报,2006,46(5):856-859.
[12]Alice R.Wattam,Kelly P.Williams,Eric E.Snyder,Nalvo F,et al.Analysis of Ten Brucella Genomes Reveals Evidence for Horizontal Gene Transfer Despite a Preferred Intracellular Lifestyle[J],J Bacteriol. 2009,191(11):3569-3579.
[13]赵岩,李明,胡福泉.细菌的IV型分泌系统[J].生命化学,2011,31(1):128-133.
[14]刘倩宏.布鲁氏菌的IV型分泌系统[J].中国人兽共患病学报,2012,28(9):951-954.
Prokaryotic Expression of BrucellaⅣSecretion System Protein BMEI0580 Gene
LIU Lai-zheng,SUN Zhi-hua,LIU Juan,SHI Jing-xue,CHEN Chuang-fu,ZHANG Hui*
(Key Laboratory of Xinjiang Endemic and Ethnic Disease,College of Animal Science&Technology,Shihezi University,Shihezi 832003,China)
[Objective]To construct a prokaryotic expression vector for BrucellaⅣ secretion system protein BMEI0580 gene,analyze effect of protein to the expression of Embryonic trophoblast’s cytokines.[Methods] In this study,the BMEI0580 gene was obtained from Brucella melitensis 16M genome,connected to the vector of pMD19-T,cloned to expression vector pET-28a and constructed recombinant plasmids pET-28a-BMEI0580 to be expressed in E.coli BL21(DE3),and analysised by Western-Blot,then detected cytokines levels.[Results]It suggests that got recombinant plasmids pET-28a-BMEI0580,and it has expressed into protein.The SDS-PAGE showed a protein band with relative molecular weight of 57kDa,the Western-Blot test showed that it had immunological characteristics.[Conclusion]The study has successfully expressed the BrucellaⅣsecretion system protein BMEI0580 gene,it laid the foundation for further study its immunity and protection.
brucella;BMEI0580 gene;prokaryotic expression
S855.1+2
:A
:1003-6377(2015)05-0020-06
国家自然科学基金(31460650)
刘来珍(1988-),男,硕士研究生,研究方向为布鲁氏菌致病机制的研究,E-mail:liu859LSQC@163.com
张辉(1978-),男,副教授,从事传染病诊断与致病机制的研究,E-mail:allanzhh@yahoo.com
2015-06-18,
2015-06-29
