紫花苜蓿对镉胁迫的生理响应及积累特性
2015-04-08孙宁骁宋桂龙
孙宁骁,宋桂龙
(北京林业大学草坪研究所,北京100083)
近些年来,随着我国城市化、工业化发展及农用化学品的过量使用,环境污染、生态破坏日益严重,影响到人类的生存和健康,其中重金属元素对环境的污染和破坏作用尤为严重[1]。Cd 是生物非必需的元素,对环境危害极大,它不仅会导致土壤正常的功能失调、质量下降,而且会对植物产生毒害作用[2]。紫花苜蓿(Medicago sativa)是豆科多年生牧草,其适应性强,虽然富集能力比不上很多超富集植物,但是由于生物量大、生长快,其富集总量甚至比超富集植物还要高[3]。到目前为止,Cd 对不同植物形态、生理等方面的影响已有大量研究[4-6],但对紫花苜蓿在Cd 胁迫下生长发育的研究报道并不多。本研究分析紫花苜蓿对Cd 胁迫的反应及积累特性,探讨Cd 对紫花苜蓿的生理影响及紫花苜蓿在Cd 污染土壤修复中的应用潜力,旨在为紫花苜蓿在土壤修复中的应用提供参考。
1 材料与方法
1.1 供试材料及试验地概况
紫花苜蓿(品种“新疆大叶苜蓿”)种子来源于北京林业大学草地资源实验室,供试土壤为草炭土与农田的表层土壤3∶ 1 混合。经实验室测定,土壤性质pH 为6.79,全氮含量为3.65 g·kg-1,有机质含量为127 g·kg-1,有效磷含量为20.9 mg·kg-1,有效钾含量为262 mg·kg-1,土壤阳离子交换量为350 mmol·kg-1。盆栽试验于北京林业大学气象站后生物学院所属温室旁的院内进行。
1.2 试验设计
试验采用完全随机区组设计,对紫花苜蓿设置6 个Cd 处理水平,3 个重复,共计18 盆,每盆5 株。6 个处理的Cd 添加量从低到高依次为T0(0),T1(10 mg · kg-1),T2(25 mg · kg-1),T3(50 mg·kg-1),T4(100 mg · kg-1)和 T5(200 mg·kg-1)。试验用塑料盆钵,直径23 cm,高20 cm,每盆装土4 kg。重金属Cd 以CdCl2·2.5H2O(分析纯试剂)形式,按不同处理水平加入土壤,并与土壤充分混合均匀,制成不同Cd 浓度的土壤,土壤稳定一周后播种。播种后86 d 采集植物样品测定生理指标,播种后106 d 收获植株,处理后进行植物干重和重金属Cd 含量的测定。
1.3 测定方法
1.3.1 相对电导率 相对电导率的测定在陈建勋[7]的方法上稍有改动。称取紫花苜蓿叶片0.1 g,剪成1 cm 的小段,置于试管中,加入25 mL 蒸馏水;用封口膜封口,室温下摇床振荡24 h,用电导仪测电导率EL1;再次封口,牙签扎孔通气,沸水浴30 min,温度降到室温时测电导率EL2;将不加叶片的蒸馏水进行振荡、沸水浴,将降到室温时的电导率作为对照,记为EL0。根据公式(1)计算相对电导率:
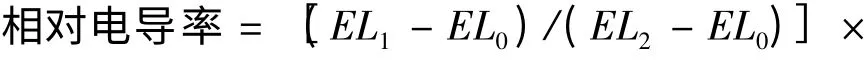
1.3.2 脯氨酸含量的测定 参考酸性茚三酮法测定[8],在此基础上稍有改动。称取紫花苜蓿叶片0.1 g,3%磺基水杨酸浸提,2.5%酸性茚三酮显色,最后用2.5 mL 甲苯萃取,在520 nm 下使用721 型分光光度计比色测定。
1.3.3 叶片叶绿素含量的测定 根据张志良[9]的方法,稍有改动。称紫花苜蓿叶片0.05 ~0.08 g,记下具体质量,剪碎后置于离心管中;加入8 mL 95%的乙醇,室温下避光静置48 h;于665 nm、649 nm 测定其吸光值;用95%乙醇调空白。根据公式计算:

叶绿素a 含量=Ca·V/W;
叶绿素b 含量=Cb·V/W;
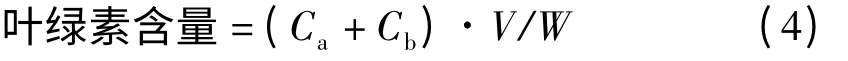
式中,Ca为叶绿素a 的浓度(mg·L-1);Cb为叶绿素b 的浓度(mg·L-1);A665和A649分别表示665 和649 nm 下的吸光值;V 为提取后的体积(L);W 为叶片鲜重(g)。
1.3.4 植物生物量的测定 收获植物,沿土面剪取地上部分,同时洗出根系,烘箱内105 ℃杀青15 min,并在80 ℃下烘至恒重,烘干后用天平称量植物各部分干重。
1.3.5 植物体内Cd 含量的测定 Cd 含量用电感耦合等离子体原子发射光谱仪(ICP-AES)测定。
转运系数=地上部植物中Cd 质量分数/地下部植物中Cd 质量分数[10];
耐性指数=重金属处理条件下植物干重/对照组植物干重[11];
积累量=植物地上或根系Cd 积累浓度×植物地上或根系生物量。
1.4 数据分析
运用SPSS 17.0 软件对所测数据统计分析,测定结果表示方法为平均值±标准误,对不同Cd 浓度处理下紫花苜蓿各指标进行单因素方差分析,并用Duncan 法对测定数据进行多重比较;制图采用Excel 2010。
2 结果与分析
2.1 不同Cd 浓度对紫花苜蓿生长影响
不同浓度Cd 胁迫下紫花苜蓿的生长状况如表1 所示,Cd 浓度达到200 mg·kg-1时,紫花苜蓿死亡。随着Cd 浓度的增加,紫花苜蓿株高呈现递减的趋势。当Cd 浓度在50 和100 mg·kg-1时,株高与对照差异显著(P <0.05),降幅分别达到21.96%和30.65%;紫花苜蓿地上部和地下部干重随Cd 浓度增加基本呈现先增大后减小的趋势,Cd 浓度为25 mg·kg-1时,地上部干重达到最大,且与对照差异显著,地下部干重在10 mg·kg-1时达到最大,但与对照差异不显著(P >0.05)。
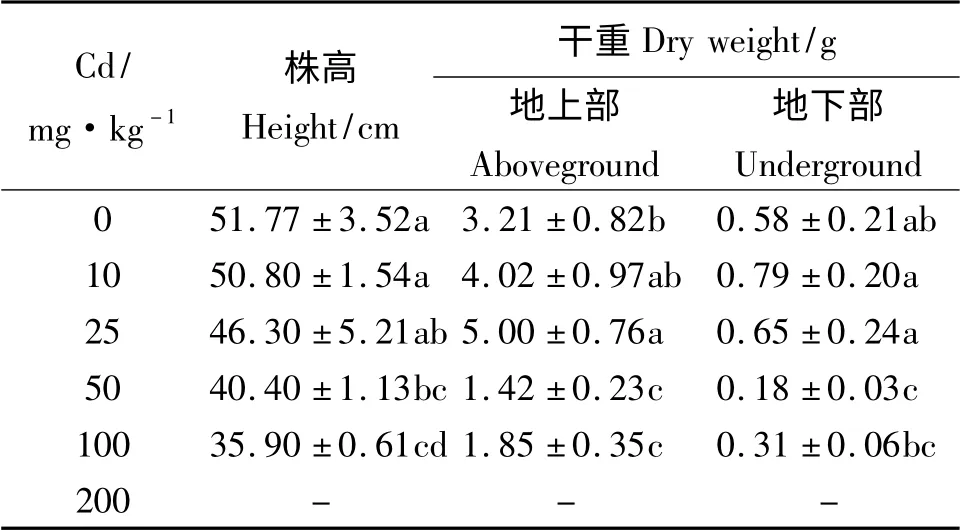
表1 紫花苜蓿的生长状况Table 1 Growth of Medicago sativa
2.2 不同Cd 浓度对紫花苜蓿生理影响
2.2.1 紫花苜蓿相对电导率 Cd 浓度达到200 mg·kg-1时,紫花苜蓿死亡。随Cd 浓度增加,叶片相对电导率呈现递增的趋势(图1)。Cd 浓度为10 mg·kg-1时,与对照差异不显著(P >0.05);Cd 浓度增加至25 和50 mg·kg-1时,叶片相对电导率比对照显著增加;当Cd 浓度达到100 mg·kg-1时,紫花苜蓿叶片相对电导率达到最大值,与其他处理差异显著,相比对照增幅达到30.02%。
2.2.2 紫花苜蓿脯氨酸含量 随Cd 浓度增加,叶片脯氨酸含量基本呈现先增大后减小的趋势(图2)。Cd 浓度达到25 mg·kg-1时,脯氨酸含量最高,与对照差异显著(P <0. 05),相比对照增幅达到34.74%;Cd浓度超过25 mg·kg-1后,脯氨酸含量逐渐下降;Cd 浓度达到100 mg·kg-1时,脯氨酸含量最低,且与其他处理差异显著,与对照相比降幅到达33.60%。这表明,低浓度Cd 胁迫使紫花苜蓿体内积累脯氨酸,维持正常代谢,高浓度Cd 胁迫使细胞机能丧失,不能积累脯氨酸以提高紫花苜蓿对Cd的抗性。
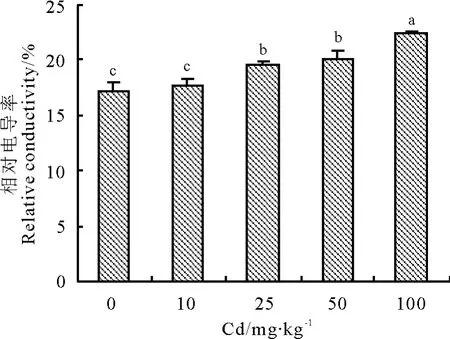
图1 Cd 胁迫对紫花苜蓿电导率的影响Fig.1 Effects of Cd stress on relative conductivity

图2 Cd 胁迫对紫花苜蓿脯氨酸的影响Fig.2 Effects of Cd stress on proline content
2.2.3 紫花苜蓿叶绿素含量 随Cd 浓度增加,叶绿素a、b 及总量都呈现递减趋势(表2)。Cd 浓度为10 mg·kg-1时,叶绿素含量略有下降,但与对照差异不显著(P >0. 05);Cd 浓度为25 和50 mg·kg-1时,叶绿素a 和总量与对照差异显著;Cd浓度为100 mg·kg-1时,叶绿素含量最低,与对照相比下降32.55%,且与其他处理差异显著;叶绿素a/b 值随Cd 浓度增加逐渐下降,但各个处理之间差异不显著。这表明,Cd 胁迫对紫花苜蓿细胞膜造成损害,导致叶绿素合成受到影响,从而使叶绿素含量急剧降低,最终将导致光合作用的下降。
2.3 不同Cd 浓度紫花苜蓿积累特性
Cd 的积累浓度随Cd 浓度增加而增加,且地下部Cd 积累浓度均大于地上部;Cd 浓度为10 mg·kg-1时转运系数最高,但与25 和50 mg·kg-1差异不显著(P >0.05);Cd 浓度为25 mg·kg-1时耐性指数最高,与其他处理差异显著;Cd 浓度为25 mg·kg-1紫花苜蓿地上部积累量最大,与对照间差异显著(P <0.05);Cd 浓度为100 mg·kg-1地下部积累量最大,与各处理之间差异显著(表3)。
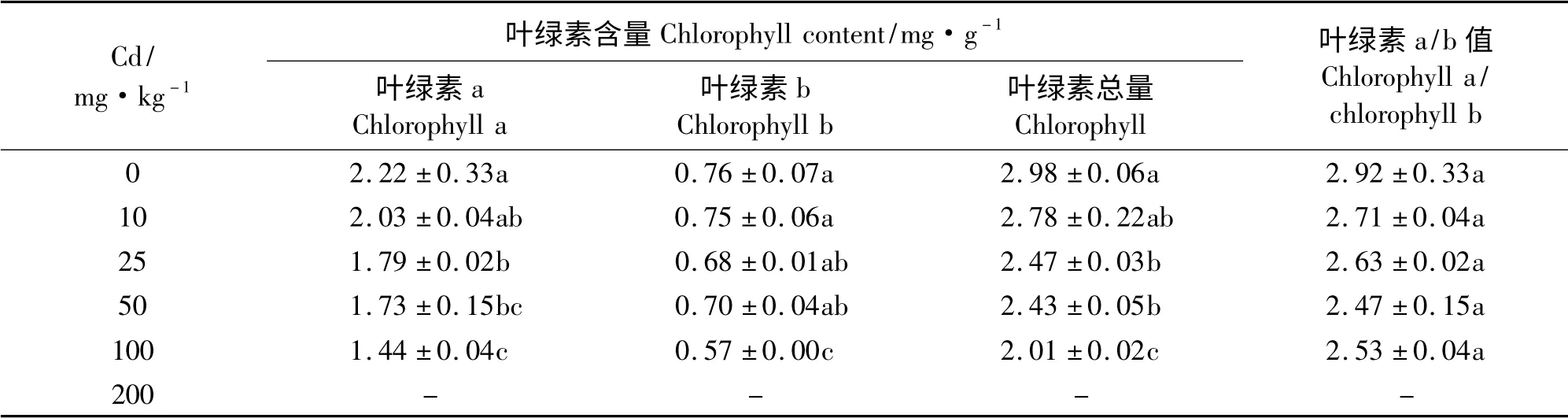
表2 Cd 胁迫对紫花苜蓿叶绿素的影响Table 2 Effects of Cd stress on chlorophyll content

表3 Cd 在紫花苜蓿体内积累和分布Table 3 Cd concentration and distributing in Medicago sativa
3 讨论与结论
Cd 是非营养元素,对植物有毒害作用,影响植物细胞代谢、生长发育并改变植物体的形态结构等[12-13]。在逆境条件下,当植物质膜受损后,细胞会启动响应机制,具体表现为电解质和某些小分子有机物大量渗漏[14]、渗透调节物质增加(如脯氨酸)[15]以及叶绿素含量降低[16]等情况。
本研究结果表明,代表质膜透性的相对电导率在Cd 胁迫条件下都出现显著(P <0.05)增加的情况,这与相关研究[2]的结果相同。脯氨酸可以降低膜脂过氧化程度[17],本研究中紫花苜蓿处于低浓度Cd 胁迫条件下,脯氨酸含量的增加可能增强紫花苜蓿的抗性,但当Cd 处理浓度过高时,紫花苜蓿细胞机能萎缩,甚至死亡,导致脯氨酸含量下降。本研究中紫花苜蓿叶绿素含量随Cd 浓度增加而降低,这与相关研究结果相同[18-19]。叶绿素a/b值可作为叶片衰老的指标[20],而试验紫花苜蓿叶绿素a/b 值均随Cd 浓度的增加而降低,说明高浓度的Cd 胁迫促进了紫花苜蓿叶片的衰老。
在实际修复中,紫花苜蓿对Cd 的去除效率主要取决于植株富集Cd 总量,即生物量与含Cd 浓度的乘积。因此,生物量与含Cd 浓度是两项非常关键的指标。试验中,低浓度Cd 胁迫可以增加紫花苜蓿地上部和地下部干重,这可能是由于紫花苜蓿体内某些激素抵消了Cd 胁迫,促进了植物生长。从地上部积累量来看,Cd 浓度为25 mg·kg-1时紫花苜蓿积累量最大,每盆为42.5 μg,若紫花苜蓿干草产量以10 000 kg·hm-2计[21],每公顷紫花苜蓿地上部可以富集85 g Cd,加以地下部富集量,在土壤Cd 浓度为25 mg·kg-1时,紫花苜蓿总共可带走超过100 g Cd。在实际土壤修复中,若加以刈割、外施激素等农艺措施,可能会进一步提高紫花苜蓿对Cd 污染土壤的修复效率。
综上所述,Cd 胁迫引起紫花苜蓿叶片相对电导率增大,叶绿素含量降低,使叶片受到伤害;低浓度Cd 胁迫使紫花苜蓿叶片脯氨酸含量增加,促进了紫花苜蓿的生长,提高了紫花苜蓿在Cd 胁迫下的耐性指数,增加了地上部Cd 的积累量。由此可知,Cd浓度在25 mg·kg-1以下时,紫花苜蓿的生理状况良好,在实际土壤修复中有应用意义。
[1] 王海慧,郇恒福,罗瑛,刘壮,高玲,黎春花,刘国道.土壤重金属污染及植物修复技术[J].中国农学通报,2009,25(11):210-214.
[2] 张呈祥,陈为峰.草地早熟禾对镉胁迫的反应及积累特性[J].中国草地学报,2012,34(4):61-67.
[3] 张杏锋,夏汉平,李志安,李海防,熊燕梅.牧草对重金属污染土壤的植物修复综述[J].生态学杂志,2009,28(8):1640-1646.
[4] 胡钟胜,章钢娅,王广志,招启柏,刘秀丽,曹显祖,曹志洪.改良剂对烟草吸收土壤中镉铅影响的研究[J]. 土壤学报,2006,43(2):233-239.
[5] Klang-Westin E,Eriksson J. Potential of Salix as phytoextractor for Cd on moderately contaminated soils[J]. Plant and Soil,2003,249(1):127-137.
[6] 曹会聪,王金达,任慧敏,赵卫,张学林.土壤镉暴露对玉米和大豆的生态毒性评估[J].环境科学学报,2007,27(2):298-303.
[7] 陈建勋.植物生理学实验指导[M].广州:华南理工大学出版社,2002:64-65.
[8] 李明,王根轩.干旱胁迫对甘草幼苗保护酶活性及脂质过氧化作用的影响[J].生态学报,2002,22(4):503-507.
[9] 张志良.植物生理学实验指导[M].北京:高等教育出版社,1990:67-70.
[10] Baker A J M,Reeves R D,Hajar A S M. Heavy metal accumulation and tolerance in British populations of the metallophyte Thlaspi caerulescens J. and C.Presl (Brassicaceae)[J].New Phytologist,1994,127(1):61-68.
[11] 格默尔.工业废弃地上植物定居[M].倪彭年,李玲英,译.北京科学技术出版社,1987.
[12] Lamsal B P,Koegel R G,Gunasekaran S.Some physicochemical and functional propertyes of alfalfa soluble leaf proteins[J].LWT-Food Science and Technology,2006,40(9):1520-1526.
[13] Aina R,Labra M,Fumagalli P,Vannini C,Marsoni M,Cucchi U,Bracale M,Sgorbati S,Citterio S.Thiol-peptide level and proteomic changes in response to cadmium toxicity in Oryza sativa L.roots[J].Environmental and Experimental Botany,2007,59(3):381-392.
[14] 马士芳,沈向群,洪雅婷,陈永浩,郭艳锋,李林.根肿病(Plasmodiophora brassicae)菌侵染对大白菜幼苗叶片膜脂过氧化的影响[J].中国农学通报,2014,30(1):128-132.
[15] 刘旻霞,马建祖.6 种植物在逆境胁迫下脯氨酸的累积特点研究[J].草业科学,2010,27(4):134-138.
[16] 许洁,曲东,周莉娜.硫营养对锌和干旱胁迫下玉米叶片中叶绿素含量的影响[J].干旱地区农业研究,2008,26(2):33-37.
[17] Smirnoff N.The role of active oxygen in the response of plants to water deficit and desiccation[J].New Phytologist,1993,125(1):27-58.
[18] 原海燕,郭智,张开明,黄苏珍,夏采意. 两种鸢尾属花卉幼苗对镉胁迫的生理抗性研究[J]. 江苏农业科学,2006,34(5):63-65.
[19] 袁祖丽,马新明,韩锦峰,李春明,吴葆存. 镉污染对烟草叶片超微结构及部分元素含量的影响[J]. 生态学报,2005,25(11):127-135.
[20] 张明生,谈锋.水分胁迫下甘薯叶绿素a/b 比值的变化及其与抗旱性的关系[J].种子,2001(4):23-25.
[21] 刘世亮,马闯,介晓磊,刘芳,崔海燕,华党领,胡华锋.喷施亚硒酸钠对紫花苜蓿干草产量和品质的影响[J].草业科学,2008,25(8):73-78.
