聚(3-羟基丁酸-co-4-羟基丁酸共聚酯)降解菌株的选育及其降解特性1)
2015-04-03张虹郭子琦侯春妹李凡陈珊大庆师范学院大庆163712东北师范大学
张虹郭子琦侯春妹李凡陈珊( 大庆师范学院,大庆,163712) ( 东北师范大学)
以石油为基础的化学合成塑料,如聚乙烯和聚氯乙烯等,已经广泛应用到人类生活的各个领域。这种传统的化学合成塑料难以降解,大量废弃物对环境造成了严重的“白色污染”[1]。近年来,来源于生物并具有生物可降解性的绿色塑料受到人们的广泛关注,其中聚(3-羟基丁酸酯-co-4-羟基丁酸酯)简称P3/4HB,为新生代(第四代)聚羟基烷酸酯类材料,被认为具有广阔的应用前景。
相对于传统的聚β-羟基丁酸酯(PHB),P3/4HB 有如下优点:结晶度低、熔点低、韧性好、便于加工等[2]。而且P3/4HB 的性能可以通过调节聚合物中4HB 的含量来进行调节,据报道当P3/4HB 聚合物中4HB 的含量小于5%,其性能接近聚丙烯(PP);调节4HB 含量至9%时,其性能与高密度乙烯(HDPE)相近;而调节4HB 含量至12%时,其性能与低密度的聚乙烯(LDPE)相似[3]。目前,对于P3/4HB 的研究多集中在其合成和改性上,对其胞外生物降解的报道较少,但完善的生物降解性能评价及可控降解模式的建立,对于聚酯材料的应用和产业化至关重要。本文对P3/4HB 降解菌株进行了筛选、鉴定,并测定了其对P3/4HB 的降解特性,为进一步研究P3/4HB 的降解机理及可控转化奠定了基础。
1 材料与方法
样品采集自吉林市化工厂的工业废水。
试剂:P3/4HB 购自天津国韵生物材料有限公司,分子生物学相关试剂购自Takara 生物公司,其它生化试剂均为国产分析纯。
基本培养基:P3/4HB 为0.15 g、MgSO4.7H2O 为0.5 g、NH4Cl 为1 g、CaCl2.2H2O 为0.005 g、KH2PO4为4.54 g、Na2HPO4.12H2O 为11.94 g[4]。
马铃薯培养基(PDA):马铃薯200 g、葡萄糖20 g、琼脂15 g。马铃薯去皮,切成块煮沸30 min,然后用纱布过滤,再加糖及琼脂,溶化后补水至1 000 mL。
察氏培养基:NaNO3为3 g、KH2PO4为1 g、Mg-SO4.7H2O 为0.5 g、KCl 为0.5 g、FeSO4为0.05 g、蔗糖为30 g、琼脂为15 g。
菌种的筛选:将工业废水水样5 mL 接入基本培养基中,置于30 ℃,150 r/min 的恒温震荡培养箱中进行富集。7 d 后取上清液100 μL 涂布于以P3/4HB 为唯一碳源的乳化平板上,置于培养箱中30 ℃培养,观察菌株的生长及透明圈形成情况,选取透明圈与菌落直径最大的菌株为目的菌株。
菌株形态学鉴定:采用点植培养法观察菌株的菌落形态和颜色,扦片法观察菌丝、分生孢子梗、分生孢子穗、孢子等形态特征。检索真菌鉴定手册,进行菌种的初步鉴定[5]。
系统发育学鉴定:CTAB 法提取菌株的基因组DNA 做为模板,ITS 通用引物为ITS1:5′-TCCGTAGGTGAACCTGCGG-3′和ITS4:5′-TCCTCCGCTTATTGATATGC-3′,进行PCR 反应扩增菌株基因组中保守的ITS 片段,扩增后的目的片段送生工生物公司测序,所得序列在NCBI 数据库进行同源性比对后,选取代表性菌株利用Mega4.1 构建系统发育树。
菌株对P3/4HB 膜的降解:将P3/4HB 粉末置于180 ℃热压机上预热2 min,热压约5 min 之后转移到冷压机上,室温自然冷却,获得厚度为0.1 cm的P3/4HB 薄膜。将P3/4HB 膜片(1.0 cm×1.0 cm×0.1 cm)70%酒精消毒并经紫外灯照射后加入到灭菌的不含P3/4HB 的基本培养基中,接入孢子悬液,28 ℃,150 r/min 振荡培养,间隔24 h 取样,计算薄膜失重率,并将薄膜喷金后进行扫描电子显微镜(SEM)观察。
菌株底物特异性分析:分别以P3/4HB、聚3-羟基丁酸酯(PHB)、聚羟基丁酸羟基戊酸酯(PHBV)、聚ε-己内酯(PCL)、聚乳酸(PLA)、聚丁二酸丁二醇酯(PBS)为底物制备乳化固体平板,将分生孢子点植到平板中央,28 ℃倒置培养5 d,观察菌落的直径大小及其透明圈的形成情况。
解聚酶活力的测定:将P3/4HB 粉末溶于氯仿中,所得溶液与十二烷基磺酸钠(SDS)混合,混合液经超声波破碎5 min,制得P3/4HB 乳化液,75 ℃加热90 min 除去氯仿,得到P3/4HB 悬浮液。取3 mL P3/4HB 悬浮液加入酶液1 mL,反应一定时间后,于650 nm 波长下测其吸收值(降低值)。一个酶活单位定义为每分钟引起光吸收降低0.001(A650 nm)单位所需的酶量[6]。每个测试样品设置3 个平行,以灭活酶液做空白对照。
粗酶液的制备:配制以P3/4HB 粉末为唯一碳源的液体培养基5 L,分装至三角瓶中,灭菌后接入分生孢子悬液,28 ℃150 r/min 振荡培养120 h,所得的发酵液经纱布过滤,4 ℃,12 000 r/min 离心制得粗酶液。
最适反应温度的测定:将P3/4HB 乳化液分别于10、20、30、40、50、60、70、80 ℃的水浴中保温10 min,然后分别加入同样经过预热的酶液,保温30 min,测定酶在不同温度下的酶活力。
温度稳定性的测定:将酶液分别置于4、10、20、30、40、50、60、70 ℃下保温1 h 后,在酶的最适反应温度下检测酶活力,绘制相对酶活力—温度曲线。
最适反应pH 测定:将粗酶液加入到不同pH 值的3 mL P3/4HB 乳化底物中(pH=4.0 ~6.0 为柠檬酸盐缓冲体系,pH=6.0~8.0 为磷酸盐缓冲体系,pH=8.0~9.0 为Tri-HCl 缓冲体系,pH=9.0 ~10.0 为甘氨酸—氢氧化钠缓冲体系),在酶的最适反应温度下测定其酶活力,绘制粗酶液的最适反应pH 曲线。
pH 稳定性的测定:将冻干的粗酶粉在不同pH的缓冲体系中4 ℃放置24 h 后,按照标准酶活测定方法在酶的最适反应温度和pH 条件下测定酶活力,绘制pH 稳定性曲线。
粗酶降解产物的测定:将发酵液装入透析袋中,在蒸馏水中4 ℃过夜,以除掉酶液中的无机盐。将透析后的酶液与P3/4HB 底物按体积比1 ∶3 的比例混合,60 ℃水浴保温30 min,以加热灭活的酶液做对照。产物离心后使用高效液相色谱四级杆串联质谱联用仪得到质谱图谱。
2 结果与分析
2.1 P3/4HB 降解菌株的筛选
将经过富集培养的污水样品稀释涂布在P3/4HB 乳化平板上,30 ℃培养7 d 后,可观察到形成明显透明圈的细菌及真菌菌落,将菌株纯化后重新点种于乳化平板上,挑取透明圈与菌落直径比值最大的一株真菌进行后续研究,命名为菌株DS0906(图1)。

图1 菌株在P3/4HB 乳化平板上生长且形成透明圈
2.2 菌种鉴定
该菌株在PDA 及察氏培养基上生长良好,菌落表面平坦,成同心环状,四周分布白色毛毡状菌丝,随培养时间的延长,菌丝的颜色由白转绿,最后变成褐色;菌丝体成丝状、有隔膜,分生孢子梗光滑,从壁厚而膨大的菌丝细胞上垂直生出;分生孢子头丰富,散生,分生孢子梗顶端稍膨大形成烧瓶状的顶囊,顶囊仅上半部产生孢子,分生孢子穗圆筒形,直径约40 μm,分生孢子椭圆形,绿色。结合菌株的形态特征,检索真菌鉴定手册可初步判断该菌种为曲霉属真菌[7]。

图2 菌株菌丝体及分生孢子的显微形态
菌株ITS 序列片段扩增后进行琼脂糖凝胶电泳,ITS 片段大小约为750 bp,对其进行核苷酸测序,得到的序列在NCBI 数据库中与Aspergillus fumigatus strain N29 的ITS 序列同源性高达99%,在系统进化上非常接近(图3),判定该菌属于烟曲霉(Aspergillus fumigatus)。
2.3 Aspergillus sp. DS0906 对P3/4HB 及其它聚酯的降解
菌株DS0906 对P3/4HB 具有高效降解能力,以乳化的P3/4HB 为碳源,培养过程中可观察到培养液逐渐变清;以P3/4HB 粉末为碳源,可观察到随着菌体的生长和产酶,培养5 d 后粉末完全消失;以P3/4HB 薄膜为碳源,由于固相材料比表面积的减少,降解速率降低,培养的前6 d,薄膜降解速率较慢,从第7 天开始,降解速率显著加快,14 d 后,薄膜被彻底降解成细小的碎片。利用扫描电子显微镜观察P3/4HB 膜降解前后的表面形态,结果显示,未降解的膜表面光滑;随着降解的进行,膜表面的孔洞增加,孔径增大,孔洞分布逐渐深入膜的内部,呈现由表及里的降解趋势(图4)。

图3 基于菌株ITS 序列的系统发育树

图4 P3/4HB 膜被菌株DS0906 降解前后的表面SEM 照片(×2000)
将少量的Aspergillus sp. DS0906 孢子分别接种于P3/4HB、PHB、PHBV、PBS、PCL、PLA 为唯一碳源的固体平板上,28 ℃倒置培养5 d,观察菌落的生长以及是否形成透明圈。表1 表明,菌株DS0906除了具有P3/4HB 降解能力外,还可以降解PHB、PHBV 和PBS;当以PLA 和PCL 为唯一碳源时,虽然菌株可以生长,但生长能力较弱且没有明显的透明圈生成,因此认为该菌株并不能有效降解高分子量的PLA 及PCL,其微弱生长可能是菌株对培养基中少量寡聚物利用的结果。

表1 Aspergillus sp. DS0906 在不同碳源培养基中的菌落直径及透明圈产生情况
2.4 菌株产P3/4HB 解聚酶的催化特性
2.4.1 温度对解聚酶的影响
按“粗酶液制备”方法制备粗酶液,测定酶的最适反应温度及温度稳定性,结果显示粗酶的最适反应温度为60 ℃,在50 ℃和70 ℃时酶活力也相对较高,达到最高酶活力的80%以上,当反应温度为80 ℃时,酶活力仍能达到最适反应温度下酶活力的78%,但在温度40 ℃以下时,解聚酶活力较低(图5A)。
温度稳定性的试验结果显示,PCL 解聚酶粗酶在50 ℃以下稳定性良好,可以保留80%以上的酶活力,但随着温度的升高,酶活力迅速下降,60 ℃保温1 h 后酶活力仅能残留30%左右,而当温度达到70℃时,保温1 h 后酶活几乎完全丧失(图5B)。
2.4.2 pH 对酶活力的影响
测定PCL 解聚酶粗酶在不同pH 条件下的酶活力,结果如图5C 所示,该酶在酸性和中性环境下具有较高的酶活力;而在碱性条件下,酶活力较低,最适反应pH 值为6.0(柠檬酸缓冲体系)。
将等量的粗酶粉分别加入不同pH(4.0 ~10.0)的缓冲液中,4 ℃保温24 h 后测定酶的残余活力,结果显示,在酸性和中性体系中,酶的稳定性较高,在pH=4.0~8.0 范围内粗酶的残余活力能够达到最高酶活力的70%以上,当pH 大于8.0 时,酶的稳定性迅速下降(图5D)。

图5 温度和pH 对粗酶液降解P3/4HB 活力的影响
2.4.3 粗酶降解P3/4HB 的产物测定
使用高效液相色谱四级杆串联质谱联用仪绘制粗酶液降解P3/4HB 产物的质谱图,结果如图6 所示,结合分子量计算结果,可以判断产物中存在羟基丁酸单体(peak 102.9),但并没有发现二聚体、三聚体及其它寡聚体,推测该P3/4HB 解聚酶是一种外切酶,每次以剪切链端一个羟基丁酸单元的模式发挥水解作用。
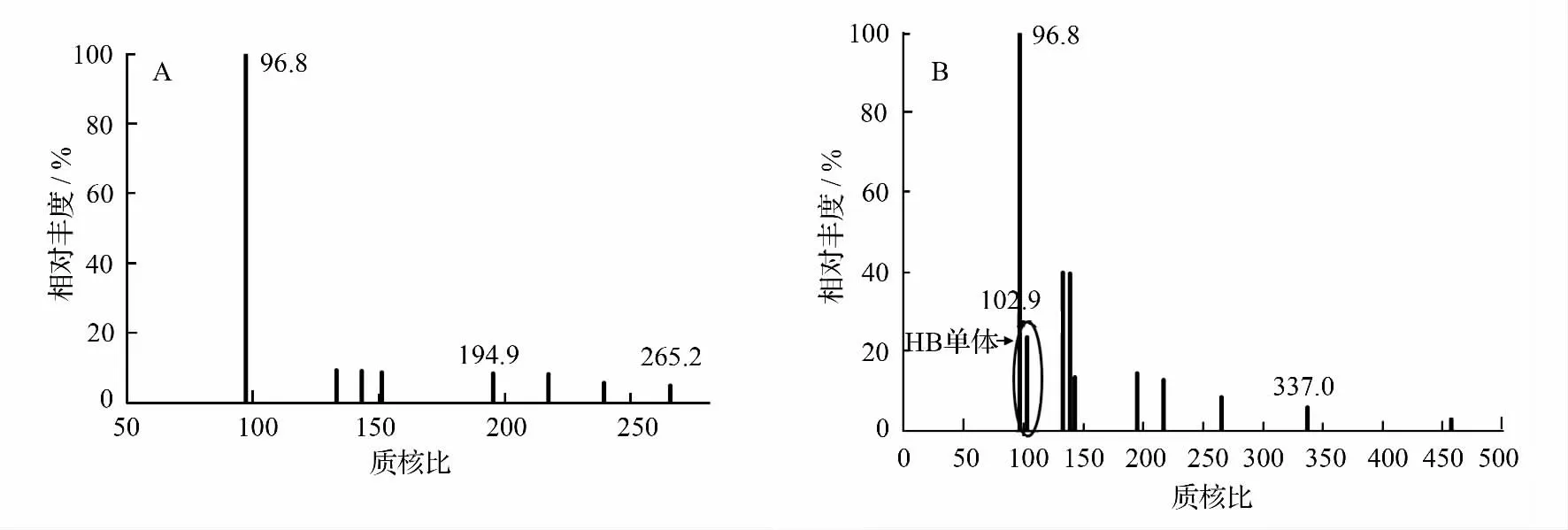
图6 粗酶液降解P3/4HB 产物的质谱图
3 结论与讨论
本研究采用富集培养、稀释涂布等方法从工业污水中筛选出一株可高效降解聚(3-羟基丁酸-co-4-羟基丁酸共聚酯)(P3/4HB)的真菌菌株,经形态学鉴定和系统发育学分析,判定该菌株属半知菌类,丛梗孢目,丛梗孢科,单胞亚科,曲霉族,曲霉属的烟曲霉,该菌株与Aspergillus fumigatus strain N29 的ITS 序列同源性高达99%,命名为Aspergillus sp.DS0906。
Aspergillus sp. DS0906 菌株对P3/4HB 及其它聚酯的降解特性研究表明,Aspergillus sp. DS0906 除高效降解聚(3-羟基丁酸-co-4-羟基丁酸共聚酯)外,还能够特异性降解高分子聚酯聚3-羟基丁酸酯、聚(3-羟基丁酸酯-co-4-羟基戊酸共聚酯)和聚丁二酸丁二醇酯,但是不能降解聚乳酸和聚ε-己内酯。菌株发酵粗酶液的最适反应温度为60 ℃,在10~50 ℃之间酶的温度稳定性较好,最适反应pH值为6.0,在pH=6.0~8.0 的范围内稳定性较高。
Aspergillus sp. DS0906 粗酶液降解P3/4HB 的产物为羟基丁酸单体,推测降解酶以每次剪切一个羟基丁酸单元的外切酶模式发挥降解作用;同时,这也表明该酶为一种外切酶,但不同的单体单元(3HB或者4HB)是否对酶的识别和催化具有影响作用还需要进一步的研究。
现阶段,对P3/4HB 生物降解的研究主要是利用生物堆肥或者利用PHB 解聚酶进行降解[8-9],而关于P3/4HB 降解菌株筛选的研究很少。因此,本文从工业废水中筛选出的高效降解P3/4HB 的真菌菌株,是P3/4HB 的降解机制研究的重要补充。为P3/4HB 解聚酶的分离纯化,以及该类降解酶与PHB 解聚酶结构和功能的比较,从而全面的阐明P3/4HB 的降解机制等工作做好准备。
[1] 杨惠娣,翁云,胡汉杰.中国生物降解塑料开发历史、现状和发展趋势[J].中国塑料,2005,19(3):3-11.
[2] 宋昭峥,赵密福.可降解塑料生产技术[J].精细石油化工进展,2005,6(3):23-20.
[3] Brandl H,Gross R A,Lenz R W. Ability of the phototrphic bacterium Rhodospirillum rubum to produce various poly (β-hydroxyalkanoates):potential source for biodegradable polyster[J]. International Journal of Biological Macromolecules,1989,11(1):49-55.
[4] Wang Y,Li F,Wang Z Y. Purification and properties of an extracellular polyhydrobutyrate depolymerase from Pseudomonas mendocina DSWY0601[J]. Chemical Research in Chinese Universities,2012,28(3):459-464.
[5] 陈珊.微生物学实验指导[M].北京:高等教育出版社,2011.
[6] 马晶,陈珊,何艳,等.DS9701 菌株的紫外诱变及PHB 解聚酶高产菌株的筛选[J].东北师大学报:自然科学版,2004,36(1):83-87.
[7] 魏景超.真菌鉴定手册[M].上海:上海科技出版社,1979.
[8] Weng Y X,Wang X L,Wang Y Z. Biodegradation behavior of PHAs with different chemical structures under controlled composting conditions[J]. Polymer Testing,2011,30(4):372-380.
[9] Zhang J Q,Kasuya Kenichi,Hikima Takaaki,et al. Mechanical properties,structure analysis enzymatic degradation of uniaxially cold-drawn films of poly [(R)-3-hydrobutyrate-co-4-hydrobutyrate][J]. Polymer Degradation and Stability,2011,96(12):2130-2138.
