改进的颗粒溶胶工艺制备高性能ZrO2-TiO2复合纳滤膜
2015-04-01陆亚伟陈献富闻娟娟邱鸣慧范益群
陆亚伟,陈献富,闻娟娟,邱鸣慧,范益群
(南京工业大学化工学院,材料化学工程国家重点实验室,国家特种分离膜工程技术研究中心,江苏 南京 210009)
引言
陶瓷纳滤膜因其在实际分离过程中具有耐高温、耐溶剂、耐腐蚀和机械强度高等优点,成为近年来纳滤膜领域的研究关注点[1]。目前,陶瓷纳滤膜的研究主要集中在Al2O3、SiO2、TiO2和ZrO2材料上,其中,ZrO2材料因其具有更高的机械强度、更好的热稳定性及化学稳定性而有着重要的开发与应用价值[2]。在 ZrO2材料中引入适量 TiO2有利于制备更小平均堆积孔孔径、更大比表面积的微孔材料,为高性能陶瓷纳滤膜的制备带来更多契机[3-4]。因此,ZrO2-TiO2复合膜材料的开发与研究对于丰富陶瓷纳滤膜材料种类、改善膜性能都具有积极的意义。
溶胶-凝胶法是大规模制备陶瓷纳滤膜的重要途径,具有制备过程简单易行、易于放大和制备参数可调控等优点,通常分为聚合溶胶路线和颗粒溶胶路线[5-6]。虽然采用聚合溶胶路线能更好地控制水解速率,易于制得小粒径溶胶,但是制备过程中有机溶剂的大量使用在一定程度上为溶胶大规模的工业化生产带来不便。因此,相比于聚合溶胶路线,采用水作为溶剂的颗粒溶胶路线,因其具有无毒、低挥发、低成本等优点,更适合规模化生产过程。而且随着小粒径颗粒溶胶制备技术的不断突破[7-9],颗粒溶胶路线被认为是未来更具竞争力的溶胶合成路线。
目前,文献中报道的 ZrO2-TiO2复合膜基本上采用聚合溶胶路线制备,多为无定形膜材料[3,10-12],由于水热稳定性的限制,常用于气体分离。而具有优良水热稳定性,用于液相体系分离的 ZrO2-TiO2复合膜鲜有报道[13]。本文采用改进的颗粒溶胶工艺制备出用于液相体系分离的ZrO2-TiO2复合纳滤膜,详细考察溶胶合成参数及热处理温度对膜材料性能的影响。
1 实 验
1.1 溶胶和粉体的制备
采用硝酸锆和钛酸四丁酯为前驱体,通过改进的颗粒溶胶工艺制备稳定的 ZrO2-TiO2复合溶胶。称取一定量的前驱体(Zr:Ti=4,摩尔比)和适量甘油,加入去离子水中进行水解反应,前驱体与水的摩尔比为1:555,水温为60℃。完全水解后加入适量络合剂(草酸)在恒温搅拌的条件下进行络合反应,1 h后即可得到一定浓度和粒径分布的ZrO2-TiO2复合溶胶,自然冷却至室温备用。随后取适量溶胶置于培养皿中,在110℃下干燥24 h后得到干凝胶,将干凝胶在 300℃、350℃、400℃、450℃、500℃和 550℃下进行煅烧,得到的粉体样品用于后续表征。
1.2 纳滤膜的制备
采用平均孔径为5 nm的管式(外径12 mm,内径8 mm,管长110 mm)α-Al2O3支撑膜为底膜。通过浸浆法[14],将ZrO2-TiO2溶胶在α-Al2O3底膜表面涂覆30 s后,经热处理,制得ZrO2-TiO2膜。热处理过程如下:先将湿膜在60℃、相对湿度60%条件下干燥10 h,然后转移至马弗炉进行烧结,烧结温度为 500℃,升温速率为 0.5℃·min-1,降温速率为1℃·min-1,保温时间为2 h。
1.3 溶胶、粉体和纳滤膜的表征
采用激光粒径分析仪(Zetasizer,Nano-ZS90,Malvern,UK)表征溶胶的粒径分布;采用旋转黏度仪(DV-II+,Brookfield,USA)表征溶胶体系的黏度;采用X射线衍射仪(X-ray Diffractometer,ARLX’TRA,Thermo Electron Corporation,USA)表征粉体的晶型结构;采用氮气吸附脱附仪(BET,TriStar II 3020,Micromeritics,USA)表征粉体的孔径和比表面积,孔径由NLDFT模型计算得到;采用热重/差热分析仪(TG/DSC,STA449C,Netzsch,Germany)表征粉体在升温过程中重量与热量的变化情况;采用场发射扫描电镜(FESEM,S4800,Hitach,Japan)表征膜层表面和断面的微观形貌;采用实验室自制的错流过滤测试装置进行膜管纯水通量、PEG截留和离子截留的测试实验;采用凝胶色谱(GPC,1515,Waters,USA)测定截留分子量。采用电感耦合等离子体发射光谱仪(ICP,Optima-7000 Dv,Perkin Elmer,USA)测定离子浓度。
2 结果与讨论
2.1 溶胶合成参数优化
水解温度是影响水解速率的重要因素,一般认为随着水解温度的升高,水解反应速率也更快[15]。溶胶粒径分布与水解温度之间的关系如图1(a)所示。从图中可以看出,当水解温度为50℃和80℃时,所得溶胶平均粒径较大,在5 nm左右。当水解温度为70℃和90℃时,虽然一部分溶胶粒径较小,但是粒径分布宽,且呈双峰分布,说明溶胶体系出现了一定程度的团聚。这一结果也与文献报道类似[16-17]。这是因为当温度较低时,水解反应速率过慢,水合离子向氢氧化离子转化的速率慢,大量的水合离子相互碰撞,容易造成一定的团聚;而当温度较高时,水解反应速率过快,大量氢氧化离子的不断碰撞造成了溶胶体系的部分团聚。当水解温度为60℃时,溶胶平均粒径小,粒径分布窄,可以认为是较合适的水解反应温度。

图1 水解反应温度与甘油添加量对溶胶粒径的影响Fig.1 Influence of hydrolysis temperature and glycerol additive amounts on sols’ particle size
考察了甘油添加量对溶胶粒径分布的影响,结果如图1(b)所示。从图中可以看出,添加甘油可以使得溶胶平均粒径变小,粒径分布变窄;当甘油与前驱体摩尔比为0.5时,平均粒径最小,随着甘油与前驱体摩尔比的增大或减小,溶胶粒径均有一定程度的增大。
考察了络合剂添加量对溶胶粒径的影响,结果如图2(a)所示,从图中可以看出,不添加络合剂时,溶胶出现了一定程度的团聚,有300 nm左右的大颗粒,说明加入络合剂后络合物的形成有利于溶胶体系的稳定。此外,络合剂添加量的多少对溶胶粒径也有影响,前驱体与络合剂的摩尔比为6时,溶胶平均粒径最小,随着络合剂添加量的增多或减少,溶胶粒径均有一定程度的增大。经过合成参数优化后制备得到的 ZrO2-TiO2颗粒溶胶外观澄清透明,溶胶粒径分布及稳定性如图2(b)所示。从图中可以看出,优化后的 ZrO2-TiO2颗粒溶胶的平均粒径约为3 nm,粒径分布呈单峰分布,且分布较窄。在一个月的考察时间内,ZrO2-TiO2颗粒溶胶的粒径保持在2.9~3.2 nm;黏度在1.28~1.31 mPa·s之间浮动。ZrO2-TiO2颗粒溶胶的粒径、黏度虽然都有一定程度的增大,但是变化幅度很小,由此可见,制备得到的ZrO2-TiO2颗粒溶胶稳定性较好。

图2 络合剂添加量对溶胶粒径的影响及优化后的溶胶性能Fig.2 Influence of complexing agent amounts on sols’ particle size and performance of optimized sols
改进的颗粒溶胶合成工艺确保了小粒径ZrO2-TiO2溶胶的成功制备,本实验采用的颗粒溶胶合成工艺如图3所示,推测溶胶的形成机理如下[18-19]:前驱体加入去离子水中后发生共水解反应,生成水合物沉淀。一方面,钛酸四丁酯与甘油富含的羟基能在很大程度上抑制前驱体的水解、缩聚反应速率,避免在溶胶形成阶段由于前驱体的过快水解、缩聚而导致大尺寸胶粒的生成。另一方面,硝酸锆水解后生成的硝酸会产生原位的自解胶作用,从而能够有效防止胶粒形成后的团聚。此外,在此自解胶过程中,添加的甘油小分子被胶粒的双电层结构吸附,形成的甘油吸附层不但能保护胶粒的双电层结构,减小由于胶粒之间碰撞产生的团聚,而且对于吸附的电荷也有一定的束缚作用,促进了胶粒结构的稳定。随后加入的草酸根离子与金属离子以二齿形式配位形成了更稳定的平面五元环螯合结构。
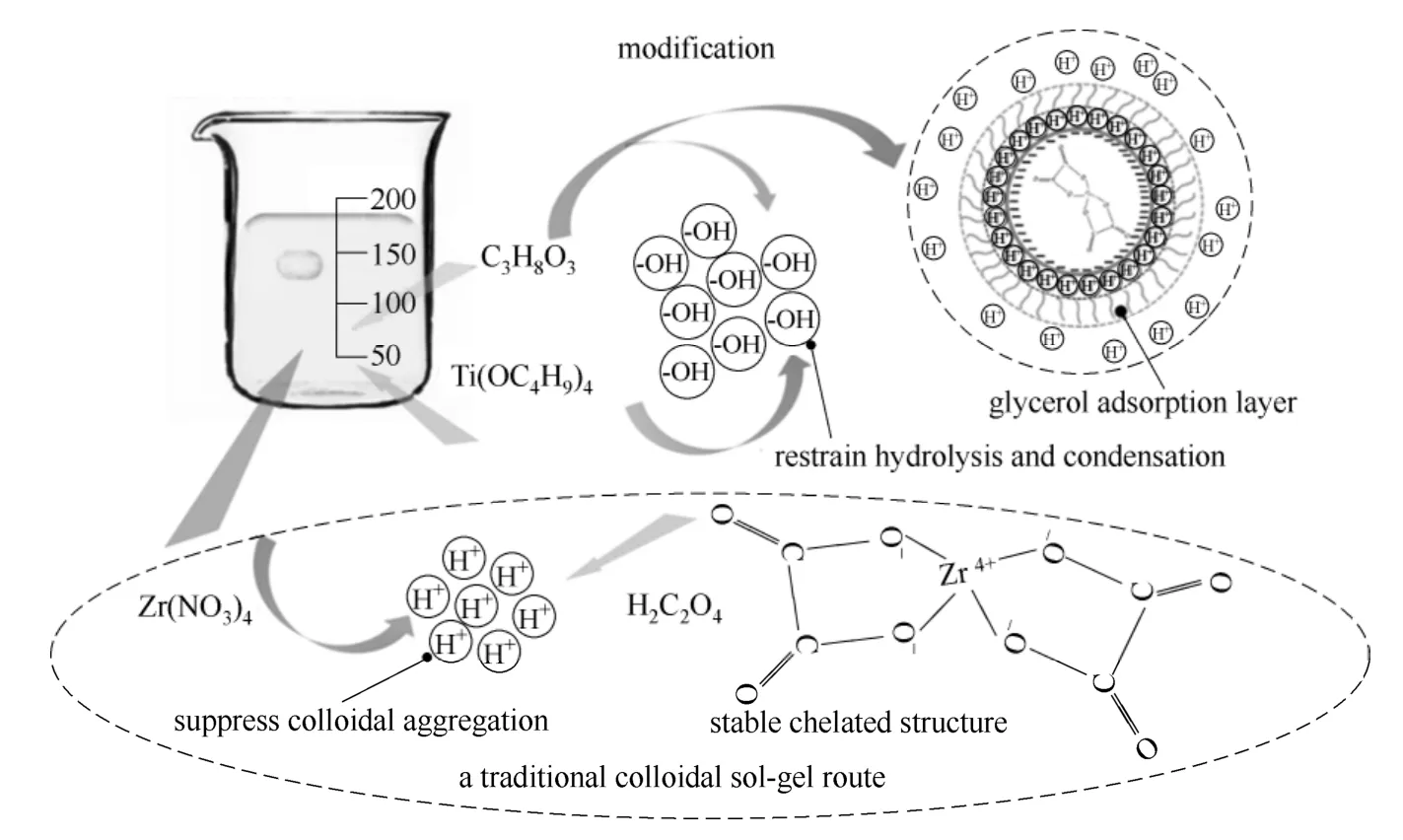
图3 改进的颗粒溶胶合成工艺Fig.3 Schematic diagram of modified colloidal sol-gel process
2.2 热处理温度对膜材料性能的影响
经过不同温度煅烧后ZrO2-TiO2粉体的XRD图谱如图 4(a)所示。从图 4(a)中可以看出,ZrO2-TiO2粉体在450℃以下都是无定形结构,而在500~550℃时呈现典型的四方相结构。TiO2的特征峰在ZrO2-TiO2粉体的XRD图谱中并没有观察到,这可能是由于两方面的原因:一方面,相比于ZrO2,TiO2含量较少,其特征峰被ZrO2主峰所掩盖;另一方面,TiO2的分布非常均匀,导致单位面积上TiO2的含量低于XRD设备检测的最低限值。此外,在300~550℃的煅烧温度范围内,ZrO2并未发生由四方相到单斜相的晶型转变,很大程度上避免烧结过程中膜层的开裂,这将有利于后续纳滤膜的制备。
经过不同温度煅烧后得到的 ZrO2-TiO2粉体的孔结构性能数据如图4(b)所示。从图中可以看出,随着煅烧温度的升高,ZrO2-TiO2粉体的比表面积减小,平均堆积孔孔径增大。在300~550℃的煅烧温度范围内,粉体的比表面积由45 m2·g-1减小到17 m2·g-1,平均堆积孔孔径由0.9 nm增大到2.8 nm。
500℃下ZrO2-TiO2粉体的氮气吸附脱附曲线和由NLDFT模型计算得到的孔径分布如图5(a)所示。从图中可以看出,粉体的孔径分布在1~3 nm之间,500℃下的氮气吸附脱附曲线没有滞后回环,属于Ⅰ型吸附脱附等温线[20],说明粉体具有典型的微孔结构。

图4 热处理温度对ZrO2-TiO2粉体晶型与孔结构的影响Fig.4 Influence of heat treatment temperature on crystal andporous structure of ZrO2-TiO2powders
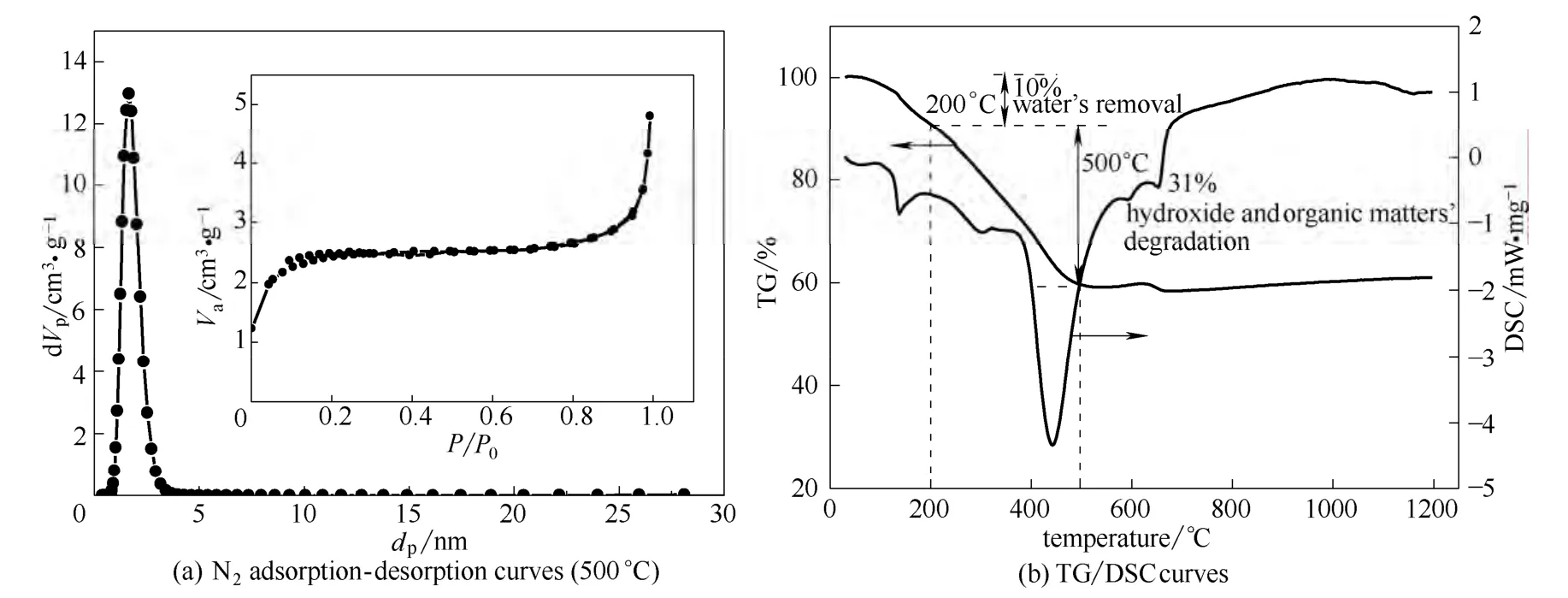
图5 ZrO2-TiO2粉体500℃下氮气吸附-脱附曲线及TG/DSC曲线Fig.5 N2adsorption-desorption curves (500℃) and TG/DSC curves of ZrO2-TiO2powders

图6 氧化铝底膜表面和断面微观形貌Fig.6 FESEM micrographs of alumina intermediate layers

图7 ZrO2-TiO2复合纳滤膜微观形貌Fig.7 FESEM micrographs of ZrO2-TiO2NF membranes
ZrO2-TiO2粉体在升温过程中的 TG/DSC曲线如图5(b)所示,整个过程以10℃·min-1的速率升温到1200℃,从图中可以看出,当温度低于200℃时,主要是自由水和结合水的脱除,失重率约为10%,这一过程的热量变化分别对应着90℃和140℃左右的吸热峰。随后,锆与钛的氢氧化物以及有机物开始分解,当温度升高至 450℃时基本分解完全,总失重率达到41%,在450℃左右较大的吸热峰与这一过程相吻合。值得注意的是,在600~700℃之间的热量变化可能是由于粉体从四方相向单斜相转变而引起的。结合上述 ZrO2-TiO2粉体的晶型和孔结构性能表征数据,选用500℃作为ZrO2-TiO2复合纳滤膜的烧成温度。
2.3 ZrO2-TiO2复合纳滤膜的表征
实验选用管式 α-Al2O3非对称支撑膜为底膜,膜层平均孔径为5 nm,其表面和断面微观形貌如图6所示。从图中可以看出,底膜表面完整无缺陷,厚度约为2 μm,与支撑层之间界面清晰,无内渗现象。采用浸浆法,控制涂膜时间为30 s,烧结温度为500℃,经过一次涂膜,制备得到ZrO2-TiO2复合纳滤膜,其表面和断面微观形貌如图7所示。图7(a)是膜层表面的低倍微观形貌图,从图中可以看到,膜层表面完整无缺陷且光滑平整,图7(b)是在未经喷金处理条件下获得的高倍 ZrO2-TiO2复合纳滤膜层表面微观形貌,可以看到,ZrO2-TiO2复合纳滤膜层由粒径在10 nm以下的颗粒堆积而成。图7(c)是其断面的微观形貌,从图中可以看出,分离层膜厚均匀,平均膜厚约为200 nm,顶层膜与底膜之间结合紧密,界面清晰,无内渗现象。

图8 ZrO2-TiO2膜的渗透和分离性能Fig.8 Permeance and separation performance of ZrO2-TiO2membranes
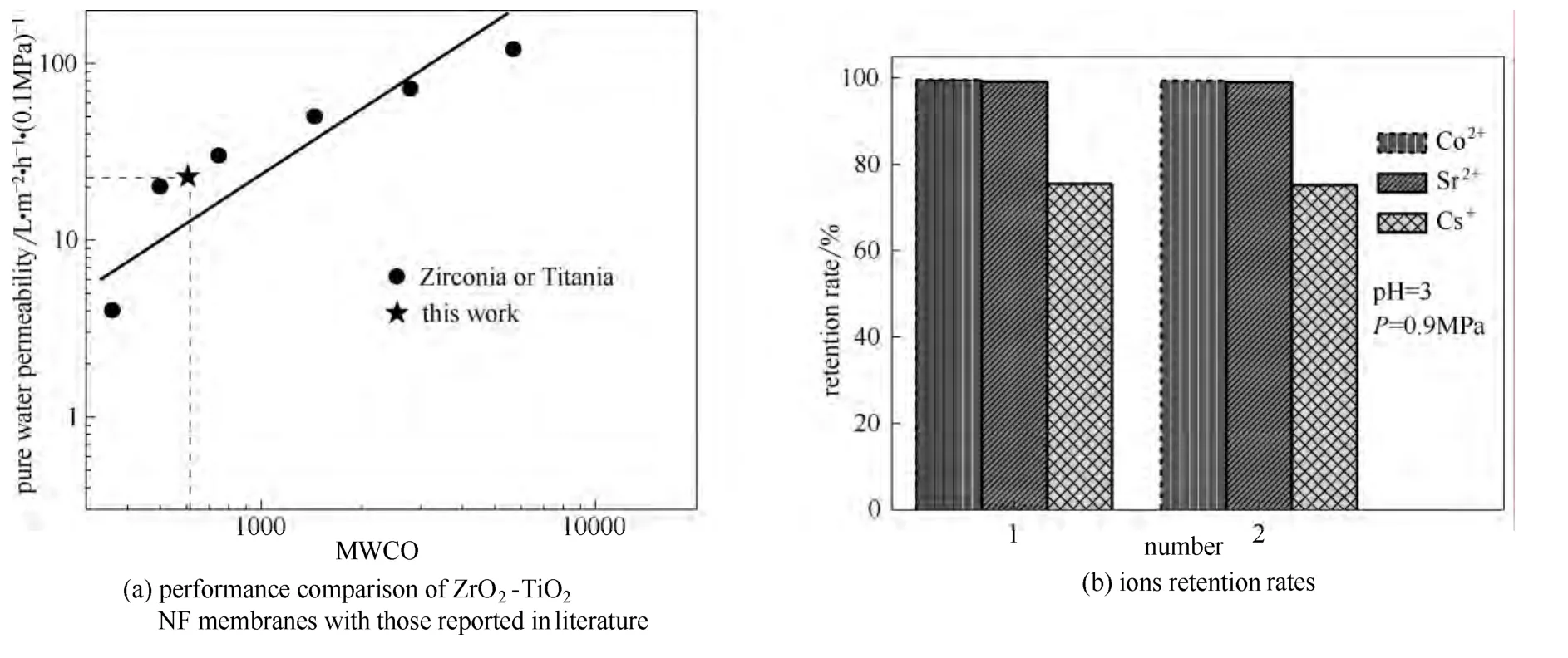
图9 与文献中的膜性能对比及离子截留率Fig.9 Performance comparison of ZrO2-TiO2NF membranes with those reported in literature and ions retention rates of ZrO2-TiO2NF membranes
实验测定了同一批次下 ZrO2-TiO2膜的渗透和分离性能,结果如图 8(a)所示。从图中可以看到,ZrO2-TiO2膜的平均纯水渗透率约 23 L·m-2·h-1·(0.1 MPa)-1,截留分子量在500~650之间,同一批次下制备的纳滤膜性能稳定,成品率高。选取该批次中3根具有代表性的纳滤膜,其截留性能曲线如图8(b)所示。从图中可以看出,NF1和NF2对分子量1000的PEG截留率在98%以上,说明膜层具有良好的完整性。NF3对分子量 1000的PEG截留率略低(约为93%),说明膜层上依然存在少量的缺陷。但是这些缺陷对纳滤的分离性能影响不大,NF3的截留分子量仍保持在600以下。
图9(a)为文献中报道的高性能ZrO2或TiO2纳滤膜截留分子量与纯水渗透率的关系曲线[21-24]。从图中可以看到,当截留分子量为500左右时,高性能 ZrO2或 TiO2膜的纯水渗透率可以达到20 L·m-2·h-1·(0.1 MPa)-1。本文制备得到的ZrO2-TiO2复合纳滤膜截留分子量约为 600时,20根膜管的平均纯水渗透率约为23 L·m-2·h-1·(0.1 MPa)-1,与文献报道的高性能 ZrO2或 TiO2纳滤膜性能相当,而本文研究工作采用的溶胶合成方法是颗粒溶胶工艺。为进一步考察所制 ZrO2-TiO2复合纳滤膜的分离性能,将所制 ZrO2-TiO2复合纳滤膜用于离子截留测试实验,测试结果如图9(b)所示,可以看到,在pH=3,压力0.9 MPa的条件下,该膜对低浓度的 Co2+、Sr2+、Cs+的截留率分别达到99.6%、99.2%和75.5%。
3 结 论
本文以高性能纳滤膜的制备为目标,通过改进的颗粒溶胶工艺制备出稳定的 ZrO2-TiO2复合颗粒溶胶。采用浸浆法,在平均孔径5 nm的管式α-Al2O3底膜上,经一次涂膜制备出完整无缺陷的高性能ZrO2-TiO2复合纳滤膜,研究得到以下结论:
(1)水解温度、甘油添加量及络合剂添加量对溶胶的粒径有重要影响,经过优化,确定最佳水解温度为60℃,最佳甘油添加量与前驱体摩尔比为0.5,最佳前驱体与络合剂摩尔比为6。
(2)经过合成参数优化后,采用改进的颗粒溶胶合成工艺制备的 ZrO2-TiO2复合颗粒溶胶平均粒径为3 nm,粒径分布窄,在一个月的老化时间里,平均粒径与黏度基本没有变化,稳定性良好。
(3)制备的ZrO2-TiO2复合纳滤膜膜层厚度约为200 nm,对PEG的截留分子量为600,纯水渗透率为 23 L·m-2·h-1·(0.1 MPa)-1,对低浓度的 Co2+、Sr2+、Cs+的截留率分别达到99.6%、99.2%和75.5%,所制 ZrO2-TiO2复合纳滤膜具有良好的渗透和分离性能,为陶瓷纳滤膜的规模化制备奠定了良好的实验基础。
[1] Drioli E, Giorno L. Comprehensive Membrane Science and Engineering [M]. Holland:Elsevier Press, 2010.
[2] Kreiter R, Rietkerk M D A, Bonekamp B C, Van V H M, Kessler V G,Vente J F. Sol-gel routes for microporous zirconia and titania membranes [J].J.Sol-Gel Sci.Technol., 2008, 48 (1-2):203-211.
[3] Van G T, Sebold D, Hauler F, Meulenberg W A, Buchkremer H P.Potentialities of microporous membranes for H2/CO2separation in future fossil fuel power plants:Evaluation of SiO2, ZrO2, Y2O3-ZrO2and TiO2-ZrO2sol-gel membranes [J].J.Membr.Sci., 2010, 359 (1-2):64-79.
[4] Aust U, Benfer S, Dietze M, Rost A, Tomandl G. Development of microporous ceramic membranes in the system TiO2/ZrO2[J].J.Membr.Sci., 2006, 281 (1-2):463-471.
[5] Topuz B, Ciftcioglu M. Sol-gel derived mesoporous and microporous alumina membranes [J].J.Sol-Gel Sci.Technol., 2010, 56 (3):287-299.
[6] Sakka S. Handbook of Sol-Gel Science and Technology:Processing,Characterization and Applications [M]. Holland:Kluwer Academic Publishers, 2005.
[7] Chen X F, Zhang W, Lin Y Q, Cai Y Y, Qiu M H, Fan Y Q.Preparation of high-flux γ-alumina nanofiltration membranes by using a modified sol-gel method [J].Micropor.Mesopor.Mater., 2015, (in press).
[8] Cai Y Y, Chen X F, Wang Y, Qiu M H, Fan Y Q. Fabrication of palladium-titania nanofiltration membranesviaa colloidal sol-gel process [J].Micropor.Mesopor.Mater., 2015, 201:202-209.
[9] Cai Y Y, Wang Y, Chen X F, Qiu M H, Fan Y Q. Modified colloidal sol-gel process for fabrication of titania nanofiltration membranes with organic additives [J].J.Membr.Sci., 2014, 476:432-441.
[10] Fukumoto T, Yoshioka T, Nagasawa H, Kanezashi M, Tsuru T.Development and gas permeation properties of microporous amorphous TiO2-ZrO2-organic composite membranes using chelating ligands [J].J.Membr.Sci., 2014, 461:96-105.
[11] Van G T, Sebold D, Kruidhof H, Bouwmeester H J M. ZrO2and TiO2membranes for nanofiltration and pervaporation [J].J.Membr.Sci.,2008, 318 (1-2):413-421.
[12] Spijksma G I, Huiskes C, Benes N E, Kruidhof H, Blank D H A,Kessler V G, Bouwmeester H J M. Microporous zirconia-titania composite membranes derived from diethanolamine-modified precursors [J].Adv.Mater., 2006, 18 (16):2165-2168.
[13] Zeidler S, Puhlfuerss P, Kaetzel U, Voigt I. Preparation and characterization of new low MWCO ceramic nanofiltration membranes for organic solvents [J].J.Membr.Sci., 2014, 470:421-430.[14] Zhu J, Fan Y Q, Xu N P. Modified dip-coating method for preparation of pinhole-free ceramic membranes [J].J.Membr.Sci., 2011, 367(1-2):14-20.
[15] Hench L L, West J K. The sol-gel process [J].Chem.Rev., 1990, 90(1):33-72.
[16] Qi H, Zhu G Z, Li L, Xu N P. Fabrication of a sol-gel derived microporous zirconia membrane for nanofiltration [J].J.Sol-Gel Sci.Technol., 2012, 62 (2):208-216.
[17] Kreiter R, Rietkerk M D A, Castricum H L, Van V H M, Ten E J E,Vente J F. Evaluation of hybrid silica sols for stable microporous membranes using high-throughput screening [J].J.Sol-Gel Sci.Technol., 2011, 57 (3):245-252.
[18] Etienne J, Larbot A, Julbe A, Guizard C, Cot L. A microporous zirconia membrane prepared by the sol-gel process from zirconyl oxalate [J].J.Membr.Sci., 1994, 86 (1-2):95-102.
[19] Larbot A, Fabre J P, Guizard C, Cot L. Inorganic membranes obtained by sol-gel techniques [J].J.Membr.Sci., 1988, 39 (3):203-212.
[20] Sing K S W, Everett D H, Haul R A W, Moscou L, Pierotti R A,Rouquerol J, Siemieniewska T. Reporting physisorption data for gas solid systems with special reference to the determination of surface-area and porosity (recommendations 1984) [J].Pure Appl.Chem., 1985, 57 (4):603-619.
[21] Dobrak A, Verrecht B, Van D H, Buekenhoudt A, Vankelecom I F J,Van D B. Solvent flux behavior and rejection characteristics of hydrophilic and hydrophobic mesoporous and microporous TiO2and ZrO2membranes [J].J.Membr.Sci., 2010, 346 (2):344-352.
[22] Voigt I, Fischer G, Puhlfurss P, Schleifenheimer M, Stahn M.TiO2-NF-membranes on capillary supports [J].Sep.Purif.Technol.,2003, 32 (1-3):87-91.
[23] Van G T, Vandecasteele C, Buekenhoudt A, Dotremont C, Luyten J,Leysen R, Van D B, Maes G. Alumina and titania multilayer membranes for nanofiltration:preparation, characterization and chemical stability [J].J.Membr.Sci., 2002, 207 (1):73-89.
[24] Tsuru T, Hironaka D, Yoshioka T, Asaeda M. Titania membranes for liquid phase separation:effect of surface charge on flux [J].Sep.Purif.Technol., 2001, 25 (1-3):307-314.
