1-丁基-3-甲基咪唑氯盐离子液体水溶液对纤维素的作用
2015-04-01王琳琳魏立纲马英冲李坤兰王艳涛丁珊万文英闫冰赵德扬王俊梅王鑫
王琳琳,魏立纲,马英冲,李坤兰,王艳涛,丁珊,万文英,闫冰,赵德扬,王俊梅,王鑫
(大连工业大学轻工与化学工程学院,辽宁 大连 116034)
引言
木质纤维生物质是一种重要的可再生资源,具有碳中和、储量丰富等优点[1-3]。由于其结构和成分的复杂性,生物质预处理已成为木质纤维生物质转化利用的一个重要组成部分。离子液体-水溶液预处理生物质作为一个新兴技术,由于水降低了离子液体的黏度、成本低、易回收等优点受到很大的关注[4-6]。Brandt等[7]已经证明了用离子液体-水溶液处理木质纤维生物质是有效的,并且定义为“the Ionosolv Process”,在这个过程中,不仅纤维素的晶体结构发生变化,还选择性地溶解了生物质中的木质素,预处理后纤维素结构与酶水解的效率密切相关。
在本课题组前期工作中,对[C4mim]Cl-水溶液处理秸秆进行了研究,处理后秸秆纤维素的结晶度高于未处理的秸秆,在 150℃时,用[C4mim]Cl-水(40%含水量) 处理秸秆后,发现提取物中有 35.2%无定形纤维素。人们普遍认为用离子液体处理纤维素后,纤维素的结晶度明显降低,但当离子液体中含水量大于5%时,对纤维素就不再起溶解作用[8]。但到目前为止,对离子液体-水溶液处理纤维素的报告还相对较少。
Olsson等[9]研究了[C2mim]OAc中水对微晶纤维素溶胀和溶解的影响。结果表明,当含水量超过10%时,严重阻碍了纤维素Ⅰ向纤维素Ⅱ转化,当含水量超过 15%时,[C2mim]OAc-水溶液就不能溶解纤维素。Shi等[10]研究[C2mim]OAc-水溶液对微晶纤维素的结晶度变化的影响,发现用20%~80%的[C2mim]OAc处理纤维素后,纤维素的结晶指数降低。Iguchi等[11]认为[C4mim]Cl-水溶液 (水分含量0.2%~4%) 对微晶纤维素在90℃时是非衍生溶剂(没有改变纤维素的化学结构),在 120℃时是衍生溶剂,在高温下,水的加入促进了纤维寡糖的水解。Mazza 等[12]指出,[C4mim]Cl-水溶液相比于[C2mim]OAc溶液-水,对纤维素溶解度较低。
本文探究了[C4mim]Cl-水溶液对无定形纤维素和微晶纤维素的作用,考察了不同含量[C4mim]Cl对无定形纤维素溶解度的影响、不同含量[C4mim]Cl对微晶纤维素结晶结构和纤维素氢键的影响。这项工作对[C4mim]Cl -水溶液处理纤维素的过程提供了新的见解。
1 实验材料和方法
1.1 材料
离子液体[C4mim]Cl由兰州化学物理研究所提供,纯度为98%。微晶纤维素(MCC,DP = 286)购自国药控股化学试剂有限公司。无定形纤维素是通过[C4mim]Cl微晶纤维素解结晶制得。微晶纤维素和无定形纤维素使用前在105℃下干燥24 h。普氮,纯度为99.9%。实验用水为双重去离子水。
1.2 分析测试仪器
X射线衍射仪, TD3500,电压40 kV,电流30 mA,以 8(°)·min-1的速度在 10°~40°(2θ) 的角度之间进行测定。傅里叶变换红外光谱仪,Nicolet 200 DXB,采用压片法,样品和氯化钾的比率为1:100,红外光谱测定范围为4000~500 cm-1。扫描电子显微镜,JSM-6300VL。
1.3 实验方法
1.3.1 制备无定形纤维素 在温度 100℃,压力 1 MPa下,将微晶纤维素溶解在离子液体[C4mim]Cl中,加去离子水使纤维素再生,测定再生纤维素的结晶度,重复上述过程,直至再生纤维素的晶体结构消失,制备成无定形纤维素。
1.3.2 [C4mim]Cl-水溶液处理纤维素 取一定质量比的[C4mim]Cl和水加入到有四氟乙烯内衬的高压釜中,再加入一定量的微晶纤维素(无定形纤维素),其与[C4mim]Cl和水的质量比为 1:20,向釜中充入氮气,使压力达到1 MPa,将高压釜放入温度为90℃,转速500 r·min-1的油浴锅中,溶解一定时间,立即过滤,收集滤液。未溶固形物经去离子水充分洗涤后置于冷冻干燥机中干燥,并在干燥处理后进行表征。
1.4 计算公式

式中,m0为纤维素样品的质量,g;mr为未溶固形物的质量,g;ml为离子液体-水溶液的质量,g;w为溶解度,%。

式中,I002是002面的最大衍射强度;Iam为2θ=18°时衍射强度;CrI为纤维素的结晶指数。

式中,Dhkl为晶粒尺寸,nm;K为谢洛常数,此处取 0.9;λ为0.1542 nm;β为特征衍射峰的最大半高宽,以弧度表示;θ为晶面的衍射角。
2 实验结果与讨论
2.1 [C4mim]Cl-水溶液对无定形纤维素的作用
当离子液体中水的质量百分数大于5% 时,离子液体对纤维素就不会起作用,失去溶解性,这是因为天然纤维素结构高度有序,分子内与分子间存在大量氢键和复杂的非结晶区[13-14]。因此,为了探索[C4mim]Cl-水溶液对无定形纤维素的作用,在90℃下将无定形纤维素溶解在不同含量的[C4mim]Cl中,结果如表1所示。含量为95%的[C4mim]Cl对无定形纤维素的溶解度最高,为 4.92%。随着离子液体含量的下降,溶解度也相应地下降直至不溶,这说明水的加入阻碍了无定形纤维素的溶解。

表1 无定形纤维素在[C4mim]Cl-水混合溶液中的溶解度Table 1 Solubility of amorphous cellulose in[C4mim]Cl-water mixture
2.2 [C4mim]Cl-水溶液对微晶纤维素结晶指数的影响
纤维素的晶体结构是了解[C4mim]Cl-水溶液对微晶纤维素作用的重要参数之一[15-17]。对[C4mim]Cl-水溶液处理后的微晶纤维素做X射线衍射(XRD)分析,结果如图1所示,从图中可以看出,微晶纤维素处理前后特征衍射峰的位置基本没变,在22.5°和18.0°各有一个主要峰和次要峰。主要峰代表的是002面峰的强度,即结晶区的衍射强度;次要峰代表的是无定形区的衍射强度。说明微晶纤维素经[C4mim]Cl-水溶液处理后晶型没有发生改变,仍然是纤维素Ⅰ。

图1 未处理和用60%[C4mim]Cl-水溶液处理微晶纤维素不同时间后的XRD谱图Fig. 1 XRD patterns of MCC treated with 60%[C4mim]Cl-water mixture in different treating duration
根据式(2)计算出不同时间和不同含量离子液体处理后的微晶纤维素的结晶指数,未处理的微晶纤维素的结晶指数为0.92。从图2中可以看出,虽然离子液体含量不同,但纤维素结晶指数的变化趋势相似。处理1 h后,纤维素的结晶指数降低,随后又升高,离子液体含量为60%时,处理2 h后结晶指数基本不变,离子液体含量为80%时,处理2 h后结晶指数又降低,然后随着处理时间的延长基本不变,离子液体含量为95%时,处理1 h后结晶指数持续降低,6 h后升高,这说明离子液体含量不同对微晶纤维素的作用程度不同。

图2 离子液体含量和时间对微晶纤维素结晶指数的影响Fig. 2 Influence of [C4mim]Cl content and treating duration on CrI of MCC
纤维素结晶指数的这种变化可能由两个因素决定,纤维素的溶胀(结晶指数降低)和无定形纤维素溶解在离子液体-水溶液中(结晶指数升高)。[C4mim]Cl-水溶液使微晶纤维素的表面发生溶胀,溶剂分子渗透到纤维素链间,破坏了微晶纤维素表面的规整结构,形成了无定形纤维素。在上述研究中,无定形纤维素可以溶解在60%~95%含量的离子液体中,因此,纤维素表面形成的无定形纤维素溶解后,规整结构又暴露出来,使结晶指数升高。这解释了纤维素的结晶指数随着处理时间上下波动的原因。随着处理时间的延长,纤维素的结晶指数趋于平稳,这可能是由于离子液体-水溶解了部分纤维素,从而阻碍了其进一步对纤维素的作用,所以结晶指数不变化。
2.3 [C4mim]Cl-水溶液对微晶纤维素晶粒尺寸的影响
为了进一步了解微晶纤维素结晶指数的变化,根据式(3)计算[C4mim]Cl-水溶液处理后纤维素的晶粒尺寸,结果如表2所示。纤维素晶粒尺寸的变化趋势与纤维素结晶指数的变化趋势相似。与未处理的纤维素相比,60%的[C4mim]Cl-水溶液处理后纤维素002和面的晶粒尺寸显著增加,随着处理时间的延长,晶粒尺寸也随之上下波动,但 101面晶粒尺寸的变化趋势不明显,可能是因为[C4mim]Cl和水对每个晶面的作用不同,对002和面作用更强。但用 95%的[C4mim]Cl-水溶液处理纤维素后,其101面晶粒尺寸的变化也很明显,这说明离子液体含量不同,对纤维素每个晶面的作用也不同。这也进一步说明[C4mim]Cl-水溶液没有改变纤维素原来的晶型,只是影响纤维素的晶粒尺寸,这种变化在红外谱图上体现为纤维素链的不同氢键的比例发生了变化。

表2 [C4mim]Cl-水溶液处理微晶纤维素后的晶粒尺寸Table 2 Crystallite size (Dhkl) of MCC treated with[C4mim]Cl-water mixtures
2.4 纤维素红外谱图的氢键拟合分析
纤维素的氢键模式是确定纤维素材料结构和性能最重要的因素之一[18-19]。为了了解[C4mim]Cl-水溶液对纤维结构中氢键的影响,对处理后的纤维素进行红外光谱分析,结果如图3所示。从图3中可以看出,处理前后纤维素的红外吸收峰形状基本相同,没有新的吸收峰出现,说明并没有在纤维素大分子中引入新的基团。
纤维素结晶区的羟基通过氢键产生作用,由于氢键分为分子内氢键和分子间氢键,表现在红外光谱的吸收波数是不一样的,对红外谱图求二阶导数,寻找分峰的位置,根据文献报道[20-22],纤维素Ⅰ分子内氢键 O(2)H…O(6)、O(3)H…O(5)和分子间氢键O(6)H…O(3′)的特征吸收波数分别为 3455~3410 cm-1、3375~3340 cm-1、3310~3230 cm-1,由此结合导数光谱进行高斯分峰拟合。

图3 60% [C4mim]Cl-水溶液处理微晶纤维素不同时间后的红外谱图Fig. 3 FTIR spectrum of MCC treated with 60%[C4mim]Cl-water mixture in different time
由表 3的拟合结果看出,60%和 95%的[C4mim]Cl-水溶液处理微晶纤维素一段时间后,纤维素分子内氢键 O(2)H…O(6)和 O(3)H…O(5)占总氢键强度比例增加,分子间氢键O(6)H…O(3′)占总氢键强度比例下降。随着处理时间的延长,纤维素分子内氢键 O(2)H…O(6)和 O(3)H…O(5)占总氢键强度比例下降,分子间氢键O(6)H…O(3′)占总氢键强度比例上升,这种变化在 XRD中体现为纤维素结晶指数发生了变化。而 80%浓度的[C4mim]Cl-水溶液处理微晶纤维素后,纤维素分子内氢键 O(2)H…O(6)和O(3)H…O(5)占总氢键强度比例下降,分子间氢键O(6)H…O(3´)占总氢键比例上升。表明不同浓度的离子液体-水溶液对纤维素氢键作用过程不同。
3 结 论
(1)无定形纤维素能够部分溶解在 [C4mim]Cl-水溶液中,且加去离子水后能再生出纤维素,无定形纤维素的溶解度随着离子液体含量的降低而降低。
(2)[C4mim]Cl-水溶液处理微晶纤维素后其晶型没有发生改变,但纤维素的结晶指数和晶粒尺寸有上下波动的变化趋势。纤维素的这种变化可能由两个因素决定,纤维素的溶胀(结晶指数降低)和无定形纤维素溶解在离子液体-水溶液中(结晶指数升高)。
(3)[C4mim]Cl-水溶液处理前后纤维素的红外吸收峰形状基本相同,没有新的吸收峰出现,说明并没有在纤维素大分子中引入新的基团。纤维素的分子内和分子间氢键相对强度都有明显变化,说明[C4mim]Cl-水溶液破坏了纤维素表面的分子内和分子间氢键。
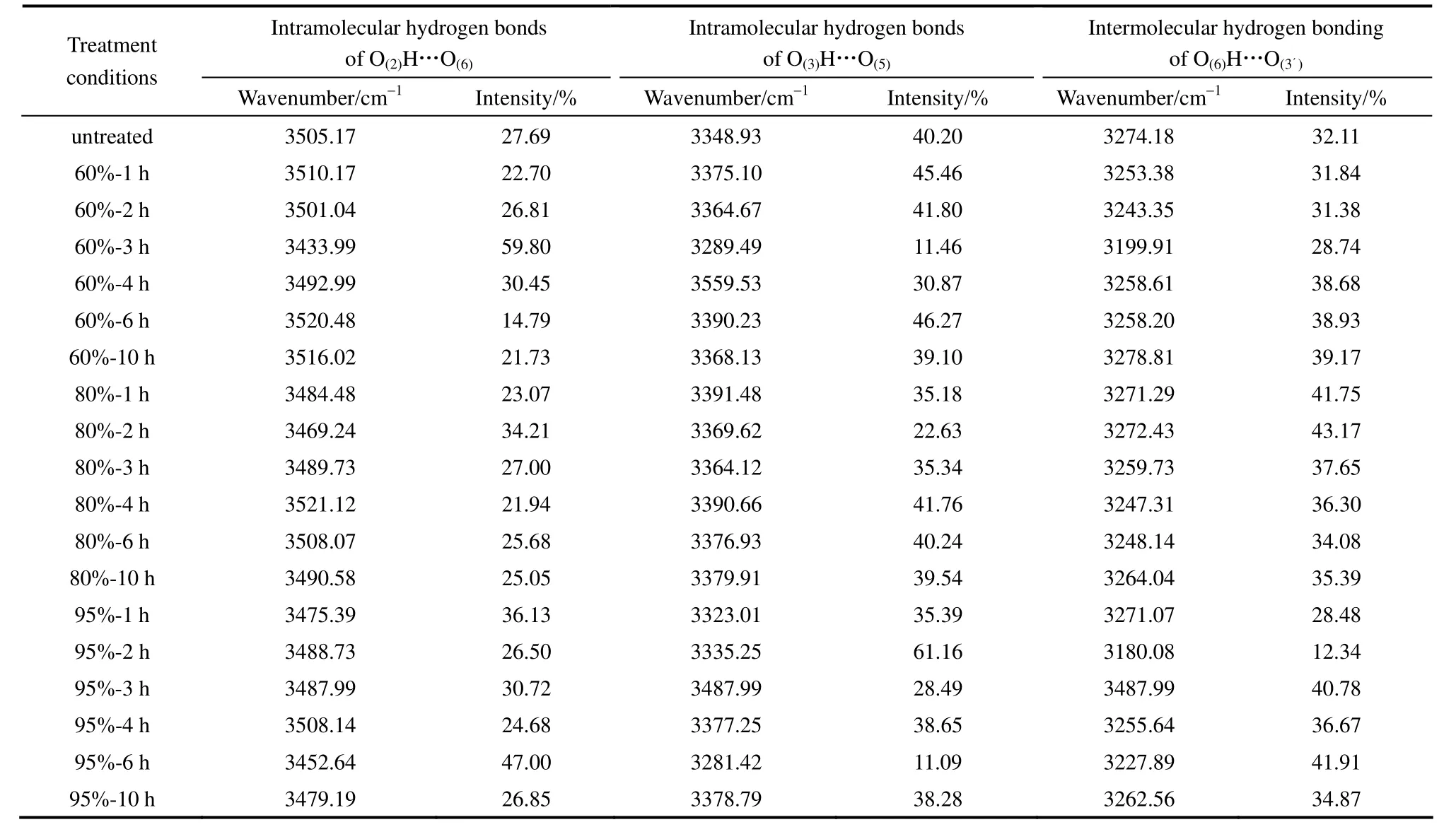
表3 [C4mim]Cl-水溶液处理微晶纤维素的红外谱图氢键拟合结果Table 3 FTIR spectra of hydrogen bonding fitting results treated MCC with [C4mim]Cl-water mixture
[1] Gu Yanlong(顾彦龙), Shi Feng(石峰), Deng Youquan(邓友全).Research and application of ionic liquids in catalysis and separation[J].Journal of Chemical Industry and Engineering(China) (化工学报), 2004, 55(12):1957-1962.
[2] Swatloski R P, Spear S K, Holbrey J D. Dissolution of cellulose with ionic liquids [J].J. Am. Chem. Soc., 2002, 124:4974-4975.
[3] Zavrel M, Bross D, Funke M. High-throughput screening for ionic liquids dissolving (ligno-)cellulose [J].Bioresource Technology, 2009,100:2580-2587.
[4] Wang Y T, Wei L G, Li K L, Ma Y C, Ma N N, Ding S, Wang L L,Zhao D Y, Yan B, Wan W Y, Zhang Q, Wang X, Wang J M, Li H.Lignin dissolution in dialkylimidazolium-based ionic liquid-water mixtures[J].Bioresource Technology, 2014, 170:499-505.
[5] Bendaoud A, Chalamet Y. Effects of relative humidity and ionic liquids on the water content and glass transition of plasticized starch[J].Carbohydrate Polymers, 2013, 97(2):665-675.
[6] Ciolacu D, Kovac J, Kokol V. The effect of the cellulose-binding domain from Clostridium cellulovorans on the supramolecular structure of cellulose fibers [J].Carbohydrate Research, 2010, 345(5):621-630.
[7] Brandt A, Grasvik J, Hallett J P, Welton T. Deconstruction of lignocellulosic biomass with ionic liquids [J].Green Chem., 2012, 15:550-583.
[8] Wei L G, Li K L, Ma Y C, Hou X. Dissolving lignocellulosic biomass in a 1-butyl-3-methylimidazolium chloride-water mixture[J].Industrial Crops and Products, 2012, 37(1):227-234.
[9] Olsson C, Idström A, Nordstierna L, Westman G. Influence of water on swelling and dissolution of cellulose in 1-ethyl-3-methylimidazolium acetate [J].Carbohydrate Polymers, 2014, 99:438-446.
[10] Shi J, Balamurugan K, Parthasarathi R, Sathitsuksanoh N, Zhang S,Stavila V, Subramanian V, Simmons B A, Singh S. Understanding the role of water during ionic liquid pretreatment of lignocellulose:co-solvent or anti-solvent? [J].Green Chem., 2014, 16:3830-3840.
[11] Iguchi M, Aida T M, Watanabe M, Smith Jr R L. Dissolution and recovery of cellulose from 1-butyl-3-methylimidazolium chloride in presence of water [J].Carbohydrate Polymers, 2013, 92(2):651-658.
[12] Mazza M, Catana D A, Vaca-Garcia C, Cecutti C. Influence of water on the dissolution of cellulose in selected ionic liquids [J].Cellulose,2009, 16(2):207-215.
[13] Schwanninger M, Rodrigues J C, Pereira H, Hinterstoisser B. Effects of short-time vibratory ball milling on the shape of FT-IR spectra of wood and cellulose [J].Vibrational Spectroscopy, 2004, 36(1):23-40.
[14] Fu D B, Mazza G. Aqueous ionic liquid pretreatment of straw [J].Bioresource Technology, 2011, 102(13):7008-7011.
[15] Dai D, Fan M. Investigation of the dislocation of natural fibres by Fourier-transform infrared spectroscopy [J].Vibrational Spectroscopy,2011, 55(2):300-306.
[16] Wang W C, Zhang P, Zhang S, Li F X, Yu J Y, Lin J Y. Structure and properties of novel regenerated cellulose fibers prepared in NaOH complex solution [J].Carbohydrate Polymers, 2013, 98(1):1031-1038.
[17] Tiwari A K, Sonu, Saha S K. Aggregation behaviour and thermodynamics of mixed micellization of gemini surfactants with aroom temperature ionic liquid in water and water-organic solvent mixed media [J].The Journal of Chemical Thermodynamics, 2013, 60:29-40.
[18] Qi X H , Watanabe M, Aida T M, Smith R L. Synergistic conversion of glucose into 5-hydroxymethylfurfural in ionic liquid-water mixtures [J].Bioresource Technology, 2012, 109:224-228.
[19] Zhao H B, Kwak J H, Zhang Z C, Brown H M, Arey B W, Holladay J E. Studying cellulose fiber structure by SEM, XRD, NMR and acid hydrolysis [J].Carbohydrate Polymers, 2007, 68(2):235-241.
[20] Cheng G, Varanasi P, Arora R, Stavila V, Simmons B A, Kent M S,Singh S. Impact of ionic liquid pretreatment conditions on cellulose crystalline structure using 1-ethyl-3-methylimidazolium acetate [J].The Journal of Physical Chemistry B, 2012, 116 (33):10049-10054.
[21] Doherty T V, Mora-Pale M, Foley S E, Linhardt R J, Dordick J S.Ionic liquid solvent properties as predictors of lignocellulose pretreatment efficacy [J].Green Chemistry, 2010, 12(11):1967-1975.
[22] Hauru L K J, Hummel M, King A W T, Kilpeläinen I, Sixta H. Role of solvent parameters in the regeneration of cellulose from ionic liquid solutions [J].Biomacromolecules, 2012, 13(9):2896-2905.
