乙醇胺乳酸盐离子液体吸收SO2过程中的物理化学性质
2015-04-01王晨星任树行侯玉翠田士东吴卫泽
王晨星,任树行,侯玉翠,田士东,吴卫泽
(1北京化工大学化学工程学院,化工资源有效利用国家重点实验室,北京 100029;2太原师范学院化学系,山西 太原030031)
引言
离子液体(ionic liquids, ILs)是一种室温及邻近温度下的有机熔盐,是由离子组成的有机液态物质。离子液体具有以下特点:① 离子液体无味、不燃,几乎没有蒸气压,因此可用在高真空体系中,同时可减少因挥发而产生的环境污染问题;② 离子液体对有机和无机物都有良好的溶解性能,可使反应在均相条件下进行;③ 可操作温度范围宽(-40~300℃),具有良好的热稳定性和化学稳定性,易与其他物质分离,可以循环利用[1-2]。除此之外,离子液体还具有结构可调、性质可控等特点。在常温下,它对SO2、CO2、H2S、乙烯、乙烷等多种有机或无机气体都具有很好的溶解性能[3-4]。因此,离子液体在气体分离,尤其是SO2分离方面具有良好的应用前景,其中乳酸基离子液体由于其优秀的SO2吸收以及再生能力,是最具有应用潜力的脱硫离子液体。但是,离子液体的应用需要基础数据的支持,特别是在设计离子液体吸收SO2的工艺时需要吸收剂的相关物性,如密度、黏度等。因此,获得离子液体和水的二元混合体系的一系列物理性质参数具有重要意义。乙醇胺乳酸盐([MEA]L)作为一种功能化的离子液体对SO2具有良好的吸收效果[5]。然而,乙醇胺乳酸盐与水二元混合体系及在吸收SO2过程中的密度、黏度却未见报道。
本文测定了常压下,乙醇胺乳酸盐-水二元混合体系在303.15~333.15 K下全浓度范围内的密度和黏度,计算超额摩尔体积VE和混合黏度变化Δη,进行了拟合及模型关联;并测定了吸收低浓度SO2前后密度和黏度。这些研究将为该离子液体在吸收SO2的工业应用方面提供基础数据。
1 实验材料和方法
1.1 材料与仪器
乙醇胺,AR,阿拉丁试剂有限公司提供,质量分数 >99.0%;乳酸,AR,阿拉丁试剂有限公司提供,质量分数85.0%~90.0%;二氧化硫,北京海普气体有限公司提供,体积分数 >99.95%;氮气,北京海普气体有限公司提供,体积分数 >99.999%;去离子水,化工资源有效利用国家重点实验室提供,电导率σ<1.5 μS·cm-1。
密度计,Anton Paar公司生产(DMA 4500M型),该仪器密度测量精度 ±1×10-5g·m-3,测量池温度精度±0.01 K,系统测定温度波动±0.02 K。黏度计,Anton Paar 公司生产(Lovis 2000M型),该仪器黏度测量精度 ±0.001 mPa·s,测量池温度精度±0.01 K,系统测定温度波动±0.02 K;核磁共振波谱仪,布鲁克公司生产(AV600型);水分滴定仪,北京先驱威锋技术开发公司生产(ZDJ-400S型),精度±0.01%;电子天平,Sartorious公司生产(BS 2202S型),精度±0.1 mg。
1.2 乙醇胺乳酸盐的合成及二元混合体系的制备
通过将乙醇胺与等物质的量的乳酸中和的方法制备离子液体[MEA]L,具体合成方法参考文献[5]。离子液体合成过程中的大量溶剂在70℃通过旋转蒸发仪除去,然后采用N2吹扫法除去离子液体中残留的溶剂,处理条件为:温度 75℃,N2流速为10 ml·min-1·g-1,吹扫时间为12 h。合成后的离子液体的结构和纯度用核磁共振波谱仪进行表征。
实验中用到的离子液体水溶液均为新鲜配制。离子液体和去离子水按一定比例混合后,通过水分滴定仪进行水分测定,每个数值重复测试3次,取其平均值。
1.3 SO2吸收实验
实验中使用的模拟烟气(0.35%的SO2)是常压下将纯 N2和 SO2按一定比例混合而成的。SO2/N2混合气通过盛有离子液体[MEA]L水溶液的玻璃试管,混合气流量为100 ml·min-1,通过转子流量计计量。试管部分浸没在水浴中,水浴的温度通过投入式加热器进行控制,保持吸收温度恒定,温度精度为±0.1 K。实验装置见图1。
1.4 密度、黏度的测定
用密度计和黏度计分别测量不同水分含量的[MEA]L溶液在303.15~333.15 K的密度和黏度,以及吸收SO2后[MEA]L溶液的密度和黏度。为了验证测定方法的准确性,测定了乙醇胺在303.15~333.15 K的密度、黏度的数据,并与文献值进行比较,其结果如表1所示。从表1可以看出所有测定数据均与文献值一致[6-7]。因此,密度和黏度的测定方法是可靠的。
二元混合体系的超额体积VE和混合黏度偏差分别通过式(1)和式(2)进行计算


图1 离子液体吸收SO2/N2混合气的装置Fig.1 Schematic diagram of apparatus for absorption ofSO2/N2mixed gas by ILs

表1 乙醇胺密度、黏度与文献值的对比Table 1 Comparison of densities and viscosities of monoethanolamine with literature data
2 实验结果与讨论
2.1 离子液体的表征
实验中合成的离子液体的结构和纯度使用核磁共振进行确认,[MEA]L的1H NMR谱图见图2。由1H NMR谱图可以看出[MEA]L的图谱与文献报道一致[8]。
2.2 不同水含量的[MEA]L溶液吸收低浓度SO2
图3显示了不同水含量的[MEA]L溶液在常压,40℃时,吸收低浓度SO2的规律。每隔一段时间,使用GB 11198.12—89提供SO2含量的测定方法,测定这些离子液体水溶液中SO2的含量(已扣除水对 SO2吸收的影响),当离子液体中 SO2的含量不再变化时,视为离子液体溶液已经吸收SO2饱和。

图2 离子液体[MEA]L的1H NMR谱图Fig.2 1H NMR spectra of [MEA]L

图3 313.15 K下不同水分含量对离子液体[MEA]L吸收SO2的影响Fig.3 Effect of water on absorption of SO2by [MEA]L at 313.15 K
从图中可以看出,随着溶液中的水分含量增加,[MEA]L的SO2饱和吸收量也随之增加,这与文献中的报道相一致[9],水分的增加促使反应的平衡向右移动,从而增加了其饱和吸收量。
2.3 [MEA]L + H2O体系的密度与混合体系的超额体积
[MEA]L + H2O二元混合体系在 303.15~333.15 K范围的各组分质量分数w、混合密度ρ、超额体积VE列于表2。
从表2可以看出,随着温度及溶液中含水量的增加,体系的密度不断减小;混合体系VE在所测温度和浓度范围内均为负值,而且随着温度的增加,混合体系VE负偏差逐渐减小。
在其他离子液体与水[10-11]的二元体系中也发现
了这种现象,表明[MEA]L和水之间存在较强的作用力。其原因可能是:由于水的加入使离子液体间的氢键断裂,体积膨胀,而离子液体和水分子之间的交叉缔合作用得到了强化,并占主导地位[12]。

表2 常压下温度为303.15~333.15 K不同水质量分数时[MEA]L (1) + H2O (2)二元混合体系的密度和超额体积Table 2 Densities and excess molar volumes of [MEA]L (1) + H2O (2) with different H2O mass fractions (w2) at 303.15—333.15 K and atmosphere pressure
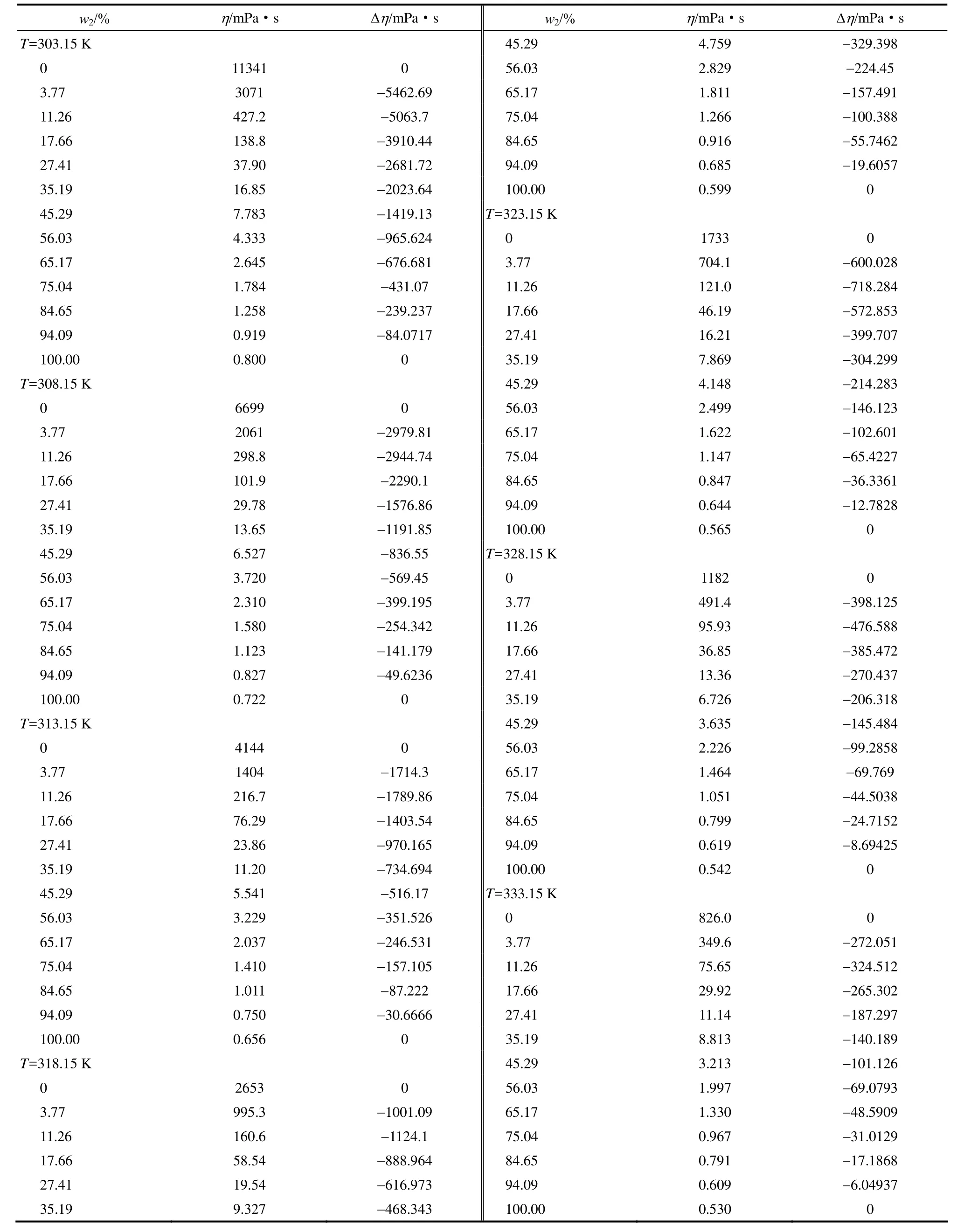
表3 常压下温度为303.15~333.15 K不同水质量分数时[MEA]L (1) + H2O (2)二元混合体系的黏度和混合黏度偏差Table 3 Viscosities and viscosity deviations of [MEA]L (1)+H2O (2) with different H2O mass fractions (w2) at 303.15—333.15 K and atmosphere pressure
2.4 [MEA]L+H2O体系的黏度与混合黏度的偏差
[MEA]L + H2O二元混合体系在 303.15~333.15 K范围的各组分质量分数w、混合黏度η、混合黏度的偏差Δη[13]列于表3。
从表3可以看出,随着温度及溶液中含水量的增加,体系的黏度急剧减小;混合体系Δη在所测温度和浓度范围内均为负值,产生了负偏差,而且Δη随着温度的上升而增大。其他乳酸基离子液体与水之间也存在相同的规律[11]。这也说明水与[MEA]L之间存在较强的作用力。
2.5 [MEA]L + H2O体系密度、黏度的拟合及模型关联
[MEA]L + H2O的密度和黏度随着温度的变化分别用式(3)和式(4)进行拟合[14-16]。
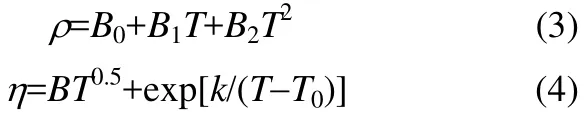
不同组成的混合体系密度和黏度随着温度的变化如图4和图5所示。
从图4、图5可以看出,混合体系的密度和黏度均随着水的质量分数的增加以及温度的升高呈现下降趋势,尤其是黏度的变化更为显著。因此通过调节水和[MEA]L的含量可以得到具有不同物性的混合溶液。
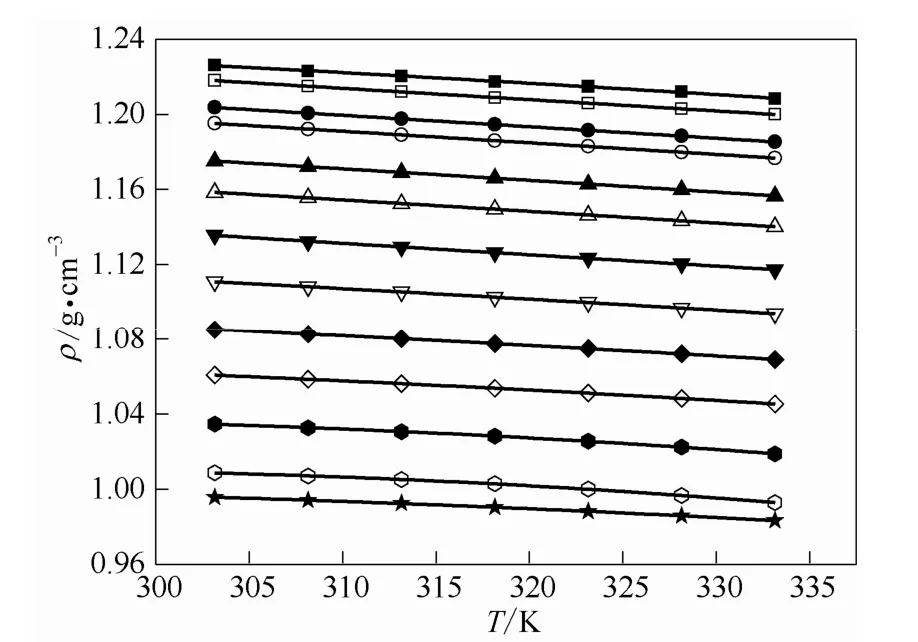
图4 [MEA]L(1) + H2O(2)的密度随温度的变化Fig. 4 Densities of [MEA]L(1) + H2O(2) as a function of temperature(solid lines are results calculated by equation.w2/% from top to bottom in turn are:0, 3.77, 11.26, 17.66,27.41, 35.19, 45.29, 56.03, 65.17, 75.04, 84.65, 94.09,100.00)

图5 [MEA]L(1) + H2O(2)的黏度随温度的变化Fig. 5 Viscosities of [MEA]L(1) + H2O(2) as a function of temperature (solid lines are results calculated by equation.w2/% from top to bottom in turn are:0.00, 3.77, 11.26,17.66, 27.41, 35.19, 45.29, 56.03, 65.17, 75.04, 84.65,94.09, 100.00)
Jouyban-Acree模型被用来预测二元混合体系的物性数据[17-19],该模型的特点在于可以将二元混合体系的物性数据与温度和组成同时进行关联。使用类似于Jouyban-Acree模型对[MEA]L(1) + H2O(2)的密度、黏度与温度和组成进行同时关联。表示方法如式(5)和式(6)所示[17]。

计算值与实验值的差异使用平均百分偏差(APD)表示,其表达式见式(7)[17]。

[MEA]L + H2O的密度和黏度随着温度和水含量的变化分别如图6和图7所示。

图6 [MEA]L (1)+H2O (2) 的密度随水含量和温度的变化Fig.6 Densities of [MEA]L (1)+H2O (2) as a function of water content and temperature (symbols are experimental data and lines are calculated results by model)

图7 [MEA]L(1) + H2O(2) 的黏度随水含量和温度的变化Fig.7 Viscosities of [MEA]L (1) + H2O (2) as a function of water content and temperature (symbols are experimental data and lines are calculated results by model)

表4 [MEA]L (1) + H2O (2)物性数据的模型参数和平均百分偏差Table 4 Parameters and APD of model for[MEA]L (1) + H2O (2)
模型的参数及APD列于表4中。从拟合结果可以看出,[MEA]L + H2O二元混合体系密度和黏度的拟合平均偏差分别为 0.066%和 6.664%。由此可见,通过模型可以较好地预测[MEA]L + H2O二元混合体系的密度和黏度。
2.6 吸收SO2前后[MEA]L + H2O体系的密度与黏度的变化

图8 不同浓度的[MEA]L溶液吸收SO2前后密度的变化Fig. 8 Densities of aqueous [MEA]L solution before (solid symbols) and after (hollow symbols) absorption as a function of temperature at different water mass fractions

表5 [MEA]L(1) + H2O(2)体系吸收SO2前后密度和黏度Table 5 Densities and viscosities of [MEA]L(1) + H2O(2)before and after SO2absorption

图9 不同浓度的[MEA]L溶液吸收SO2前后黏度的变化Fig. 9 Viscosities of aqueous [MEA]L solution before (solid symbols) and after (hollow symbols) absorption as a function of temperature at different water mass fractions
表5和图8、图9显示了含水量为 30%、50%、70%的[MEA]L溶液在吸收 SO2前后的密度和黏度变化。
对比吸收SO2前后的数据,可以发现,在相同的实验条件下,[MEA]L溶液吸收SO2后的密度和黏度较吸收之前均有增大。
究其原因可能是因为 SO2与水结合生成H2SO3,从而增强了体系中分子间的相互作用,导致密度及黏度的上升。
3 结 论
(1)测定了常压下乙醇胺乳酸盐与水二元体系全浓度范围内和303.15~333.15 K下的混合液的密度、黏度。结果表明该体系密度随着温度、水含量的增大而下降;该体系的黏度随着温度、水含量的增大而下降,当水的质量分数大于60%时,黏度无明显变化。并且计算不同温度及组成下该二元体系的超额摩尔体积VE和混合黏度变化Δη,结果均为负值,产生了负偏差,说明水与[MEA]L之间存在较强的作用力。
(2)用 Jouyban-Acree模型对二元混合体系的物性进行关联,模型预测的密度数据与实验数据的平均偏差为0.066%,模型预测的黏度数据与实验数据的平均偏差为6.664%。
(3)测定了含水量为30%、50%、70%的[MEA]L溶液对低浓度(体积分数 0.35%)SO2的饱和吸收量,并测量了吸收前后[MEA]L溶液的密度及黏度的变化。结果表明,随着含水量的增加,[MEA]L对SO2的饱和吸收量增加;吸收后溶液的密度、黏度,相比于吸收前都稍稍变大了,说明吸收后的溶液分子间的作用力较吸收前有所增强。
[1] Liu R X, Wang J J. Research and application on green solvent—the ionic liquid [J].Chemical Industry and Engineering Progress, 2002,21(1):43-48.
[2] Dupont J, de Souza R F, Suarez P A Z. Inoic liquid (molten salt)phase organometallic catalysis [J].Chem. Rev., 2002, 102:3667-3692.
[3] Anthony J L, Maginn E J, Brennecke J F. Solubilities and thermodynamic properties of gases in the ionic liquid 1-n-butyl-3-methylimidazolium hexafluorophosphate [J].J. Phys.Chem. B, 2002, 106:7315-7320.
[4] Guo B, Duan E H, Zhong Y F,et al. Absorption and oxidation of H2S in caprolactam tetrabutyl ammonium bromide ionic liquid [J].Energy Fuels, 2011, 25:159-161.
[5] Zhai L Z, Zhong Q, He C,et al.Hydroxyl ammonium ionic liquids synthesized by water-bath microwave:synthesis and desulfurization[J].J. Hazard. Mater., 2010, 177(1/2/3):807-813.
[6] Aguila-Hernandez J, Trejo A, Garcia-Flores B E,et al. Viscometric and volumetric behaviour of binary mixtures of sulfolane andN-methylpyrrolidone with monoethanolamine and diethanolamine in the range 303–373 K [J].Fluid Phase Equilib., 2008, 267(2):172-180.
[7] Kapadi U R, Hundiwale D G, Patil N B,et al. Viscosities, excess molar volume of binary mixtures of ethanolamine with water at 303.15, 308.15, 313.15 and 318.15 K [J].Fluid Phase Equilib., 2002,2002(2):335-341.
[8] Yuan X L, Zhang S J, Lu X M. Hydroxyl ammonium ionic liquids:synthesis, properties, and solubility of SO2[J].J. Chem. Eng. Data,2007, 52(2):596-599.
[9] Qian J G, Ren S H, Tian S D. Highly efficient and reversible absorption of SO2by aqueous triethyleneteramine tetralactate solutions [J].Ind. Eng. Chem. Res., 2014, 53(39):15207-15212.
[10] Taib M M, Murugesan T. Densities and excess molar volumes of binary mixtures of bis(2-hydroxyethyl) ammonium acetate + water and monoethanolamine + bis(2-hydroxyethyl)ammonium acetate at temperatures from 303.15 to 353.15 K [J].J. Chem. Eng. Data, 2010,55(12):5910-5913.
[11] Tian S D, Ren S H, Hou Y C,et al. Densities, viscosities and excess properties of binary mixtures of 1,1,3,3-tetramethylguandinium lactate + water atT=303.15 to 328.15 K [J].J. Chem. Eng. Data,2013, 58:1885-1892.
[12] Lin Mingsui(林明穗), Lin Jinqing(林金清). Excess volumes of mixture for 1,3-propanediol + water/ethanol [J].CIESC Journal(化工学报), 2009,60 (2):294-298.
[13] Tu C H, Lee S L, Peng I H. Excess volumes and viscosities of binary mixture of aliphatic alcohols(C1—C4) with nitromethane [J].J. Chem.Eng. Data, 2001, 46(1):151-160.
[14] Zhao Y S, Zhang X P, Zeng S J,et al. Density, viscosity, and performances of carbon dioxide capture in 16 absorbents of amine +ionic liquid + H2O, ionic liquid + H2O, and amine + H2O systems [J].J. Chem. Eng. Data, 2010, 55(9):3513-3519.
[15] DiGuilio R M, Lee R J, Schaeffer S T,et al. Densities and viscosities of the ethanolamines [J].J. Chem. Eng. Data, 1992, 37(2):239-242.
[16] Lee S, Choi S I, Maken S,et al. Physical properties of aqueous sodium glycinate solution as an absorbent for carbon dioxide removal[J].J. Chem. Eng. Data, 2005, 50(5):1773-1776.
[17] Hasan M, Kadam U B, Hiray A P,et al. Densities, viscosities, and ultrasonic velocity studies of binary mixtures of chloroform with pentan-1-ol, hexan-1-ol, and heptan-1-ol at 303.15 and 313.15 K [J].J.Chem. Eng. Data, 2006, 51(2):671-675.
[18] Jouyban A, Fathi-Azarbayjani A, Khoubnasabjafari M,et al.Mathematical representation of the density of liquid mixtures at various temperatures using Jouyban-Acree model [J].Indian J. Chem.,2005, 44(8):1553-1560.
[19] Jouyban A, Khoubnasabjafari M, Vaez- Gharamaleki Z,et al.Calculation of the viscosity of binary liquids at various temperatures using Jouyban-Acree model [J].Chem. Pharm. Bull., 2005, 53(5):519-523.
