植物叶片中硫含量测定方法研究
2015-04-01杨璐依丽米努尔朱苗苗李宏
杨璐,依丽米努尔,朱苗苗,李宏*
(1.新疆林业科学院,新疆 乌鲁木齐 830002;2.新疆农业大学 林学与园艺学院,新疆 乌鲁木齐 830052)
硫是植物生长必需的矿质营养元素之一,是继氮、磷、钾之后第四位植物生长必需的营养元素[1],几乎所有蛋白质都有含硫氨基酸,因此硫在植物细胞的结构和功能中都有着重要作用。硫不仅是蛋白质和氨基酸的组成成分,而且参与许多酶、辅酶和硫胺类等生理活性物质的组成,参与有氧呼吸作用、氮素代谢、脂肪代谢、淀粉合成和生物固氮作用等重要生理生化过程[2]。研究表明,硫能促进豆科作物形成根瘤,参与固氮酶的形成[3];硫元素能提高氨基酸、蛋白质含量,进而提升农产品品质[4]。同时,植物对一定浓度范围内的大气污染物不仅具有一定程度的抵抗力,而且具有一定程度的吸收净化能力,通过植物叶片中的含硫量检测大气环境中二氧化硫的浓度[5-7]。因此,硫的测定对于环境科学和生态学的研究均有重要意义。本文采用单因素实验对硫酸钡比浊法测定植物叶片中的硫含量进行了系统的研究,旨在建立一种简便、快捷测定植物叶片中硫含量的方法。
1 实验部分
1.1 试剂与仪器
Na2SO4、BaCl2均为优级纯;Na2CO3、硝酸、盐酸、甘油、无水乙醇、丙酮、吐温80 均为分析纯。
UV-2600 紫外可见光分光光度计;F6020C-33-80 马弗炉;DHG-9053A 烘箱;C-MAG HP10 电热板;TW20 水浴锅;C-MAG HS4 磁力搅拌器;TP-214 万分之一天平。
1.2 实验方法
1.2.1 样品处理 对从现场采集的新鲜植物叶片样品立即用自来水洗2 ~3 次,去除叶面尘埃及附着物,再用去离子水冲洗2 次,自然晾干后置于鼓风干燥箱中在70 ℃下烘30 min,然后105 ℃下烘至恒重。将烘干的样品用电动粉碎机粉碎,过60 ~80 mm 筛孔,得到粉末状样品,备用。
样品处理参考吴名剑等[8]的方法,略有改动。精确称取适量样品1.000 g 于瓷坩埚中,加入2 mL 5% Na2CO3溶液,搅拌均匀,调节温度300 ℃烘干至完全炭化,然后移入马弗炉中先调节温度300 ℃1 h 后逐步升温至600 ℃,灰化2 h 后取出,冷却后加入10 mL 2%盐酸,电热板100 ℃加热20 min,过滤,滤液至于25 mL 容量瓶中,用去离子水稀释至刻度,摇匀,即得供试品溶液。
1.2.2 样品测定 取2 mL 供试品溶液,置于25 mL 容量瓶中,加入2 mL 甘油-乙醇(1 ∶1)保护剂,加入少量去离子水稀释,摇匀,加入10 mg/mL BaCl2溶液2 mL,再加入25% HCl 溶液2 mL,用去离子水稀释至刻度,摇匀后静置3 min,倒入1 cm 石英比色皿中,以试剂空白作参比,在波长470 nm 下测定其吸光度,并计算样品中的硫含量。
2 结果与讨论
2.1 吸收波长的选择
取样品浓度16 μg/mL 的硫标准溶液,按照实验方法在200 ~600 nm 进行波长扫描,其吸收曲线显示,在450 ~475 nm 该体系吸收值较稳定,在470 nm波长处体系有最大吸收峰,故实验选择470 nm 为测量波长。
2.2 加入不同酸的稳定性实验
取硫标准溶液,分三组,a 组不加任何酸,b 组加HCl(体积比1 ∶3)1 mL、c 组加HNO3(体积比1 ∶3)1 mL,按文献方法,以相应的试剂空白作参比,测定吸光度值观察30 min,每5 min 记录1 次,结果见图1。
由图1 可知,不加酸的一组测定的吸光度不稳定,忽高忽低,变异系数为9.2%。加酸的两组吸光度均较为稳定,随着时间的延长略有下降。加HCl组吸收值比加HNO3组的吸光度值大,且较稳定,因此,选择在比色体系中加入HCl。
溶液酸度的高低即是H+浓度的高低,它对沉淀反应有一定的影响[9],当溶液中酸度较低或较高时均会影响吸光度的稳定性,需在合适的酸度范围内进行沉淀反应,才能使形成的悬浊液测得的吸光度高而稳定[6,10]。进一步对HCl(体积比1 ∶3)用量进行考察。取硫标准溶液,加入0.50,1.00,1.50,2.00,3.00,4.00,5.00 mL 的HCl(体积比1 ∶3)溶液,按实验方法,以相应的试剂空白作参比,测定吸光度见图2。

图1 加入不同酸的稳定性实验Fig.1 The stability test of different acid

图2 盐酸用量对吸光度的影响Fig.2 The influence on the absorbance of different amount of hydrochloric acid
由图2 可知,当盐酸(体积比1 ∶3)加入量为2 mL 时吸光度值最高。
2.3 胶体保护剂的选择
2.3.1 不加任何胶体保护剂时不同SO2-4 浓度的稳定性实验 分别取0.00,1.00,3.00,4.00,5.00,6.00,8.00 mL 硫标准溶液,至25 mL 容量瓶中,用文献实验方法[11],以相应的试剂空白作参比,静置1 min 后立刻倒入l cm 石英比色皿中,在波长470 nm下测定其吸光度,观察45 min,前10 min 每2 min记录1 次,之后每5 min 记录1 次,见图3。
由图3 可知,不加任何有机试剂时,BaSO4胶体吸光度值在8 min 内较稳定,8 min 后除浓度为4 μg/mL 外其它各个浓度的吸光度值均逐渐下降,浓度越大,吸光度下降越快,是由于BaSO4胶体颗粒沉降造成的。在未添加胶体保护剂的条件下,BaSO4胶体的稳定性较弱,因此需要加入适当的稳定剂。

图3 不加保护剂的稳定性实验Fig.3 The stability test without stabilizer

2.3.2 加入不同有机试剂作保护剂的稳定性实验
胶体稳定剂能控制生成BaSO4晶粒的大小,增加胶粒的亲水性,同时增加介质的粘度,以利于分散相的稳定防止BaSO4胶体颗粒的沉淀,使其在体系中分散均匀、稳定时间长,使测得的吸光度稳定可靠[9]。取4 mL 硫标准溶液,分别加入甘油、丙酮、无水乙醇、吐温80、甘油-乙醇(1 ∶1)各2 mL,按实验方法,以相应的试剂空白作参比,测定吸光度,观察45 min,前5 min 每1 min 记录1 次,之后每5 min 记录1 次,见图4。

图4 保护剂的选择Fig.4 The test of choice stabilizer

由图4 可知,加入丙酮等有机试剂后,胶体吸光度值稳定时间至少达45 min。但不同的保护剂有不同的效果:加丙酮、甘油、无水乙醇、吐温80、甘油-乙醇(1 ∶1)稳定剂均较稳定,但是加甘油-乙醇(1 ∶1)的吸光度值最大且稳定性较好,所以选择甘油-乙醇(1 ∶1)作保护剂。
进一步对胶体保护剂的用量进行考察。取硫标准溶液浓度16 μg/mL 时,分别加入0.5,1.0,2.0,3.00,4.00,5.00 mL 保护剂,按照实验方法,以相应的试剂空白作参比,测定吸光度,见图5。添加保护剂的用量要在适宜的范围内体系才较为稳定,保护剂含量过低使体系稳定性降低,保护剂含量过高使体系不易澄清影响比色。

图5 保护剂用量对吸光度的影响Fig.5 The influence on the absorbance of different amount of stabilizer
由图5 可知,在加入保护剂2 mL 时体系有最大的吸光度值,因此确定保护剂用量为2 mL。
进一步对加入胶体保护剂后不同SO2-4浓度的稳定性进行考察。以甘油-乙醇(1 ∶1)作为胶体保护剂,在不同SO2-4浓度时的稳定性实验,按实验方法,以相应的试剂空白作参比,测定吸光度,观察45 min,前5 min 每1 min 记录1 次,之后每2 min 记录1 次,到10 min 后每5 min 记录1 次,见图6。

图6 加保护剂后不同SO2-4 浓度的稳定性Fig.6 The stability test of stabilizer

由图6 可知,在体系中加入2 mL 甘油-乙醇(1 ∶1)作为胶体保护剂,在不同SO2-4浓度下体系的稳定性较好。
2.4 BaCl2 形态及剂量影响
目前普遍使用的方法是将BaCl2·H2O 晶体研细,过筛0.25 ~0.5 mm 后使用,本实验选用此方法和配制成10%BaCl2溶液作为实验条件进行对比,见图7。
由图7 可知,加入10% BaCl2溶液作为实验条件的稳定性较好,变异系数为0.82%。加入BaCl2·H2O 晶体颗粒的稳定性较差,变异系数为7.5%。在沉淀的形成过程中,加入液体BaCl2则为液-液反应,此时溶液中的微小颗粒相互发生反应,反应速度较快。当加入一定粒级范围内均匀的固体BaCl2时则为固-液反应,不利于BaSO4的形成和均匀悬浮,在30 min 内吸光度呈持续上升趋势。

图7 氯化钡形态的选择Fig.7 The test of form of BaCl2
2.5 BaCl2 溶液用量考察
取标准品浓度16 μg/mL 时,加入2 mL 甘油-乙醇(1 ∶1)保护剂,用去离子水稀释到20 mL 左右,分别加入0.5,1.00,1.50,2.00,3.00,4.00,5.00 mL 10 mg/mL BaCl2溶液,再加入2 mL 25% HCl 溶液,用去离子水稀释至刻度,摇匀,静置3 min,倾入1 cm玻璃比色皿中,以试剂空白作参比,在波长470 nm下测定其吸光度,见图8。

图8 氯化钡用量的选择Fig.8 The test of content of BaCl2
由图8 可知,BaCl2溶液用量在2 ~5 mL 吸光度最大且稳定。
当溶液中BaSO4的结晶速度大于溶解速度时,溶液中BaSO4晶体颗粒数逐渐增加,吸光度逐渐上升,当体系达到平衡时吸光度最高。如果继续加入BaCl2,体系中Ba2+浓度远远超过其沉淀反应所需要的量,导致部分沉淀聚沉并且使沉淀溶解度增大,因此BaCl2加入量需在适量范围内,根据实验结果选择BaCl2加入量2 mL 为宜。
2.6 温度选择
取标准品浓度16 μg/mL 时,按照实验方法,分别在20,30,40,50,60,70,80,90 ℃下加热10 min,冷却,测量吸光度值,分析温度对吸光度的影响。由图9 可知,加热温度20 ~40 ℃吸光度值较稳定,加热温度超过50 ℃后吸光度值呈逐渐下降趋势。温度对硫酸钡比浊法的吸光度的影响有正反两方面,一方面,温度升高可以缩短沉淀的陈化时间加速转化为晶体大颗粒使吸光度增大;另一方面,温度升高使沉淀的溶解度增大吸光度下降。结合本实验的结果,为测定方法简单易行且稳定性好,选择在室温下进行。

图9 温度的选择Fig.9 The test of choose different temperature
2.7 标准曲线
准确称取0.369 7 g 烘至恒重的Na2SO4,去离子水定容至250 mL 容量瓶中,得含量为1.0 mg/mL的储备液,取10 mL 到100 mL 容量瓶中去离子水定容,即稀释了10 倍,得0.1 mg/mL 的标准溶液。在9 个25 mL 容量瓶中,分别加入0.00,1.00,2.00,3.00,4.00,5.00,6.00,7.00,8.00 mL 硫标准溶液,浓度分别为:0.00,4,8,12,16,20,24,28,32 μg/mL,按照选定的样品测定方法测定吸光度,并根据各标准溶液的浓度及相应的吸光度绘制工作曲线(图10),其线性回归方程为:y =0.006 3x-0.000 2,R2=0.998 4。
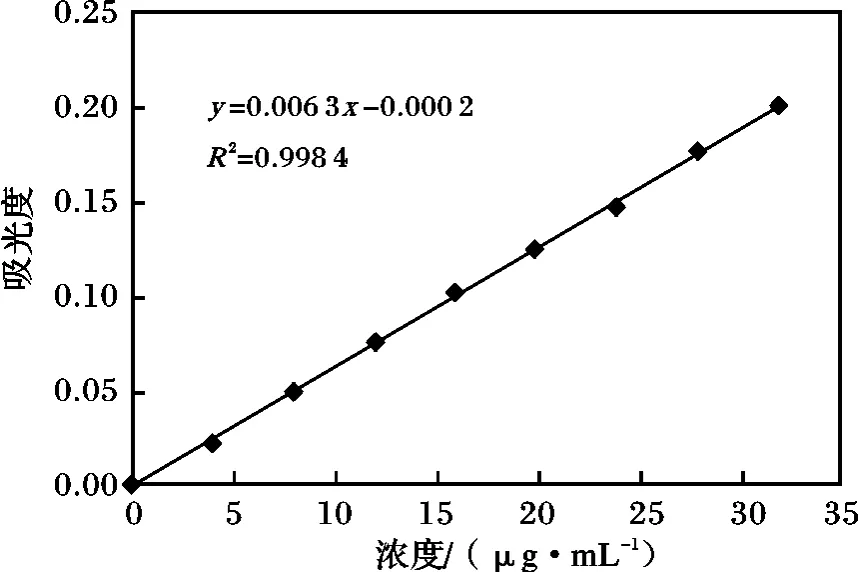
图10 标准曲线Fig.10 The results of sulfur standard curve
2.8 样品量的考察
精密吸取处理好的葡萄样品供试品溶液,分别加入1,2,3,4,5 mL,用选定的方法,测定吸光度,选定样品的量,见图11。
由图11 可知,加入样品2 mL 后吸光度值为0.111,在标准曲线的12 ~20 μg/mL,较合适。

图11 样品量的考察Fig.11 The test of sample amount
2.9 重复性和加样回收率
取同一份样品供试品溶液,用选定的方法,样品平行处理6 次,测定吸光度,计算吸光度值A 的相对标准偏差,RSD 为1.32%,表明该实验方法的重复性良好。
精密称取6 份样品各1 g,分成3 组,各组分别加入对照品溶液,按实验方法测定吸光度,并计算加样回收率和相对标准偏差,结果见表1,平均回收率为99.17%,RSD 为1.89%,符合方法要求的回收率,表明该测定方法可用于植物叶片中硫含量的测定。

表1 回收率实验结果Table 1 The results of recovery experiment
3 结论
在植物中的硫有两种存在形式:有机硫和无机硫,大部分的有机硫以蛋白质形式出现,形态和含量比较稳定;无机硫多以SO2-4的形式在细胞中,含量随着硫素供应水平的变化存在很大的差异。植物从土壤中吸收硫素主要是以SO2-4的形式逆浓度梯度的主动吸收过程进入植物体内,然后通过代谢合成为有机硫固定在细胞中,也可以转移到其他部位被再次利用[1]。同时,植物可以吸收大气中的硫化氢、二氧化硫等供生长发育的需要。植株中SO2-4可作为硫素诊断的指标[12]。
由于不同研究文献中硫酸钡比浊法的比色条件有一定的差异,对于不同的样品材料会产生比较大的误差[8]。本文采用单因素实验对硫酸钡比浊法对测定植物叶片硫含量进行系统的研究,在硫浓度为0 ~32 μg/mL 内与其吸光值有良好的线性关系(r=0.998 4);检测波长经实验测定为470 nm,葡萄叶片提取液2 mL 在甘油-乙醇(1 ∶1)2 mL,10 mg/mL BaCl2溶液2 mL,25% HCl 溶液2 mL,常温下反应的条件下,测定其470 nm 处的吸光值,平均回收率为99.17%,RSD 为1.89%。该法具有操作简单、速度快、准确性高、精密度高、稳定性和重现性好、设备要求低等优点,是检测植物叶片中硫含量可靠方法。
[1] 谢瑞芝,董树亭,胡昌浩.植物硫素营养研究进展[J].中国农学通报,2002,18(2):65-69.
[2] Rennenberg H,Herschbach C,Haberer K,et al.Sulfur metabolism in plants:Are trees different?[J].Plant Biology,2007,9:620-637.
[3] 李金凤.大豆硫素营养及硫肥肥效研究[D].沈阳:沈阳农业大学,2003.
[4] 王东,于振文,樊广华,等.硫素对冬小麦品质和产量的影响[J].山东农业科学,2000,6:10-12.
[5] 郭雪艳,关庆伟,刘畅,等.园林绿化树种香樟叶片的含硫量动态分析[J].城市环境与城市生态,2012,25(4):19-21.
[6] 傅娇艳,丁振华,吴彦慜,等.硫酸钡分光光度比浊法测定高硫环境样品[J].厦门大学学报:自然科学版,2007,46(6):880-883.
[7] 洪渊,黄俊华,张冬鹏.深圳市园林植物叶片含硫量的特点[J].生态科学,2007,26(2):122-125.
[8] 吴名剑,孙贤军,雷启福,等.硫酸钡溶胶比浊法测定烟草中的硫[J].烟草科技,2005(1):24-26.
[9] 丁根娣,吴杰,许志遂.硫酸钡吸光比浊法测定机理的探讨[J].理化检验-化学分册,2001,37(3):111-112.
[10]宋金如,刘淑娟,朱霞萍.测定水中硫酸根方法的概述[J].华东地质学院学报,2002,25(2):64-68.
[11]梁运献.硫酸钡比浊法测定土壤全硫的改进[J].广西农业科学,2002,4:186-187.
[12]洪渊,张冬鹏,黄俊华.硫污染对9 种园林植物叶片硫含量与叶绿素荧光参数的影响[J].生态科学,2006,25(6):558-560.
