以环己胺为模板剂麦羟硅钠石转晶制备镁碱沸石
2015-04-01王瑜吕天明史丽孙江波张守磊孟长功
王瑜,吕天明,史丽,孙江波,张守磊,孟长功
(1.大连理工大学 化学学院,辽宁 大连 116024;2.轻工业环境保护研究所,北京 100089)
沸石分子筛由于具有规整的孔道结构和一定大小的均匀孔道体系,已被作为催化材料、气体分离与吸附剂、离子交换剂等广泛应用于石油与天然气加工、精细化工、环保与核废料处理等方面[1]。其中,镁碱沸石的骨架类型为FER 型,属正交晶系,是一种由硅铝酸盐形成的中孔、高硅沸石。它具有二维的交叉孔道系统,其八元环孔道沿[001]方向大小为0.48 nm ×0.35 nm,十元环孔道是沿[010]方向大小为0.54 nm×0.42 nm[2-3]。镁碱沸石广泛的应用在催化、分离及膜反应器等领域[4-8],例如其在制备异构烯烃的异构化反应中具有良好的催化活性。
镁碱沸石的合成方法主要为水热合成法,也有一些特殊的合成方法,例如:利用硅酸盐固体转化制备镁碱沸石[9-10];非模板剂条件下制备[11-12];在没有无机阳离子的条件下制备[13];在非水体系下高温转化[14]等等。本文采用层状硅酸盐转晶的方法利用环己胺为模板剂将层状硅酸盐麦羟硅钠石(magadiite)转晶制备镁碱沸石。利用X-射线衍射、红外、热重等分析手段对制备出的镁碱沸石进行表征,重点研究了影响转晶的各个因素,并分析了其热稳定性。
1 实验部分
1.1 试剂与仪器
麦羟硅钠石,参照文献合成[15];铝酸钠、氢氧化钾、环己胺均为分析纯;去离子水。
DHG-9053A 型电热恒温鼓风干燥箱;SHZ-D(III)循环水式真空泵;JY5002 电子天平;SX2-4-10马弗炉;反应釜,大连理工大学加工厂;PANalytical X’Pert 型X-射线衍射仪;QUANTA450 型扫描电子显微镜;Nicolet 6700 型傅里叶变换红外光谱仪;Q50型热重分析仪。
1.2 实验方法
称取0.38 g NaAlO2于容积为100 mL 的塑料烧杯中,再依次加入62.55 g H2O、0.20 g KOH 和1.50 g麦羟硅钠石,在室温下搅拌2 h,使液体混合均匀。再向所得浊液中加入4.61 g 环己胺,用玻璃棒搅拌至混匀。将所得溶液转移到反应釜中,密闭,置于恒温箱中,在160 ℃下反应72 h,冷却,抽滤洗涤至滤液无色且呈中性,100 ℃下干燥即得产品。反应初始凝胶组成为:SiO2∶0.07 NaAlO2∶0.14 KOH ∶139 H2O ∶2.0 CHA。
1.3 性能测试
镁碱沸石的结构采用X-射线衍射仪测定,测试条件为:Cu 靶,Kα 射线(λ =0.154 06 nm),管电压为40 kV,管电流为30 mA,扫描范围为4 ~50°/(2θ),扫描速度为8(°)/min。晶体形貌由扫描电子显微镜测定,操作电压为30 kV。合成样品的骨架结构采用傅里叶变换红外光谱仪测定,测定方法为:对KBr 粉末进行加热干燥处理,取少量固体样品于研钵中,加入适量KBr 粉末充分研磨,研细后,在5×107~10 ×107Pa 压力范围下压片,制片的厚度一般为0.01 ~1 mm,直径为0.5 cm。光谱扫描范围400 ~4 000 cm-1,分辨率为4 cm-1,扫描次数为32次,扫描时扣除空气中二氧化碳和水分的干扰。产品的热重曲线由热重分析仪进行测量分析。测定条件为:温度为50 ~800 ℃,升温速率10 ℃/min,载气为空气。
2 结果与讨论
2.1 晶相分析
对所得的样品进行晶型分析,图1 为所合成的麦羟硅钠石(a)和镁碱沸石(b)的XRD 谱图。
由图1a 可知,合成的麦羟硅钠石为纯相且结晶好,可以用来转晶制备镁碱沸石。图1b 是通过麦羟硅钠石转晶合成出的镁碱沸石,其具有典型的FER结构特征并能够完全与标准镁碱沸石的特征峰符合。同时,所得的XRD 谱图基线平稳,衍射峰强度较高而且没有明显的杂峰存在,说明所合成的镁碱沸石具有较高的结晶度以及纯度。
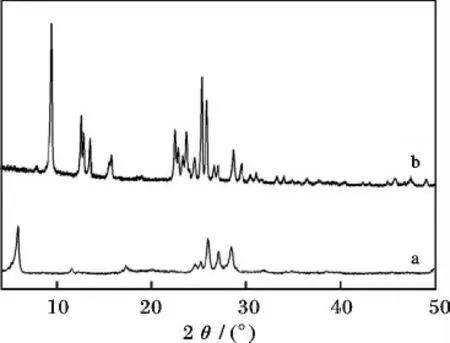
图1 所合成的麦羟硅钠石(a)和镁碱沸石(b)的XRD 图Fig.1 XRD patterns of the synthesized magadiite (a)and ferrierite (b)
2.2 形貌分析
产物的扫描电镜分析见图2。
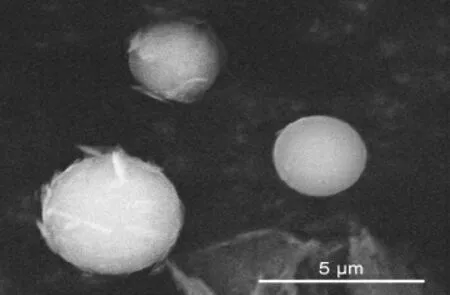
图2 所合成的镁碱沸石的扫描电镜图Fig.2 SEM image of the as-obtained ferrierite
由图2 可知,产物的形貌由球形状小单晶组成,呈现出典型的镁碱沸石晶体形貌。其晶体形貌均一,说明产物为纯相。
2.3 红外光谱分析
样品的红外光谱见图3。

图3 所合成的镁碱沸石的红外谱图Fig.3 IR spectrum of ferrierite
由图3 可知,存在以下几个特征吸收峰:在波数为1 637,3 455 cm-1的吸收峰,归属为水的弯曲振动和结构羟基的伸缩振动;在1 236 cm-1处的尖峰,可归属为T─O 外部四面体的反对称伸缩振动;在590 cm-1处是双五元环的振动峰;在1 024,798,691 cm-1出现的特征吸收峰是T─O 内部四面体的对称和反对称伸缩振动;在465 cm-1处是T─O─T的弯曲振动;在1 485,1 453,1 384 cm-1处的吸收峰可归属为CH2的变形振动,这说明CHA 存在于骨架结构中。
2.4 热分析
图4 是镁碱沸石在不同温度下煅烧1 h 后的XRD 谱图。

图4 所合成的镁碱沸石在不同温度煅烧1 h后的XRD 图Fig.4 XRD pattens of the synthesized ferrierite caclined at different temperature
由图4 可知,当煅烧温度为900 ℃(图4a)时,镁碱沸石结构和结晶度都没有发生任何变化;升高煅烧温度至1 000 ℃时,虽然部分峰强度变弱,但镁碱沸石的特征峰仍然很明显,说明在1 000 ℃(图4b)时镁碱沸石的结构和结晶度还较稳定,未发生太大变化;当温度升高到1 100 ℃(图4c)时,镁碱沸石的结构消失成为无定形结构,在2θ =20 ~30°之间形成较低的峰包,此时镁碱沸石的结构已被破坏。
图5 是镁碱沸石的TG 谱图。

图5 所合成的镁碱沸石的TG 图Fig.5 TG curve of the synthesized ferrierite
由图5 可知,产物的失重分为三个阶段:第一个阶段是在40 ~300 ℃,失重5.32%,为分子筛脱出吸附水;第二个阶段是在300 ~420 ℃,失重2.98%,为分子筛中结构水的脱出;第三阶段为420~580 ℃,失重为1.82%,为分子筛释放模板剂CHA,但从XRD 图可以看出,此时其结构并未塌陷,而且所合成的镁碱沸石在1 000 ℃仍然可以稳定存在。由此可以判断,在镁碱沸石中,模板剂CHA 只起结构导向作用,并不参与分子筛骨架的构成,所以在550 ℃模板剂释放后,其结构和结晶度仍变化不大。
2.5 镁碱沸石合成的影响因素
实验中从初始凝胶的SiO2/Al2O3、碱度、模板剂的用量几个方面考察了各影响因素对麦羟硅钠石转晶制备镁碱沸石的影响。表1 给出了初始凝胶组成和合成的条件对产物晶相的影响。结合样品的XRD 谱图,对不同实验条件下,产物的结果进行详细的分析。

表1 不同实验条件下产物晶相Table 1 Influence of composition of reactants on the synthesized products
2.5.1 SiO2/Al2O3对合成镁碱沸石的影响 图6是在通过改变NaAlO2的加入量而得到不同SiO2/Al2O3下,产物的XRD 谱图。
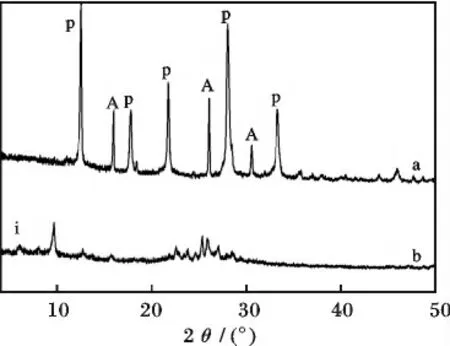
图6 在不同SiO2/Al2O3 下样品的XRD 谱图Fig.6 XRD patterns of the samples at various SiO2/Al2O3
由图6 和表1 可知,当SiO2/Al2O3为10 时,产物为方沸石(ANA)和NaP 沸石;而当增加SiO2/Al2O3到20 时,仍有麦羟硅钠石的特征峰出现,说明在较大SiO2/Al2O3下,初始凝胶中仍有部分麦羟硅钠石未转晶。
2.5.2 碱度对合成镁碱沸石的影响 考察H2O 加入量的改变对实验结果的影响,见图7。

图7 在不同H2O/SiO2 下样品的XRD 谱图Fig.7 XRD patterns of the samples at various H2O/SiO2
由图7 和表1 可知,当H2O/SiO2为104 时,有丝光沸石的杂相;增加H2O/SiO2到144 时,丝光沸石的峰完全消失,同时也有镁碱沸石的特征峰出现,但也有很明显的麦羟硅钠石特征峰出现,并且生成NaP 型沸石,说明若增大H2O/SiO2会抑制丝光沸石的生成,但同时也会抑制麦羟硅钠石的转晶,并生成NaP 型沸石。
2.5.3 模板剂用量对合成镁碱沸石的影响 对模板剂的用量进行考察,以确定模板剂的最佳用量,其结果见图8。

图8 在不同CHA/SiO2 下样品的XRD 谱图Fig.8 XRD patterns of the samples at various CHA/SiO2
由图8 可知,当CHA/SiO2=1.0 时,XRD 谱图中虽然出现了镁碱沸石的特征吸收峰,但是峰强很弱,同时有麦羟硅钠石特征峰出现,说明模板剂用量减少时,仅有少量麦羟硅钠石进行了转晶;而当CHA/SiO2=4.0 时,有较强的镁碱沸石特征峰出现,但同时出现了丝光沸石的特征吸收峰,说明增大模板剂用量,更容易使初始凝胶转晶生成镁碱沸石,晶化程度也会更好,但同时也会使系统生成丝光沸石。
3 结论
(1)采用转晶的合成方法,将麦羟硅钠石转晶制备出镁碱沸石,合成的镁碱沸石纯度高,结晶度好,晶体形貌为球型。
(2)麦羟硅钠石转晶制备镁碱沸石的最佳合成配比为SiO2∶0.07 NaAlO2∶0.14 KOH ∶139 H2O∶2.0 CHA。增大硅铝比会有部分麦羟硅钠石没有转晶,降低硅铝比会有方沸石和NaP 型沸石生成;降低碱度会有部分麦羟硅钠石没有转晶,并且伴有NaP 型沸石的生成,而增大碱度则会生成丝光沸石;模板剂的最佳用量为CHA/SiO2=2,增大至4 会有丝光沸石生成,降低至1 则会有部分麦羟硅钠石没有转晶。(3)合成的镁碱沸石在1 000 ℃时仍能保持晶体的结构,说明合成的镁碱沸石具有很好的热稳定性。
[1] 徐如人,庞文琴.分子筛与多孔化学[M].北京:科学出版社,2004:13-18.
[2] Bonillaa A,Baudouina D,Pérez-Ramírez J.Desilication of ferrierite zeolite for porosity generation and improved effectiveness in polyethylene pyrolysis[J].J Catal,2009,265(2):170-180.
[3] Pinara A B,Mrquez-lvareza C,Grande-Casasa M,et al.Template-controlled acidity and catalytic activity of ferrierite crystalas[J].J Catal,2009,263(2):258-265.
[4] Pan H,Wang X P,Xing N,et al.Effect of sodium in ferrierite on selective catalytic reduction of NO by acetylene[J].Catal Letters,2008,125(1/2):123-129.
[5] Capela S,Catalao R,Ribeiro M F,et al.Methanol interaction with NO2:An attempt to identify intermediate compounds in CH4-SCR of NO with Co/Pd-HFER catalyst[J].Catal Today,2008,137(2/3/4):157-161.
[6] Gil B,Janas J,Wloch E,et al.The influence of the initial acidity of HFER on the status of Co species and catalytic performance of CoFER and InCoFER in CH4-SCR-NO[J].Catal Today,2008,137(2/3/4):174-178.
[7] Xing N,Wang X P,Zhang A F,et al.Eley-Rideal mode of formamide species formation in selective catalytic reduction of NOxby C2H2over ferrierite based catalysts[J].Catal Communication,2008,9(11/12):2117-2120.
[8] Cornelli R A.Skeletal isomerization of linear butenes on boron promoted ferrierite:Effect of the catalyst preparation technique[J].Catal Letters,2008,122(3/4):302-309.
[9] Cheng X W,Wang J,Guo J,et al.High-silica ferrierite zeolite self-transformed from aluminosilicate gel[J].Chemphyschem,2006,7(6):1198-1202.
[10]Kuperman A,Nadimi S,Oliver S,et al.Non-aqueous synthesis of giant crystals of zeolites and molecular sieves[J].Nature,1993,365(6443):239-241.
[11]Rakoczy R A,Breuninger M,Hunger M,et al.Templatefree synthesis of the zeolite ferrierite and characterisation of its acid sites[J].Chem Eng Technol,2002,25(8):273-275.
[12]Suzuki Y,Wakihara T,Itabashi K,et al.Cooperative effect of sodium and potassium cations on synthesis of ferrierite[J].Top Catal,2009,52(1/2):67-74.
[13] Schreyeck L,Caullet P,Mougenel J C.PREFER:A new layered (alumino)silicate precursor of FER-type zeolite[J].Micropor Mesopor Mat,1996,6(5/6):259-271.
[14] Du H B,Qiu S L,Pang W Q.Syntheses of ferrierite and mordenite zeolites from dried gel in alcoholic system[J].Chemical Research in Chinese Universities,1995,11(4):364-366.
[15]W Yu,S Yunshuai,M Changgong,et al.Synthesis of magadiite using a natural diatomite material[J].J Chem Technol Biot,2009,84(12):1894-1898.
