酶辅助提取金银花中绿原酸与多糖的工艺研究
2015-12-24石奇
石奇
(西安文理学院化学与化学工程学院,陕西 西安 710065)
金银花为忍冬科植物忍冬的干燥花蕾或带初开的花[1]。现代药理研究表明,金银花具有抑菌[2]、抗病毒[3]、抗氧化[4]、抗肿瘤[5]等药理作用。金银花绿原酸和金银花多糖同为金银花的主要活性成分,都具有抗细菌、抗氧化和抗肿瘤等功能[6-9]。植物中活性物质的提取方法有多种,如水提法、酶提法、微波辅助提取法、超声辅助提取法等。酶提法具有快速、高效、反应时间短、温和等诸多优点,已应用于植物活性成分的提取上[10-11]。
由于绿原酸和多糖都具有很好的药物活性,在食品、保健、医药和日用化工等多个领域具有重要的应用,而以往的研究一般只提取金银花中的一种有效成分,目前还未见同时提取这两种活性成分的工艺报道,本研究以酶提法为辅助,采用酶法水提醇沉一套工艺将金银花中的绿原酸和多糖一并取出分离,以期同时获得较高得率的绿原酸、多糖,为合理利用药材资源及工业化生产提供实验室理论依据。
1 实验部分
1.1 材料与仪器
乙醇、丙酮、甲醇、磷酸、乙腈、乙酸乙酯、三氯乙酸、无水葡萄糖、苯酚、浓硫酸均为分析纯;金银花药材,产自河北省邢台市;绿原酸标准品(纯度≥98%),购自天津市一方科技有限公司;纤维素酶(酶活力≥400 U/mg)。
RE-52AA 型旋转蒸发仪;LXJ-64-01 型离心机;755B 型分光光度计;YP202N 型电子天平;101 型电热鼓风干燥箱;Nicolet 5700 型红外光谱仪;AGILENTLC12 型高效液相色谱仪。
1.2 绿原酸与多糖提取
取100.00 g 金银花干燥粉末,加入1∶10 的蒸馏水以及一定量的纤维素酶,一定温度提取数次,合并多次提取液与金银花残渣,离心分离,液体减压浓缩,1∶4(体积比)无水乙醇低温沉淀,离心分离。醇沉固体低温真空干燥,8%三氯乙酸脱蛋白,常温搅拌25 min,离心分离,上清液乙醇沉淀,静置,离心,固体用乙醇、丙酮依次进行洗涤,低温真空干燥,得金银花多糖。首次醇沉操作所得液体与金银花料渣混合,回流提取2 h,离心分离,液体减压浓缩,乙酸乙酯纯化处理[12],低温真空干燥,得金银花绿原酸。
1.3 绿原酸含量测定
采用高效液相色谱法测定金银花中绿原酸[13]。色谱柱:C18粒(250 nm×4.6 mm,5 μm),流动相:乙腈∶0. 4% 磷酸(15 ∶85),超声振荡15 min,流速1 mL/min,检测波长254 nm,柱温30 ℃,进样量20 μL,样品在进样前经0.45 μm 滤膜过滤。
精密称取绿原酸对照品0.010 6 g,加50%甲醇溶解并稀释至50.0 mL,即为对照品溶液。精密吸取对照品溶液1.0,2.0,3.0,4.0,5.0 mL 置棕色量瓶中加50%甲醇稀释至10.0 mL 摇匀,按上述色谱条件,以峰面积积分值为纵坐标,浓度为横坐标,得绿原酸标准工作曲线y =20 763x +235.92,相关系数为R2=0.999 3,其线性范围为:21.20 ~106.0 μg/mL。
1.4 多糖含量测定
采用苯酚-硫酸法[14],测定金银花提取物中总糖含量。以葡萄糖为标准样品,分别取标准溶液(质量浓度为10 mg/mL)0.1,0.2,0.3,0.4,0.5,0.6,0.7 mL 依次加水,为1 mL。另取蒸馏水1 mL作空白实验,每支试管加10%苯酚溶液1 mL,摇匀。然后每支试管中缓慢加入H2SO45 mL,并放入冷水中冷却,摇匀。在490 nm 下比色测定,以葡萄糖质量浓度(mg/mL)为横坐标,吸光度为纵坐标,制作标准曲线得方程y=0.030 3x+1.800 1,R2=0.995 8。

2 结果与讨论
2.1 提取温度对绿原酸与多糖得率的影响
取酶用量为0.2%,提取时间为60 min,探讨不同提取温度对金银花绿原酸与多糖得率的影响,实验结果见图1。

图1 提取温度对绿原酸和多糖得率的影响Fig.1 Effects of extraction temperature on yield of chlorogenic acid and polysaccharide
由图1 可知,提取温度为50 ℃时,酶法辅助对绿原酸和多糖的提取效果最好,随着提取温度升高,对多糖提取的影响不大,但使得绿原酸的得率下降,可能是由于体系温度升高导致酶活力下降对绿原酸提取的负面影响较大,而对多糖提取影响较小。
2.2 酶用量对绿原酸与多糖得率的影响
固定提取温度为50 ℃,提取时间60 min,考察不同酶用量对两种产品得率的影响,实验结果见图2。

图2 酶用量对绿原酸和多糖得率的影响Fig.2 Effects of cellulase concentration on extraction yield of chlorogenic acid and polysaccharide
由图2 可知,随着酶用量的增加,提取绿原酸和多糖的得率呈上升趋势,但当酶用量超过0.3% ~0.4%后,有效成分提取得率增效趋于平缓,这主要是由于纤维素酶的加入使得金银花细胞壁破坏,增加了绿原酸和多糖的溶出,随着酶用量的增加,金银花中两种有效成分大部分已溶出,所以继续增加酶浓度将不再显著增加提取效果。
2.3 提取时间对绿原酸与多糖得率的影响
设定提取温度为50 ℃,酶用量为0.4%,比较不同提取时间对产品得率的影响,实验结果见图3。
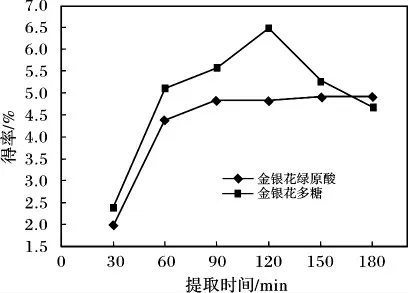
图3 提取时间对绿原酸和多糖得率的影响Fig.3 Effects of extraction time on yield of chlorogenic acid and polysaccharide
由图3 可知,随着提取时间的延长,金银花多糖的提取得率呈先增大后下降的状态,而金银花绿原酸的提取得率呈先增大,到90 min 后再继续延长提取时间对其提取得率的影响不大,这主要是提取时间较长后导致多糖分解,而绿原酸变化不大。
2.4 正交实验优化
根据上述单因素实验探索情况,结合提取温度、酶用量与提取时间3 个因素,各取3 个水平,选用L9(34)的正交表,以绿原酸得率与多糖得率为考察指标,经权重得率(绿原酸、多糖得率权重值各为0.5),对酶辅助提取工艺进行优化,并对结果进行极差分析,确定最优工艺,正交实验结果见表1。
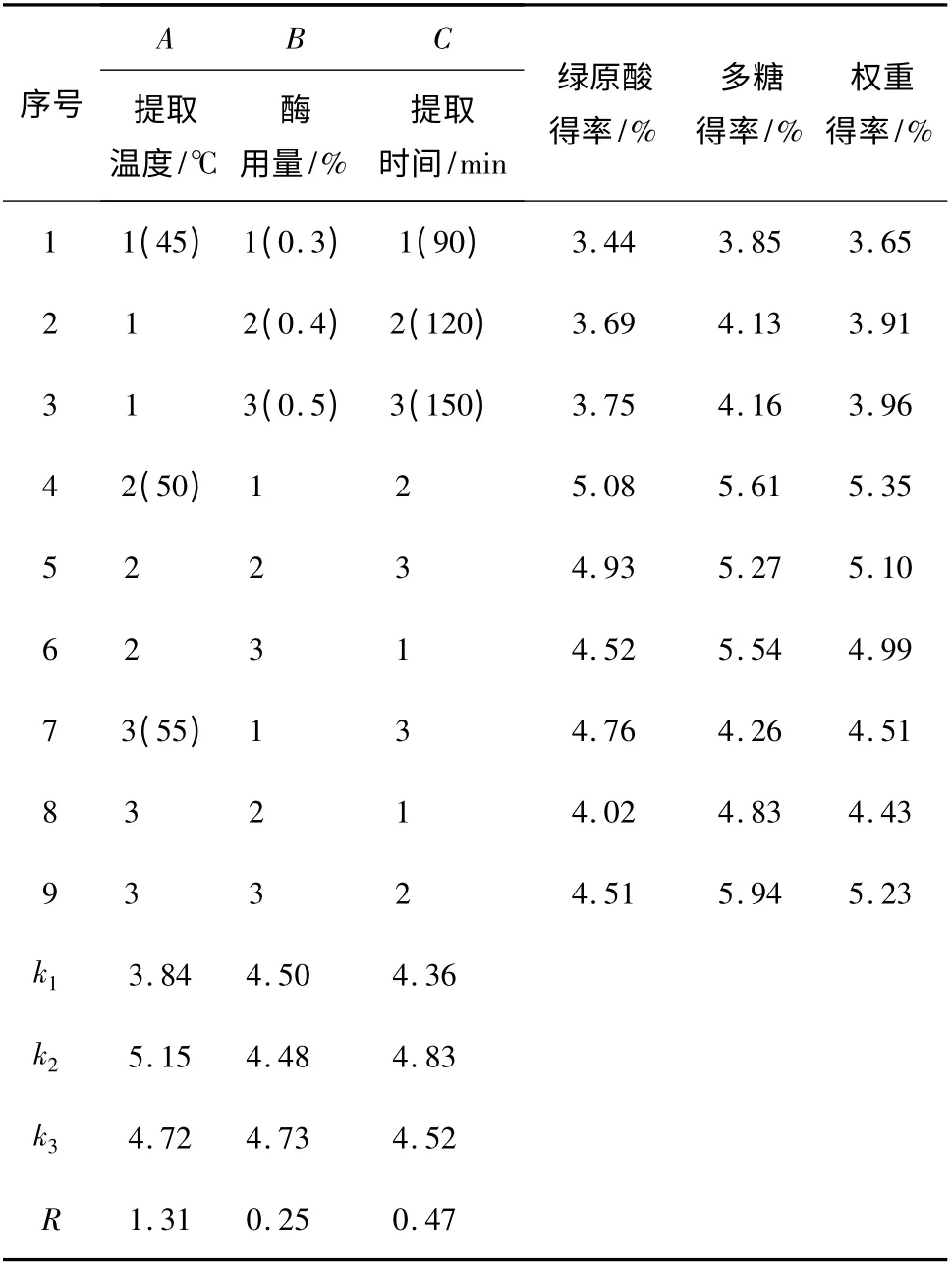
表1 正交实验设计与结果Table 1 Results of orthogonal test
由表1 可知,3 个因素对提取效果的影响程度大小为:提取温度﹥提取时间﹥酶用量,确定最佳的工艺条件为:提取温度50 ℃,提取时间120 min,酶用量0.5%。在该最佳工艺条件下,重复3 次平行实验,得金银花绿原酸平均得率为4.90%,金银花多糖平均得率为6.58%。
2.5 金银花绿原酸HPLC 色谱检测分析
将提取所得金银花绿原酸样品研成细粉,称取细粉约0. 5 g,加入50% 甲醇50 mL,超声处理15 min,放冷,过滤,吸取滤液5 mL,加50%甲醇至25 mL 即为提取样品溶液。取绿原酸对照品(按1.3 节)与提取样品溶液各20 μL 分别进样测定,结果见图4。
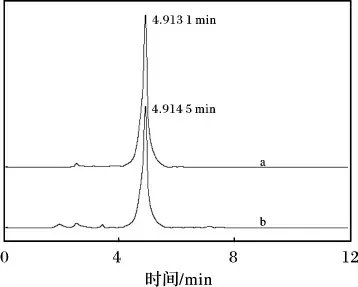
图4 金银花绿原酸HPLC 图Fig.4 HPLC chromatogram of standard chlorogenic acid and chlorogenic acid from Flos Lonicerae
由图4 可知,检测物均在4.91 min 处出现最大吸收峰,可以断定两种物质为同一化合物。
2.6 金银花多糖红外光谱检测分析
提取所得金银花多糖的红外分析见图5。
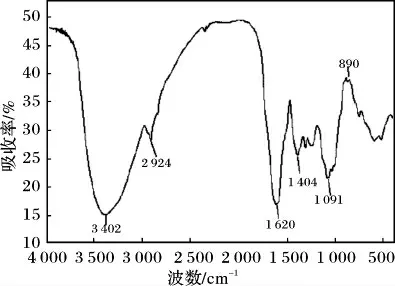
图5 金银花多糖的红外光谱图Fig.5 IR spectra analysis of polysaccharides from Flos Lonicerae
由图5 可知,提取所得多糖具有典型的多糖特征吸收峰[15],3 402 cm-1处的吸收峰是—OH 的伸缩振动吸收峰,2 924 cm-1处是C—H 的伸缩振动吸收峰,波数1 620 cm-1处有 C O 非对称的伸缩振动峰,1 404 cm-1处是C—H 变角振动,1 091 cm-1处为—OH 的变角振动吸收峰,在890 cm-1处存在β-型糖苷键的特征吸收峰,说明金银花多糖为β-多糖。
3 结论
通过该实验,可以在一条工艺下同时实现对金银花绿原酸和金银花多糖这两种活性物质的提取,并得到较好的提取效果。金银花多糖红外分析表明该产物具有多糖的特征吸收峰,并初步断定其结构为β-多糖型。经单因素实验探索,由正交实验得知提取温度影响程度最大,其次是提取时间,酶用量影响最小,确定提取的最佳工艺参数为:提取温度50 ℃,提取时间120 min,酶用量0.5%,得到金银花绿原酸得率为4.90%,金银花多糖得率为6.58%。
[1] 中华人民共和国药典委员会.中华人民共和国药典一部[S].北京:化学工业出版社,2010:152.
[2] 李平,赵成. 金银花水提物及醇提物体外抗菌实验[J].中国当代医药,2010,17(17):48-50.
[3] 胡克杰,王跃红,王栋.金银花中绿原酸在体外抗病毒作用的实验研究[J].中医药信息,2010,7(3):27-28.
[4] 宫璀璀,郑玉霞,郑乃刚,等. 金银花在体内抗氧化作用的实验研究[J]. 实用医药杂志,2006,23(5):584-585.
[5] 刘玉国,刘玉红,蒋海强.金银花多糖对小鼠S180 肉瘤的抑制作用与机制研究[J]. 肿瘤学杂志,2012,18(8):584-587.
[6] 吴卫华,康桢,欧阳冬生,等. 绿原酸的药理学研究进展[J].天然产物研究与开发,2006,18(4):691-694.
[7] 王辉,田呈瑞,马守磊,等.绿原酸的研究进展[J]. 食品工业科技,2009,30(5):341-345.
[8] 林雄平,陈晓清,苏育才,等. 金银花和苦丁茶多糖提取物抗菌活性研究[J]. 亚热带植物科学,2008,37(1):51-53.
[9] 苏香萍,龚大春,张亚雄,等. 二氧化碳超临界萃取金银花挥发油化学成分的研究[J]. 时珍国医国药,2007,18(11):2643-2644.
[10]钱志伟,王会晓,杨海蛟,等.酶法提取马齿苋多糖[J].中国农学通报,2011,27(5):475-478.
[11]白海波,王剑飞,周蒂.金银花提取条件对绿原酸含量的影响[J].中国现代应用药学杂志,2003,20(2):130-132.
[12]游庆红,尹秀莲,朱昱.金银花中绿原酸的提取纯化方法研究[J]. 安徽农业科学,2009,37(24):11549-11550.
[13]包卫华.不同产地的金银花中绿原酸含量的研究比较[J].时珍国医国药,2007,18(7):5071-5072.
[14]罗毅,潘细贵,刘刚,等.苯酚-硫酸法测定多糖含量显色方式的优选[J]. 中国中医药信息杂志,2005,12(1):45-46.
[15]宁永成. 有机化合物结构鉴定与有机波谱学[M]. 北京:科学出版社,2002.
