IL-17、IL-33在哮喘发病机制中的作用
2015-04-01陈旭央胡莉蔓
陈旭央 张 冰 胡莉蔓
浙江省乐清市人民医院儿科,浙江乐清 325600
支气管哮喘是一种以黏液分泌过多、 气道高反应性、上皮下纤维化、慢性气道炎症为特征的慢性特异性呼吸道疾病[1]。 作为常见的呼吸道疾病,哮喘的发病率逐年增高,临床上具有发病机制复杂、周期性、长期性和反复性的特点。 国内外研究表明,哮喘是由多种炎性细胞及其产生的细胞因子共同参与的炎性反应慢性气道疾病[2]。 白细胞介素17(interleukin 17,IL-17)和白细胞介素33(interleukin 33,IL-33)是近来发现的两种细胞因子[3-4],在多种免疫性疾病中起着重要的作用。为探讨IL-17、IL-33 在儿童哮喘发病机制中的作用, 本文以乐清市人民医院(以下简称“我院”)收治的82 例哮喘患儿作为研究对象,检测肺功能指标、血清细胞因子及炎症细胞水平,并分析细胞因子水平与哮喘患儿肺功能的关系,现将结果报道如下:
1 资料与方法
1.1 一般资料
选择我院2011 年2 月~2014 年8 月收治的82例哮喘患儿作为研究对象,根据患儿的临床表现分为急性发作组、缓解期组,并选取同期健康儿童作为对照(健康组)。急性发作组45 例,男27 例、女18 例;年龄1.5~10岁,平均(5.64±3.19)岁。 缓解期组37 例,男23 例、女14 例;年龄2~11 岁,平均(5.98±3.31)岁。 健康组40 例,男25 例、女15 例;年龄2~12 岁,平均(6.13±3.37)岁。 三组儿童的年龄、性别一般资料比较,差异无统计学意义(P >0.05),具有可比性。
纳入标准:①急性发作组和缓解期组患儿的诊断均符合中华医学会儿科学分会呼吸学病组2008 年制订的《儿童支气管哮喘及防治指南》中的诊断标准;②健康组儿童来自于到我院儿保科进行常规保健的健康儿童;③该研究获得所有参与研究的儿童监护人的知情同意。
排除标准:①合并结核病、系统性红斑狼疮的患儿;②近期使用过糖皮质激素或免疫抑制剂治疗的患儿;③合并肝肾功能障碍或其他免疫性疾病的患儿。
1.2 方法
1.2.1 标本采集 研究组及对照组儿童分别留取空腹静脉血3 mL, 置于含有乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)的抗凝管中,室温下静置1 h, 血液凝固后在4000 r/min 的离心机中进行离心10 min,留取血清,保存于-20℃冰箱备检。
1.2.2 主要仪器 见表1。

表1 主要仪器及型号
1.2.3 检测方法 采用美国eBioscience 公司生产的试剂盒, 采用酶联免疫吸附法检验IL-17、IL-33、 白介素-5(IL-5)、白介素-4(IL-4)、γ-干扰素(IFN-γ)。 采用日立全自动7080 生化分析仪测定免疫球蛋白IgE水平;其中试剂购于中生北控生物科技有限公司。 肺功能选用我院呼吸内科肺功能仪 (型号:MicroQuark,意大利科时迈公司),检测用力肺活量(FVC)、第1 秒用力肺活量(FEV1)、呼气高峰流量(PEF)、75%、50%及25%的肺活量最大呼气流速(V75、V50、V25)。
1.2.4 观察指标 检测三组儿童的IL-17、IL-33、IL-5、IL-4、IFN-γ、免疫球蛋白E(IgE)、中性粒细胞、白细胞、淋巴细胞测定值,同时检测急性发作组、缓解期组儿童的肺功能指标:FEV1、PEF、V75、V50、V25, 并采用实测值/预计值的百分比表示, 即FEV1%、PEF%、V75%、V50%、V25%。
1.3 统计学方法
采用统计软件SPSS 17.0 对数据进行分析, 正态分布计量资料以均数±标准差()表示,多组间比较采用方差分析,两两比较采用LSD-t 检验。 计数资料以率表示,采用χ2检验。 以P <0.05 为差异有统计学意义。
2 结果
2.1 哮喘患儿的肺功能指标情况
缓解期组患儿的PEF%、FEV1%、V50%、V25%均显著优于急性发作组患儿,差异有统计学意义(P <0.05)。见表2。
表2 不同分期哮喘患儿的肺功能指标检测情况()
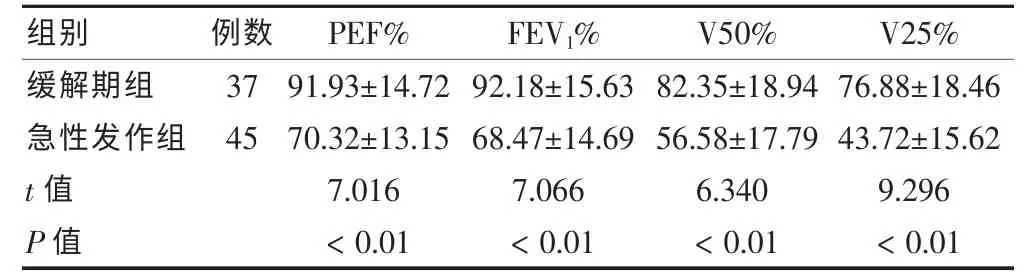
表2 不同分期哮喘患儿的肺功能指标检测情况()
注:PEF%:呼气高峰流量实测值/预计值;FEV1%:第一秒用力肺活量实测值/预计值;V50%:50%的肺活量最大呼气流速实测值/预计值;V25%:25%肺活量最大呼气流速实测值/预计值
?
2.2 三组的血清细胞因子检测情况
缓解期组、急性发作组、健康组的IL-17、IL-5、IL-4、IFN-γ、IgE 水平比较, 差异有统计学意义 (P <0.05),两两比较显示健康组低于缓解期组,缓解期组低于急性发作组,差异均有统计学意义(P <0.05);三组研究的IL-33 水平比较,差异无统计学意义(P >0.05)。见表3。
2.3 三组的白细胞、中性粒细胞、淋巴细胞水平比较
三组儿童的中性粒细胞、 淋巴细胞百分比差异均有统计学意义(P <0.05),组间两两比较差异均有统计学意义(P <0.05)。 见表4。
表3 三组的细胞因子水平比较()
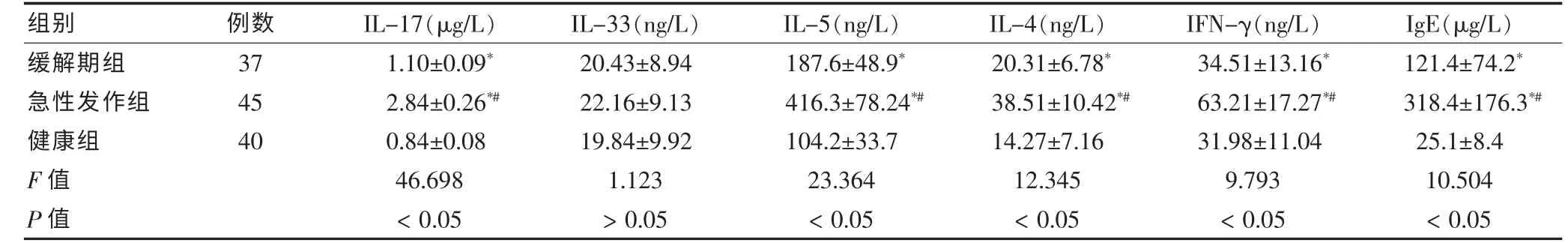
表3 三组的细胞因子水平比较()
注:与健康组比较,*P <0.05;与缓解期组比较,#P <0.05;IL-17:白介素-17;IL-33:白介素-33;IL-5:白介素-5;IL-4:白介素-4;IFN-γ:γ-干扰素;IgE:免疫球蛋白E
组别 例数 IL-17(μg/L) IL-33(ng/L) IL-5(ng/L) IL-4(ng/L) IFN-γ(ng/L) IgE(μg/L)缓解期组急性发作组健康组F 值P 值37 45 40 1.10±0.09*2.84±0.26*#0.84±0.08 46.698<0.05 20.43±8.94 22.16±9.13 19.84±9.92 1.123>0.05 187.6±48.9*416.3±78.24*#104.2±33.7 23.364<0.05 20.31±6.78*38.51±10.42*#14.27±7.16 12.345<0.05 34.51±13.16*63.21±17.27*#31.98±11.04 9.793<0.05 121.4±74.2*318.4±176.3*#25.1±8.4 10.504<0.05
表4 三组的白细胞总数、中性粒细胞、淋巴细胞百分比()
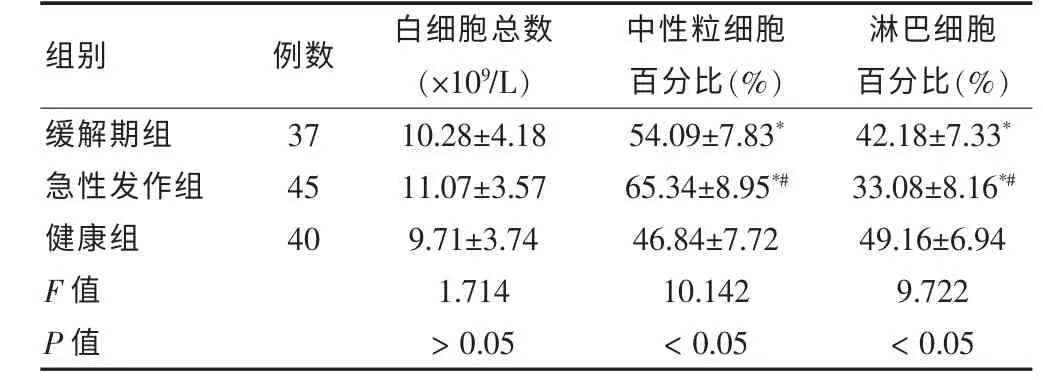
表4 三组的白细胞总数、中性粒细胞、淋巴细胞百分比()
注:与健康组比较,*P <0.05;与缓解期组比较,#P <0.05
组别 例数 白细胞总数(×109/L)中性粒细胞百分比(%)淋巴细胞百分比(%)缓解期组急性发作组健康组F 值P 值37 45 40 10.28±4.18 11.07±3.57 9.71±3.74 1.714>0.05 54.09±7.83*65.34±8.95*#46.84±7.72 10.142<0.05 42.18±7.33*33.08±8.16*#49.16±6.94 9.722<0.05
2.4 细胞因子水平与哮喘患儿肺功能炎症细胞的关系
急性发作组患儿的IL-17、IL-5、IL-4、IFN-γ 与患儿的FEV1%、PEF%呈负相关,与中性粒细胞百分比呈正相关;IgE 与患儿的FEV1%、PEF%无显著的相关性,与中性粒细胞百分比值呈显著的正相关。 见表5。
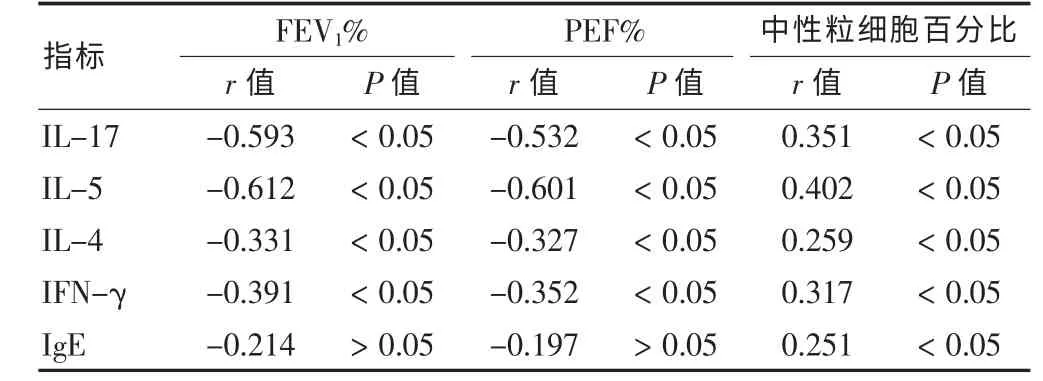
表5 细胞因子水平与哮喘患儿肺功能的相关性
3 讨论
哮喘又被称为支气管哮喘,属于临床中较为常见的慢性呼吸道疾病,主要是由多种炎症细胞参与的气道慢性炎症[5-6]。 在该病的发展过程中中性粒细胞、嗜酸性粒细胞、 肥大细胞、T 淋巴细胞等均扮演了重要的角色。 据报道[7]我国儿童支气管哮喘的患病率在近几十年间均呈上升趋势。 支气管哮喘的发生与环境、遗传、内分泌及免疫等因素有关。 患者自身的免疫失调在哮喘的发病过程中起到重要作用[8]。 作为一种急诊科较为常见的危重急症,哮喘的主要特征为气道重塑、气道慢性炎症、气道高反应性。气道炎症是因为嗜酸性粒细胞浸润气道而引起气道过敏反应,使气道的高反应性增加[9]。该病会导致患者气道的高反应性,出现可逆性的气流限制,引发患者出现喘息、胸闷以及咳嗽等临床症状,在夜间或者清晨的发作次数较多[10]。重症哮喘的临床症状较为严重, 且伴有呼吸肌疲劳,合并急性的呼吸衰竭, 严重影响着患儿的生活质量,甚至危及患儿的生命。
哮喘的发病机制及其复杂,目前普遍认为其发病的关键是辅助性T 细胞1 型(Th1)/辅助性T 细胞2型(Th2)细胞失衡,此时Th1 型免疫反应减弱但Th2 型免疫反应异常增强[11-12]。 作为Th2 的细胞因子,IL-4、IL-5 会使变应原特异的IgE 增加和气道嗜酸粒细胞浸润,导致气道高反应性和气道慢性炎症[13-14]。 血清IgE 是观察儿童哮喘的重要指标之一,IgE 含量升高可通过释放炎症介质导致乳膜肿胀、支气管平滑肌痉挛、气道狭窄、通气功能下降[15-16]。 IL-33 是一种可以引起组织免疫病理损伤的前炎症细胞因子,在自身免疫性疾病和慢性炎症中起着重要的作用[17]。 TH17 是一种最新在研究自身免疫性疾病中发现的不同于Th1 和Th2 的Th 细胞亚群,能产生IL-17。 现有研究[18-19]表明银屑病、系统性红斑狼疮、类风湿性关节炎、脑脊髓炎、多发性硬化症等疾病的发病都有Th17/IL-17 的参与。因此,研究Th17/IL-17、IL-33 等在哮喘发病中的作用,对于其完善发病机制具有重要的意义。
IL-4,IFN-γ 分别为Th2、Th1 分泌的特征性细胞因子。 IL-4 可促进Th0 转变为Th2 且抑制Th1 的功能[20];通过增强B 淋巴细胞可溶性低亲和力IgE 受体的表达及转录能力使机体内IgE 合成增加, 进而IgE的体液免疫和自然杀伤细胞的杀伤能力增强;促进嗜酸性粒细胞聚集及其对内皮细胞的黏附, 因此IL-4会改变Th 1 /Th2 的平衡在哮喘发病过程中起到重要的促炎作用。 与IL-4 相反,IFN-γ 会促进Th1 细胞分化,阻碍Th2 细胞的形成,减少IL-4 的分泌[21],使IgE水平、支气管肺泡灌洗液中浸润细胞数量、气道高反应性降低,故起到保护哮喘的作用。 在动物实验中发现[22]IL-33 可使Th2 细胞、树突细胞、嗜碱性粒细胞、嗜酸性粒细胞核肥大细胞募集并活化,在这些细胞释放的细胞因子和趋化因子的作用下加速哮喘的发生。Th17/IL-17 能加重哮喘的气道高反应和气道炎症。IL-17 通过增强中性粒细胞趋化因子IL-8 使中性粒细胞在气道内募集[23],上调Th2 介导的嗜酸性粒细胞性气道炎症。 在IL-17 的刺激作用,支气管上皮细胞和肺成纤维细胞释放IL-6[24],从而使气道黏液高分泌,参与气道重构。即IL-17 可通过诱导多种细胞因子表达而参与到哮喘的发病中。 本研究结果显示:缓解期组、 急性发作期组、 健康组儿童血清中IL-17、IL-5、IL-4、IFN-γ、IgE 水平差异有统计学意义(P <0.05),且健康组<缓解期组<急性发作组(P <0.05),但IL-33 血清水平差异无有统计学意义(P >0.05);急性发作 组 患 儿 的IL-17、IL-5、IL-4、IFN-γ 与 患 儿 的FEV1%、PEF%呈负相关,与中性粒细胞百分比呈正相关。 因此,L-17、IL-4 及IL-5 等细胞因子在儿童哮喘发病中发挥一定作用, 而IL-33 与哮喘的发病无关,与相关研究[25-26]结果一致。
综上所述,IL-17、IL-4 及IL-5 等细胞因子在支气管哮喘发病机制中发挥着重要的作用,并参与其发病过程。由于哮喘的发病机制复杂、发病原因多,目前临床治疗较为困难。 因此, 深入研究IL-17、IL-4 及IL-5 等细胞因子所起到的作用和治疗方法, 对开发高效治疗哮喘药物、提高哮喘患者的生活质量具有重要的现实意义。
[1] 蒋群芳.儿童支气管哮喘血清IL-4,IL-13 及IgE 水平变化的意义[J].国际检验医学杂志,2013,34(11):1446-1447.
[2] Izuhara K,Ohta S,Shiraishi H,et al. The mechanism of mucus production in bronchial asthma [J]. Current medicinal chemistry,2009,16(22):2867-2875.
[3] 任建立,徐青.IL-33,IL—15 在儿童哮喘发病中的作用研究[J].中国妇幼保健,2014,29(6):904-906.
[4] Park H,Lee CM,Jung ID,et al. Quercetin regulates Th1/Th2 balance in a murine model of asthma [J]. International immunopharmacology,2009,9(3):261-267.
[5] 杨华,黄桂红.Th1/Th2 细胞因子失衡在哮喘发病机制中的作用[J].临床肺科杂志,2013,18(12):2271-2272.
[6] 苗伟伟,汪凤凤,刘洪泱,等.支气管哮喘气道重塑的新视角:免疫球蛋白E[J].中华结核和呼吸杂志,2013,36(5):367-369.
[7] 张春霞,陈柏谕.IL-33 与儿童常见自身免疫性疾病关系的研究进展[J].临床儿科杂志,2014,32(5):491-493.
[8] 周宏斌,陈志华,李雯.Th17 细胞及白细胞介素17A 在慢性气道炎症性疾病中的作用[J].中国病理生理杂志,2012,28(3):560-564.
[9] 龚臣,邓静敏.Th17/Treg 在支气管哮喘发病机制中的作用及研究进展[J].国际呼吸杂志,2013,33(9):684-688.
[10] 韩文宁,李锦亮.咳嗽变异性哮喘患者白细胞介素-4,5及IgE 水平的变化[J].中国生育健康杂志,2013,24(2):615-616.
[11] 刘金凤.哮喘患儿嗜酸性粒细胞,IL-4 及IFN-γ 检测的临床意义[J].中国儿童保健杂志,2014,22(1):96-97.
[12] Borish L,Steinke JW. Interleukin-33 in asthma: how big of a role does it play?[J].Current Allergy And Asthma Reports,2011,11(1): 7-11.
[13] 涂国华,钱金强,易阳等.哮喘儿童不同时期血清白细胞介素-8、白细胞介素-17 及痰液中性粒细胞的变化[J].中国小儿急救医学,2012,19(5):521-523.
[14] 姚圣连,徐美玉,钱金强,等.辅助性T 细胞17 及白介素-17 在呼吸道合胞病毒毛细支气管炎的表达及作用[J].临床儿科杂志,2013,31(9):850-853.
[15] 刘瑜.IL-17/Th17 及Th1/Th2 在儿童哮喘中的作用研究[D].广州:南方医科大学,2013.
[16] Liew FY,Pitman NI,McInnes IB.Disease-associated functions of IL-33: the new kid in the IL-1 family [J]. Nature Reviews Immunology,2010,10(2):103-110.
[17] Préfontaine D,Lajoie-Kadoch S,Foley S,et al. Increased expression of IL-33 in severe asthma:evidence of expression by airway smooth muscle cells[J].The Journal of Imm unology,2009,183(8): 5094-5103.
[18] Liu X,Li M,Wu Y,et al. Anti-IL-33 antibody treatment inhibits airway inflammation in a murine model of allergic asthma [J]. Biochemical and Biophysical Research Communications,2009,386(1): 181-185.
[19] Smith DE. IL‐33: a tissue derived cytokine pathway involved in allergic inflammation and asthma [J]. Clinical& Experimental Allergy,2010,40(2): 200-208.
[20] Lloyd CM. IL-33 family members and asthma-bridging innate and adaptive immune responses [J]. Current Opinion In Immunology,2010,22(6): 800-806.
[21] Schnyder-Candrian S,Togbe D,Couillin I,et al. Interleukin-17 is a negative regulator of established allergic asthma [J]. The Journal of Experimental Medicine,2006,203(12): 2715-2725.
[22] Song C,Luo L,Lei Z,et al. IL-17-producing alveolar macrophages mediate allergic lung inflammation related to asthma [J]. The Journal of Immunology,2008,181(9):6117-6124.
[23] 赵燕,程晓明,王长征,等.Th17 应答在哮喘发病机制中作用的研究进展[J].重庆医学,2013,42(2):216-218
[24] 方丽萍.激素抵抗型哮喘发病机制的研究进展[J].医学研究生学报,2013,26(10):1113-1116.
[25] 刘淑萍,马冉,李祥安,等.支气管哮喘患儿白细胞介素33与气道炎性反应的相关性研究[J].疑难病杂志,2013,12(6):422-424,,封3.
[26] 孙博文,唐颖,李晓丹,等.支气管哮喘患者外周血中IL-33 水平的检测及其在支气管哮喘发病机制中的作用[J].吉林大学学报:医学版,2014,40(2):395-398.
