紫菜腐霉侵染对条斑紫菜叶状体防御性物质含量及保护性酶类活性的影响❋
2015-03-31张晓南孙佩佩茅云翔邹丹丹唐祥海莫照兰
张晓南, 孙佩佩, 茅云翔❋❋, 邹丹丹, 唐祥海, 莫照兰
(1.中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003; 2.中国海洋大学海洋生命学院,山东 青岛 266003;3.农业部渔业资源可持续发展重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071)
紫菜腐霉侵染对条斑紫菜叶状体防御性物质含量及保护性酶类活性的影响❋
张晓南1,2, 孙佩佩1,2, 茅云翔1,2❋❋, 邹丹丹1,2, 唐祥海1,2, 莫照兰3
(1.中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003; 2.中国海洋大学海洋生命学院,山东 青岛 266003;3.农业部渔业资源可持续发展重点实验室,中国水产科学研究院黄海水产研究所,山东 青岛 266071)
研究了紫菜腐霉侵染对条斑紫菜叶状体防御性物质脯氨酸(Pro),保护性酶类苯丙氨酸转氨酶(PAL)、多酚氧化酶(PPO),防御信号活性氧(ROS)和细胞损伤指示性物质丙二醛(MDA),在不同时间点(0、1、3、5、7、9 d)的含量和活性影响。实验结果表明:紫菜腐霉侵染能够打破细胞ROS的动态平衡,引起ROS含量极显著增加(P<0.01),进而影响细胞渗透压平衡,表现为Pro含量极显著增加(P<0.01),并导致细胞内保护酶类PAL和PPO活性极显著增加(P<0.01),并且ROS积累引起细胞膜脂过氧化,MDA含量发生极显著变化(P<0.01)。由此推测条斑紫菜叶状体对紫菜腐霉侵染的生理响应过程为:紫菜腐霉侵染引起藻体ROS含量积累上升,积累的ROS激活机体防御系统,Pro含量增加以调节细胞渗透平衡;同时积累的ROS激活细胞内保护酶类,PAL和PPO的活性增强。迅速积累的ROS引起细胞损伤,导致细胞膜脂过氧化,产生并积累MDA。本实验为全面了解条斑紫菜防御紫菜腐霉侵染的机制奠定了基础,同时为后续条斑紫菜赤腐病抗性品系的选育提供了理论指导。
条斑紫菜;紫菜腐霉;侵染;防御性物质;保护酶类;丙二醛
条斑紫菜(Pyropiayezoensis)是中国重要的经济海藻,在中国北方地区被广泛栽培。条斑紫菜在其进化过程中不断适应潮间带重复性干露和复水的环境,因此具有很强的抗逆能力,能够适应潮间带温度、光强、渗透压等的急剧变化,成为潮间带海藻的典型代表,具有重要的科研价值[1]。近年来,随着紫菜栽培面积的不断扩大,海区环境不断恶化,病原菌的侵染以及种质退化问题,导致紫菜病害时有发生[2-3]。紫菜病害的发生,不仅降低了紫菜品质,而且导致大面积减产,甚至绝收,给养殖户带来了巨大损失[4]。
目前,国内外对于高等植物的抗病性相关的生理生化变化已做了大量研究,并取得相应的研究成果。防御性物质Pro可以通过调节渗透压来保护细胞膜系统的完整性,周宝利等[5]研究了嫁接茄子抗病性与电导率和游离脯氨酸含量变化的关系。保护性酶类PAL和PPO在植物抗病反应中有重要的生理意义,杨家书等[6]研究了小麦白粉病的发生与机体内苯丙氨酸转氨酶(PAL)和多酚氧化酶(PPO)活性的关系,Friend等[7]研究了马铃薯晚疫病发病过程中机体内苯丙氨酸转氨酶(PAL)和多酚氧化酶(PPO)活性的变化,并指出PAL和PPO 2种酶与植物的抗病性呈正相关。近年来,活性氧ROS因广泛存在并具有重要生理功能而受到广泛研究[8-9]。氧爆发不仅对入侵的病原菌有细胞毒害作用,还可以作为一种信号激活寄主植物进一步的防御反应,比如过敏性细胞死亡[10]。尽管高浓度的ROS会对细胞产生损害作用,但其在植物-病原菌互作反应中的防御信号作用不容忽视[11]。如Doke等[12]研究发现了烟草花叶病毒(TMV)侵染烟草后引起感染叶片活性氧爆发,Sekizawa等[13]在研究水稻稻瘟病时也发现了在菌株侵染水稻时有大量活性氧释放,他们认为ROS在植物抗病过程中发挥了重要作用。细胞损伤指示物质MDA是细胞膜脂过氧化的产物,其含量可以反应细胞受损伤程度。Radwana等[14]在黄色花叶病毒感染南瓜叶子的过程中,将MDA作为细胞受到破坏的直接相关物质。藻类对病原菌的生理生化响应虽然也有一些报道。在墨角藻的研究中发现脯氨酸可以抑制细菌的附着[15];Bouara等[16]在内生病原菌对角叉菜配子体侵染的研究中观察到PAL活性的升高;在对海带病烂研究中也发现了PAL和PPO活性的动态变化[17]。在藻类中也发现了病原菌侵染时的ROS积累,Weinberger等[18-19]在对江蓠属红藻(Gracilariasp.)的研究中发现,其在受到琼胶寡糖刺激时,可迅速检测到H2O2的积累。彭金良等[20]研究了非生物胁迫对小球藻的影响,发现α-萘酚会引起细胞膜不饱和脂肪酸的过氧化,导致脂质过氧化物MDA的形成。但迄今为止,未见有关条斑紫菜应对病原菌侵染响应机制的报道。
条斑紫菜赤腐病(red rot disease)是由紫菜腐霉(Pythiumporphyrae)引起的一种严重危害条斑紫菜生长的卵菌病害。该病首先由Arasaki[21-22]报道,由Takahasi[23]定名;马家海等首次报道了中国条斑紫菜赤腐病的发生,并分离纯化出紫菜腐霉[24]。国内外关于紫菜腐霉的生长发育[25-26]、对紫菜的侵染过程[27]、对宿主细胞的识别与附着机理[28]已有研究,但研究主要集中于病害的预防监测[29-30],对藻体抗病相关研究较少。Uppalapati等[31]、Park等[32]利用紫菜腐霉侵染产生的病斑个数、病斑面积等指标对几种紫菜做了抗病性评价,而对抗病生理生化方面的研究未见报道。因此,研究紫菜腐霉侵染对条斑紫菜叶状体生理生化指标的影响,探讨条斑紫菜叶状体对紫菜腐霉侵染的响应机制,对条斑紫菜赤腐病抗性品系的选育有重要价值。
为此,本研究以条斑紫菜叶状体和紫菜腐霉为实验材料,研究了在紫菜腐霉侵染条件下条斑紫菜叶状体防御性物质脯氨酸(Pro),保护性酶类苯丙氨酸转氨酶(PAL)、多酚氧化酶(PPO),防御信号活性氧(ROS)和细胞损伤指示性物质丙二醛(MDA),在不同时间点(0、1、3、5、7、9 d)的含量和活性变化,旨在初步了解条斑紫菜叶状体对紫菜腐霉侵染的机体响应机制,为全面认识条斑紫菜的抗病机理奠定基础,为条斑紫菜抗病性综合评价指标体系的建立提供依据,同时为后续条斑紫菜抗病品种的选育提供理论指导。
1 材料与方法
1.1 实验材料及培养基
条斑紫菜叶状体是2014年2—4月采自青岛湛山湾(36° 03′ 07.5″ N; 120° 21′ 45.6″ E),0~4℃低温下12 h内带回实验室。叶状体经过无菌海水刷洗以去除表面沉淀和附着的杂藻。清洗后的紫菜在实验室条件(10 ℃,32 ppt,60~80 μmol photons m-2·s-1,12 D∶12 L)驯化2~3 d,每3d添加一次PES营养盐[33]。选择生理状态良好、长度在3~4 cm的健康紫菜用于后续感染实验。
病原菌紫菜腐霉分离自江苏紫菜栽培海区,菌株编号为OUCPABTP005。紫菜腐霉培养在玉米琼脂板上[34]。
1.2 紫菜腐霉侵染条斑紫菜叶状体
1.2.1 紫菜腐霉孢子的诱导 紫菜腐霉孢子诱导方法参照Uppalapati和Addepalli[35-36],0.5 g的菌丝加入到100 mL CaCl2浓度为10 mmol·L-1的半海水(海水与蒸馏水的体积比为1:1)中,15 ℃下120 r/min振荡培养,期间每隔1 h换1次半海水培养基,进行4~5次。15 h后用筛绢滤去菌丝得到孢子悬液,并在显微镜下对孢子浓度进行计数。
1.2.2 人工感染 紫菜叶片经过0.7% 的KI溶液浸泡除菌10min后,用灭菌海水冲洗3次,置于装有1L孢子悬液的锥形瓶中进行人工感染实验(温度15℃,其它实验条件与正常培养相同)。设置实验组和对照组,实验组孢子浓度103ind·mL-1,对照组不加孢子。叶状体密度为1g·L-1。每隔1d分别取实验组和对照组样品测定各项生理指标。每个处理组分别设置4个平行。记录每个实验组发病叶片数和每一叶片的病斑面积。
1.3 病情指数和生理生化指标的测定
1.3.1 病情指数的测定 紫菜叶片病斑面积的计算:取不同感染时间(0、1、3、5、7、9 d)的叶片30个进行数码拍照,参照文献[37]的方法计算病斑率:(1)将坐标纸平铺在白瓷盘上,作为拍照背景底板。(2)将待测叶片平展于坐标上。(3)用适当的拍摄分辨率、图像存贮像素和拍摄角度对叶片进行拍摄,拍摄结束后将图片导入计算机。(4)在Photoshop图像处理软件中打开叶片图像,分别选取图片中叶片部分及病斑区域,然后打开菜单中“图像”,选取“直方图”选项,记录显示参数中的“像素”数值。(5)病斑率=病斑区域像素点数/叶片像素点数。
调查条斑紫菜赤腐病病情指数[38]。时以片为单位,根据每个叶片的病斑率进行病情分级。0级为整个叶片完好或几乎无病斑;1级为有少量病斑或病斑很小,病斑率≤20%;2级为叶片有较多病斑,病斑率≤40%;3级为病斑较多且病斑较大,病斑率≤60%;4级为叶片上有大量病斑,病斑率≤80%;5级为叶片上有大量病斑,仅剩基部或整片病烂,病斑率>80%。
病情指数的计算:

1.3.2 生理生化指标的测定 分别取0.1g的实验样品用于以下指标的测定。组织样品的研磨破碎,用组织匀浆仪进行(6 800r/min,2个钢珠,匀浆30s),然后加入不同缓冲液,分别离心,取上清液,用于后续各物质含量及活性测定。
ROS含量的测定参考Contreras等[39]:使用2, 7-二氯荧光黄为标准物质(0~10nmol),单位ng/gFW。Pro含量的测定:采用茚三酮法[40],单位μg/gFW。PAL活性测定:活性测定参照MiltonZaker的方法[41],反应混合液共 4mL,包括2mL200μmol/L提取缓冲液(pH=8.8,0.1mol/L),1mL60μmol/LL-苯丙氨酸,1mL酶提取液。以不加酶液的为对照。30℃水浴20min,290nm处测吸光度A,以△A值改变 0.01为1个酶活单位。PPO活性测定∶活性测定基本参照王海河等[42]的方法,测定反应体系含0.2mL酶液,2.8mL0.05mol/LPBS(pH=6.8),1mL0.4mmol/L邻苯二酚。28℃保温10min,374nm处测吸光度A,以每min△A值改变0.01为一个酶活单位。比活单位为U/gFW(FW:鲜重,U:酶活力单位)。MDA含量测定:测定方法参考Heath等[43]硫代巴比妥酸(TBA)比色法,但根据实际情况进行了修改[44],以A532nm-1/2(A510nm-A560nm)的值来代表丙二醛与TBA反应的吸光度值,单位nmol/gFW。
1.4 统计分析
取实验组和对照组数据的差值用Excel和SPSS22.0进行统计分析,并采用单因素方差分析(One-wayANOVA)和最小显著差异法(LSD)分析不同时间点数据的差异显著性(P<0.05)。
2 结果
2.1 条斑紫菜赤腐病症状及病情表现
紫菜腐霉感染不同时间,条斑紫菜叶状体的病情指数见表1。在感染前条斑紫菜叶状体健康完整没有病斑(见图1A),病情指数为0;感染第一天即出现病斑,但病斑面积较小,病级集中在0级和1级;随着感染时间的延长,病斑率变大(见图1A~F),在第9天,发病最厉害,部分病烂程度达到5级(见图1F),甚至藻体颜色变为紫红色。显微观察可见,条斑紫菜叶状体被紫菜腐霉菌丝穿透,细胞变形(见图1G),菌丝穿透的细胞膜被破坏,藻红素溶出(见图1H)。随着感染时间的延长,细胞内结构被破坏,甚至导致细胞死亡(见图1I),死亡细胞脱落形成叶状体上的空洞。
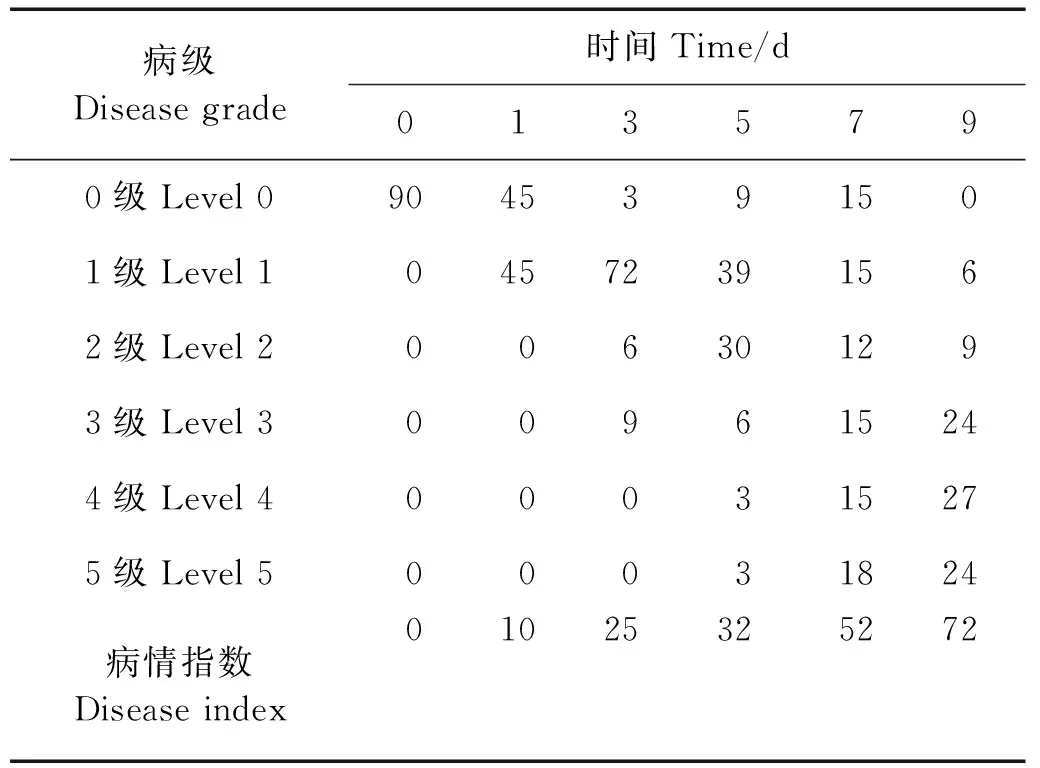
表1 不同感染时间各级病叶数及其病情指数
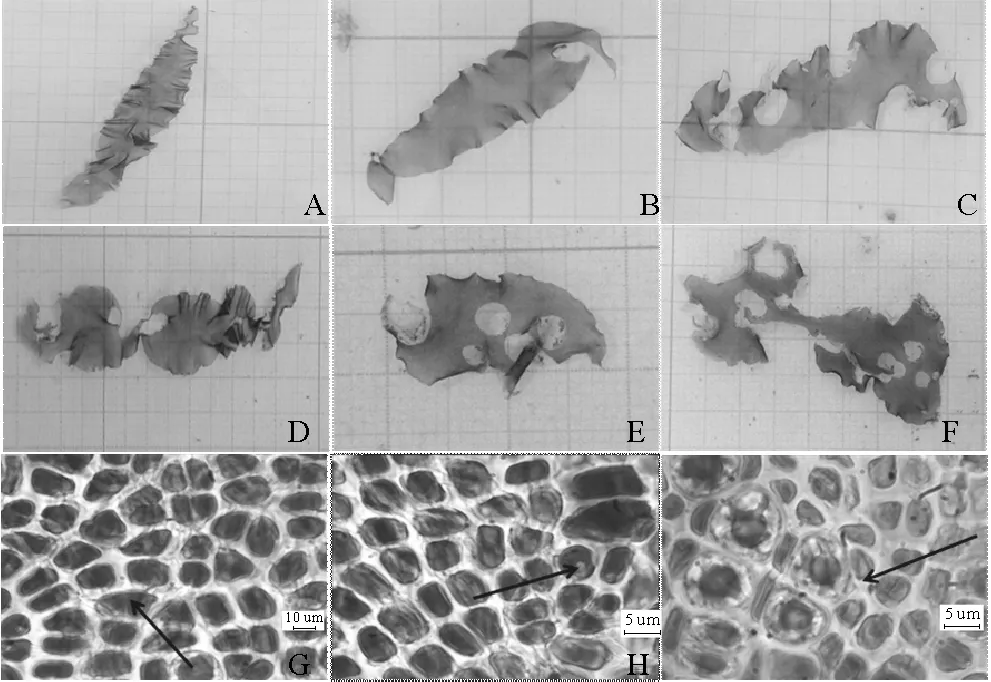
(A~F. 0~5级病烂的紫菜叶片;G. 紫菜细胞被穿透变形;H. 细胞被菌丝穿透,藻红蛋白融出(箭头所示);I. 菌丝穿透的细胞大部分死亡。A~F. From 0 to 5 grade of the rot thallus; G. Distorted thallus cells, penetrated by hypha; H. Pigments of phycoerythrin released (arrow); I. Most of cells were death.)
图1 紫菜腐霉感染后的病斑及显微照片
Fig.1 The observation of the thallus infected byP.porphyrae
2.2 紫菜腐霉侵染对条斑紫菜叶状体ROS与Pro含量的影响
当条斑紫菜叶状体受到紫菜腐霉侵染时,总体来看ROS含量变化量表现为极显著上升(P<0.01)(见图2)。第1天即表现出显著变化,在第3、5天时变化不显著,在第7、9天出现极显著上升(P<0.01)。随着感染时间的延长,感染叶状体持续积累大量ROS,增加幅度越大。感染第9天ROS含量最高,达到第1天的2.43倍。
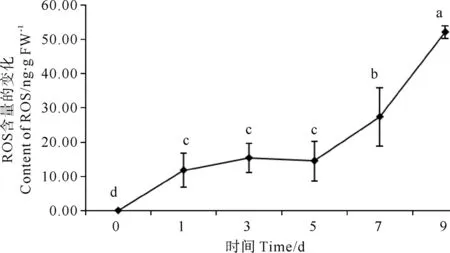
图2 紫菜腐霉感染对条斑紫菜叶状体ROS含量的影响
在紫菜腐霉侵染条件下,条斑紫菜叶状体中Pro含量第1天时变量上升不显著(见图3),在第3天变化量出现极显著(P<0.01)上升,第5、7天时上升不显著,第9天出现极显著上升,并且含量达到最高值,是第1天的7.43倍。
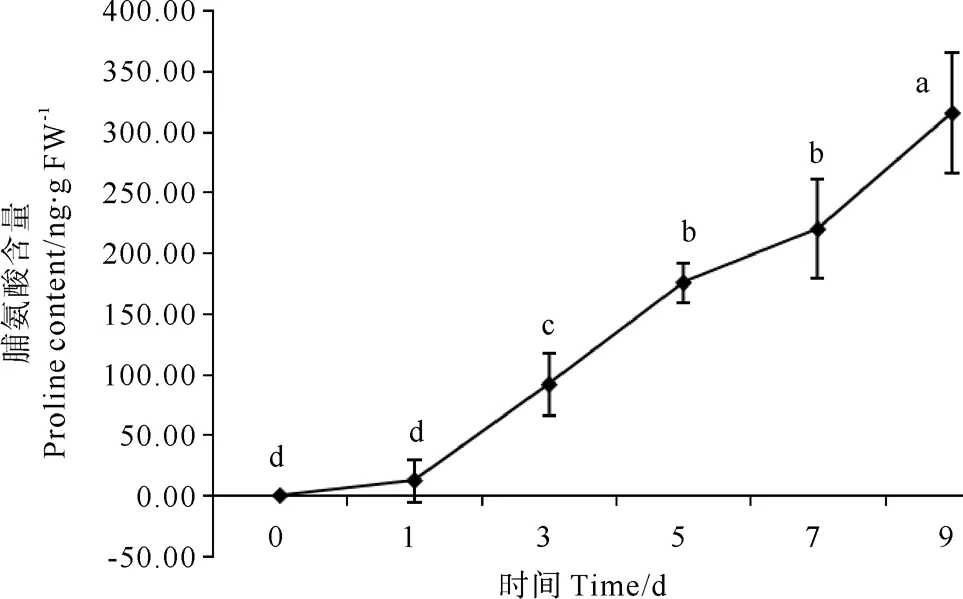
图3 紫菜腐霉感染对条斑紫菜叶状体Pro含量的影响
2.3 紫菜腐霉侵染对条斑紫菜保护性酶类PAL与PPO活性的影响
紫菜腐霉侵染条件下,条斑紫菜叶状体PAL活性变化量表现为极显著提高(P<0.01)(见图4)。在第1天时有极显著增加,第3、5天时变化不显著,第7、9天时有显著增加。且随着侵染时间的延长,提高幅度越大,在1~7d的活性提高较慢,表现为缓慢上升,第9天时活性急剧上升,并在第9天酶活性达到最高值,酶活性达到19.67 U/g FW。
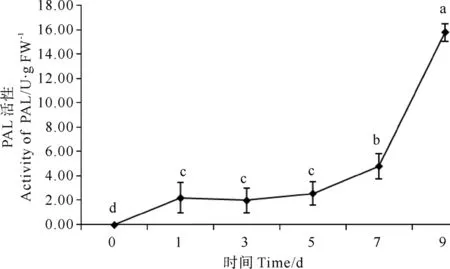
图4 紫菜腐霉感染对条斑紫菜叶状体PAL活性的影响
在紫菜腐霉感染条件下,条斑紫菜叶状体PPO活性变化表现为极显著升高(P<0.01)(见图5)。在第1天时有极显著增加,第3、5天是增加不显著。第7、9天时有极显著增加。且在感染初期,酶活性变化较缓慢,随着感染时间的延长,活性逐渐增加,在第9天达到最高值,其峰值为35.10U/g FW。
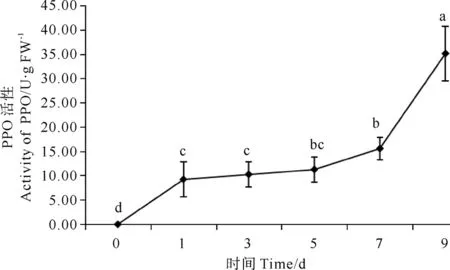
图5 紫菜腐霉感染对条斑紫菜叶状体PPO活性的影响
2.4 紫菜腐霉侵染对条斑紫菜叶状体MDA含量的影响
总体来看,MDA含量变化量随感染时间延长呈现极显著(P<0.01)增加的趋势。见图6,在感染第1天,条斑紫菜叶状体MDA含量变化表现为极显著上升(P<0.01),第3、5天时变化不显著,在感染第7天时达到最大值,随后第9天MDA含量又开始极显著下降(P<0.01)。
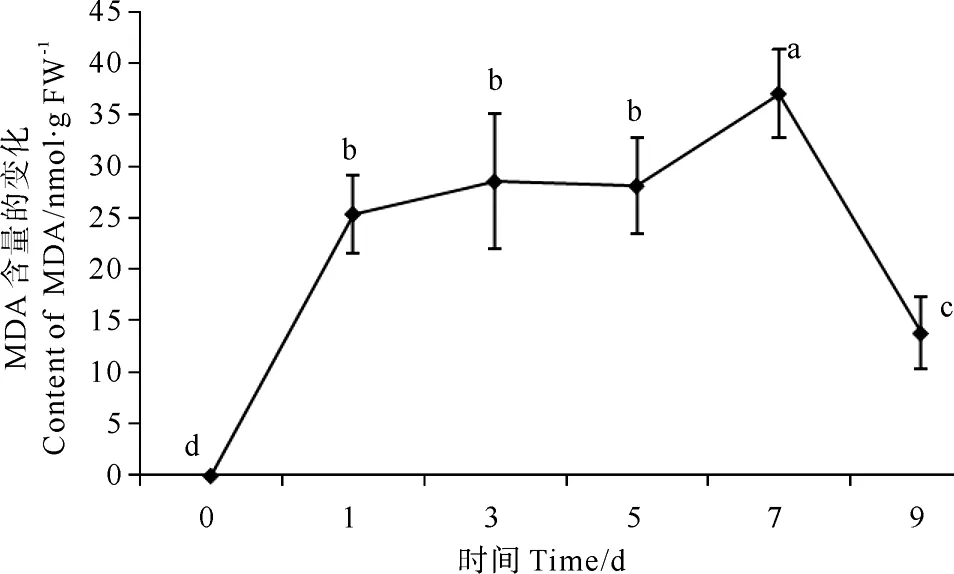
图6 紫菜腐霉感染对条斑紫菜叶状体MDA含量的影响
3 讨论
3.1 紫菜腐霉侵染对条斑紫菜脯氨酸的影响
Pro在植物体内是一种重要的渗透调节有机物质。正常状态下Pro含量低,但当受到逆境胁迫(干旱、高温、光强、病原菌)时,其含量可迅速增多,通过调节渗透压保持细胞内外渗透平衡,或与其他化合物形成亲水聚合物,以保持膜系统的完整性,使其免受外界因子的伤害[45]。另外研究表明,外源脯氨酸具有清除活性氧自由基的作用[46]。随着细胞中ROS含量的持续积累,膜系统严重受损,细胞中的渗透压调节系统和防御酶系也迅速响应。本研究中,随着紫菜腐霉感染时间的延长,条斑紫菜叶状体中Pro含量显著上升(见图3),不断调节渗透压保持细胞内外渗透平衡,以保护细胞膜系统的结构完整,这与感染前期MDA含量的变化趋势一致,均表现为迅速上升。在感染后期,MDA含量降低。但Pro含量仍持续上升,可能是由于细胞膜的其他损伤导致Pro含量持续上升。这与欧秀玲等关于棉花黄萎病病原菌引起的转基因抗病棉花游离脯氨酸含量升高,而感病品种Pro相对较低与结果相一致[47]。
3.2 紫菜腐霉侵染对条斑紫菜保护性酶类的影响
随着细胞中ROS含量不断积累,其作为第二信使可以激发植物调控防卫反应相关基因的表达[48]。苯丙氨酸转氨酶(PAL)是苯丙烷类代谢的关键酶和限速酶,在高等植物中苯丙烷类代谢途径中可以产生植保素、木质素、酚类化合物等次生产物。植保素是一种低分子量抗微生物化合物;木质素可以使细胞壁木栓化,阻止病原菌的侵染和发生[49]。大量研究表明,多酚氧化酶(PPO)是植物体内普遍存在的末端氧化酶,可以通过参与次生代谢,将酚类物质氧化成毒性更强的醌类物质,醌类物质聚合成痂,形成病斑封闭感染组织,阻止病原菌的扩散[50]。本研究中,条斑紫菜叶状体中PAL和PPO活性在紫菜腐霉感染初期增加不明显,与ROS的增加趋势一致;在感染后期,随着ROS大幅度升高,PAL和PPO活性也大幅度提高。对照感染过程的病情指数,可以看出,在感染初期,病原菌的侵染只局限在病斑周围,(见图1A~E),这时候的ROS含量增长较少,对PAL和PPO这两种酶活性的刺激有限,在感染后期,紫菜腐霉的侵染遍及整个藻体,藻体不但出现病斑还表现为藻体颜色变成紫红色(见图1F),此时瞬间爆发的大量ROS 彻底激活PAL和PPO活性,PAL和PPO活性表现为大幅度上升。这种先缓慢上升然后急剧上升的趋势与水稻感染稻瘟病[51]、玉米感染大、小斑病[52]的研究结果一致,故认为PAL、PPO活性可以作为条斑紫菜应对紫菜腐霉侵染的一种生理指标。
3.3 紫菜腐霉侵染对条斑紫菜膜系统的影响
正常状态下,植物体内ROS的产生和消除处于动态平衡。当植物遭受病原菌侵染时,平衡状态被打破,导致ROS的积累[53]。在高等植物的免疫系统中,宿主识别外界入侵者的第一反应是产生并积累ROS。一方面ROS因其强氧化活性可以对病原菌产生毒害作用,直接杀死病原菌[54];另一方面可以诱导植物体内植保素的合成,而植保素可产生对病原菌的拮抗作用[55]。另外,ROS还可以作为第二信使激发植物调控防卫反应相关基因的表达[56-57]。但是,瞬间大量的ROS积累会导致植物体内ROS产生和清除系统失去平衡,积累的ROS对细胞膜有强氧化性,会导致膜系统的损伤[58]。MDA作为植物膜脂过氧化产物之一,可与细胞内其他物质发生反应引起膜系统的损伤,其含量是衡量细胞膜脂损伤程度的一个重要指标[59]。膜脂过氧化的加剧,导致电解质外渗,因此MDA含量与植物的抗病性有负相关关系[60]。本研究中,条斑紫菜叶状体应对紫菜腐霉侵染的第一反应是瞬间产生大量的ROS,含量极显著上升(见图2),结果与Küpper等[61]关于褐藻酸降解物引起海带孢子体的氧爆发结果一致。在紫菜腐霉侵染的1~7 d,随着ROS含量上升,MDA含量也显著上升,与二者的趋势一致(见图6),也与Radwan等[62]在ZYMV病毒侵染南瓜时,MDA和ROS显著增加的结果一致。本研究表明藻类应对病原侵染的生理与生化反应机制很可能与高等植物存在广泛的一致性。
4 结语
实验结果表明:紫菜腐霉感染引起条斑紫菜叶状体防御物质、保护酶类、防御信号和细胞损伤指示物质的改变,表现为ROS、Pro、PAL、PPO极显著上升,MDA先上升后下降。活性氧ROS含量上升表明,紫菜腐霉的侵染打破了活性氧的产生和消除平衡,导致活性氧ROS积累,打破细胞膜渗透压平衡,表现为Pro含量极其显著增加(P<0.01)。细胞膜渗透压平衡受到破坏,导致Pro含量迅速增多,以保护细胞膜系统; PAL和PPO是重要的保护酶,二者含量的增多,说明病原菌侵染导致条斑紫菜组织启动防卫反应,通过酶促反应产生的化学物质来抑制病原菌侵染。随着ROS积累量不断增加,细胞膜受到破坏,膜脂过氧化程度加深,MDA含量增多。ROS积累引起细胞损伤的浓度还需要进一步研究。本研究提供了条斑紫菜受紫菜腐霉感染后ROS、Pro MDA含量变化,以及PAL、PPO活性变化,为建立条斑紫菜抗赤腐病评价体系及筛选抗病品系提供了重要数据。
[1] Behura S, Sahoo S, Srivastava V K.Porphyra: the economic seaweed as a new experimental system[J]. Curr Sci, 2002, 83(11): 1313-1316.
[2] 曾呈奎, 王素娟, 刘思俭, 等. 海藻栽培学[M]. 上海: 上海科学技术出版社, 1985: 204-206.
[3] Klochkova T A, Shim J B, Hwang M S, et al. Host-parasite interactions and host species susceptibility of the marine oomycete parasite,Olpidiopsissp., from Korea that infects red algae[J]. J Appl Phycol, 2012, 24(1): 135-144.
[4] Kim G H, Moon K H, Kim J Y, et al. A revaluation of algal diseases inKoreanpyropia(Porphyra) sea farms and their economic impact[J]. Algae, 2014, 29(4): 249-265.
[5] 周宝利, 高艳新. 嫁接茄子抗病性与电导率、脯氨酸含量及苯丙氨酸解氨酶活性的关系[J]. 园艺学报, 1998, 25(3): 300-302.
[6] 杨家书, 吴畏, 吴友三, 等. 植物苯丙酸类代谢与小麦对白粉病抗性的关系[J]. 植物病理学报, 1986, 16(3): 169-173.
[7] Friend J, Reynolds S B, Aveyard M A. Phenylalanine ammonia lyase, chlorogenic acid and lignin in potato tuber tissue inoculated withPhytophthorainfestans[J]. Physiol Plant Pathol, 1973, 3(4): 495-507.
[8] Nürnberger T, Brunner F, Kemmerling B, et al. Innate immunity in plants and animals: striking similarities and obvious differences[J]. Immunol Rev, 2004, 198(1): 249-266.
[9] Delledonne M, Zeier J, Marocco A, et al. Signal interactions between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response[J]. P Nati Acad Sci, 2001, 98(23): 13454-13459.
[10] Torres M A, Dangl J L. Functions of the respiratory burst oxidase in biotic interactions, abiotic stress and development[J]. Curr Opin Plant Biol, 2005, 8(4): 397-403.
[11] Grant J J, Loake G J. Role of reactive oxygen intermediates and cognate redox signaling in disease resistance[J]. Plant Physiol, 2000, 124(1): 21-30.
[12] Doke N, Ohashi Y. Involvement of O2-generation system in the induction of necrotic lesions on tobacco leaves infected with TMV[J]. Physiol Mol Plant P, 1988, 32(1): 163-175.
[13] Sekizawa Y, Haga M, Hirabayashi E, et al. Dynamic behavior of superoxide generation in rice leaf tissue infected with blast fungus and its regulation by some substances (Pesticide Chemistry)[J]. Agr Biol Chem Tokyo, 1987, 51(3): 763-770.
[14] Radwan D E M, Fayez K A, Mahmoud S Y, et al. Salicylic acid alleviates growth inhibition and oxidative stress caused by zucchini yellow mosaic virus infection inCucurbitapepoleaves[J]. Physiol Mol Plant P, 2006, 69(4): 172-181.
[15] Saha M, Rempt M, Gebser B, et al. Dimethylsulphopropionate (DMSP) and proline from the surface of the brown algaFucusvesiculosusinhibit bacterial attachment[J]. Biofouling, 2012, 28(6): 593-604.
[16] Bouarab K, Adas F, Gaquerel E, et al. The innate immunity of a marine red alga involves oxylipins from both the eicosanoid and octadecanoid pathways[J]. Plant Physiol, 2004, 135(3): 1838-1848.
[17] 王丽丽, 唐学玺, 王蒙, 等. 海带病烂发生过程中的生理生化变化研究(Ⅱ)——PAL, PPO 和多酚的变化[J]. 海洋科学进展, 2004, 22(1): 73-76.
[18] Weinberger F, Friedlander M, Hoppe H G. Oligoagars elicit a physiological response inGracilariaconferta(Rhodophyta)[J]. J Phycol, 1999, 35(4): 747-755.
[19] Weinberger F, Leonardi P, Miravalles A, et al. Dissection of two distinct defense-related responses to agar oligosaccharides inGracilariachilensis(Rhodophyta) andGracilariaconferta(Rhodophyta)[J]. J Phycol, 2005, 41(4): 863-873.
[20] 彭金良, 严国安. α-萘酚胁迫对普通小球藻生长及抗氧化酶活性的影响[J]. 武汉大学学报(理学版), 2001, 47(4): 449-452.
[21] Arasaki S. Studies on the rot ofPorphyrateneraby a Pythium[J]. Bull Jpn Soc Sci Fish, 1947, 13(3): 74-90.
[22] Arasaki S, Akino K, Tomiyama T. A comparison of some physiological aspects in marine pythium on the host and on the artificial medium[J]. Bull Misaki Mar Biol Inst Kyoto Univ, 1968, 12: 203-206.
[23] Takahashi M. Identification of genus pythium[J]. Plant Prot, 1970, 24(8): 339-346.
[24] 马家海. 条斑紫菜赤腐病的初步研究[J]. 上海水产大学学报, 1996, 5(1): 1-7.
[25] Correa J A. Infectious diseases of marine algae: current knowledge and approaches[J]. Prog Phycolo Res, 1997, 12: 149-180.
[26] 刘一萌, 马家海, 文茜. 坛紫菜赤腐病与拟油壶菌病并发病的初步研究[J]. 大连海洋大学学报, 2012, 27(6): 546-550.
[27] 丁怀宇. 紫菜腐霉侵染条斑紫菜叶状体过程研究[J]. 淮阴师范学院学报(自然科学版), 2006, 5(1): 69-73.
[28] Uppalapati S R, Kerwin J L, Fujita Y. Epifluorescence and scanning electron microcopy of host-pathogen interactions betweenPythiumporphyrae(Peronosporales Oomycota) andPorphyrayezoensis(Bangiales, Rhodophyta)[J]. Bot Mar, 2001, 44(2): 139-145.
[29] Park C S, Kakinuma M, Amano H. Forecasting infections of the red rot disease onPorphyrayezoensisUeda (Rhodophyta) cultivation farms[J]. J Appl Phycol, 2006, 18(3-5): 295-299.
[30] Schroeder K L, Martin F N, de Cock A W A M, et al. Molecular detection and quantification ofPythiumspecies: evolving taxonomy, new tools, and challenges[J]. Plant Dis, 2013, 97(1): 4-20.
[31] Uppalapati S R, Fujita Y. The relative resistances ofPorphyraspecies (Bangiales, Rhodophyta) to infection byPythiumporphyrae(Peronosporales, Oomycota)[J]. Bot Mar, 2001, 44(1): 1-7.
[32] Park C S, Hwang E K. Isolation and evaluation of a strain ofPyropiayezoensis(Bangiales, Rhodophyta) resistant to red rot disease[J]. J Appl Phycol, 2014, 26(2): 811-817.
[33] West J A, McBride D L. Long-term and diurnal carpospore discharge patterns in the Ceramiaceae, Rhodomelaceae and Delesseriaceae (Rhodophyta)[J]. Hydrobiologia, 1999, 398: 101-114.
[34] Park C S, Sakaguchik E, Kakinuma M A, et al. Comparison of the morphological and physiological features of the red rot disease fungusPythiumsp. isolated fromPorphyrayezoensisfrom Korea and Japan[J]. Fisheries Sci, 2000, 66(2): 261-269.
[35] Uppalapati S R, Fujita Y. Carbohydrate regulation of attachment, encystment, and appressorium formation byPythiumporphyrae(Oomycota) zoospores onPorphyrayezoensis(Rhodophyta)[J]. J Phycol, 2000, 36(2): 359-366.
[36] Addepalli M K, Fujita Y. Regulatory role of external calcium onPythiumporphyrae(Oomycota) zoospore release, development and infection in causing red rot disease ofPorphyrayezoensis(Rhodophyta)[J]. FEMS microbial Lett, 2002, 211(2): 253-257.
[37] Chen J M, Black T A, Adams R S. Evaluation of hemispherical photography for determining plant area index and geometry of a forest stand[J]. Agr Forest Meteorol, 1991, 56(1): 129-143.
[38] 李社增, 马平, C H H, 等. 相对病情指数划分棉花品种抗病性的统计学基础[J]. 棉花学报, 2003, 15(6): 344-347.
[39] Contreras L, Moenne A, Correa J A. Antioxidant responses inScytosiphonlomentaria(Phaeophyceae) inhabiting copper enriched coastal environments[J]. J Phycol, 2005, 41(6), 1184-1195.
[40] Milton Z. Induction of phenylalanine deaminase by light and its relation to chlorogenic acid synthesis in potato tuber tissue[J]. Plant Physiol, 1965, 40(5): 779-784.
[41] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社. 2000: 161-169.
[42] 王海河, 林奇英, 谢联辉, 等. 黄瓜花叶病毒三个毒株对烟草细胞内防御系统及细胞膜通透性的影响[J]. 植物病理学报, 2001, 31(1): 43-49.
[43] Heath R L, Packer L. Photoperoxidation in isolation chloroplast kinetics and stoichimetry of fatty acid peroxidation[J]. Arch Biochem Biophys, 1968, 125(1): 189-198.
[44] 周巍巍, 谢潮添, 陈昌生, 等. 低氮, 磷胁迫对坛紫菜叶状体生理生化特征的影响[J]. 水产学报, 2011, 35(4): 543-550.
[45] 汤章城. 逆境条件下植物脯氨酸的累积及其可能的意义[J]. 植物生理学通讯, 1984, 1: 15-21.
[46] Voetberg G S, Sharp R E. Growth of the maize primary root at low water potentials III. Role of increased proline deposition in osmotic adjustment[J]. Plant Physiol, 1991, 96(4): 1125-1130.
[47] 欧秀玲, 耿雅文, 李凤, 等. 棉花黄萎病病原菌诱导侵染对转基因抗病棉花生理性状的影响[J]. 生物技术通报, 2013, 6: 94-98.
[48] Apostol I, Heinstein P. F, Low P. S. Rapid stimulation of an oxidative burst during elicitation of cultured plant cells[J]. Plant Physiol, 1989, 90(1): 109-116.
[49] 冯洁, 陈其煐. 棉株体内几种生化物质与抗枯萎病之间关系的初步研究[J]. 植物病理学报, 1991, 21(4): 291-29.
[50] Moerschbacher B M, Noll U, Ocampo C A, et al. Hypersensitive lignification response as the mechanism of non-host resistance of wheat against oat crown rust[J]. Physiol Plant, 1990, 78(4): 609-615.
[51] 欧阳光察, 应初衍, 朱明华, 等. 稻瘟病菌孢子和毒素对水稻抗病性的诱导与苯丙烷类代谢途径的关系[J]. 植物生理与分子生物学学报, 1987, 13(4): 40-42.
[52] 王敬文, 薛应龙. 植物苯丙氨酸解氨酶的研究. Ⅲ. 玉米小斑病菌HelminthosporiummaydisT.h小种和大斑病菌Helninthospiriumtureium毒素对苯丙氨酸解氨酶(PAL)的刺激作用[J]. 植物生理学报, 1982, 8(3): 237-243.
[53] Wu G, Shortt B J, Lawrence E B. Disease resistance conferred by expression of a gene encoding H2O2-generating glucose oxidase in transgenic potato[J]. Plant Cell, 1995, 7(9): 1357-1368.
[54] 李合生. 现代植物生理学[M]. 北京: 高等教育出版社, 2002: 4l5-419.
[55] Peng M, Kuc J. Peroxidase-generated hydrogen peroxide as a source of antifungal activity in vitro and on tobacco leaf discs[J]. Phytopathology, 1992, 82(6): 696-703.
[56] 林忠平. 植物对病害的防御系统[J]. 植物学通报, 1993, 10(3): 1-3.
[57] Foyer C H, Descourvieres P, Kunert K J. Protection against oxygen radicals: an important defence mechanism studied in transgenic plants[J]. Plant Cell Environ, 1994, 17(5): 507-523.
[58] Shao H B, Jiang S Y, Li F M, et al. Some advances in plant stress physiology and their implications in the systems biology era[J]. Colloid Surface B, 2007, 54(1): 33-36.
[59] 余叔文, 汤章城. 植物生理与分子生物学[M]. 北京: 科学出版社, 1998, 770-783.
[60] 李俊兰, 李妙, 翟学军, 等. 棉花感染黄萎病后叶片组分内生化特性分析[J]. 华北农学报, 1995, 10: 134-138.
[61] Küpper F C, Kloareg B, Guern J, et al. Oligoguluronates elicit an oxidative burst in the brown algal kelpLaminariadigitata[J]. physiol. Plant, 2001, 125(1): 278-291.
[62] Radwan D E M, Fayez K A, Mahmoud S Y, et al. Salicylic acid alleviates growth inhibition and oxidative stress caused by zucchini yellow mosaic virus infection inCucurbitapepoleaves[J]. Physiol Mol Plant P, 2006, 69(4): 172-181.
责任编辑 高 蓓
The Variation of Defensive Compounds Content and Protective Enzymes Activity of
PyropiayezoensisGametophyte Infected by OomycetePythiumporphyrae
ZHANG Xiao-Nan1,2, SUN Pei-Pei1,2, MAO Yun-Xiang1,2, ZOU Dan-Dan1,2,
TANG Xiang-Hai1,2, MO Zhao-Lan3
(1.The Key Laboratory of Marine Genetics and Breeding Ministry of Education, Ocean University of China, Qingdao 266003, China; 2. College of Marine Life Sciences, Ocean University of China, Qingdao 266003, China; 3. Yellow Sea Fisheries Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
In this study, the content of defensive compounds (ROS, Pro), the activity of the protective enzymes (PAL, PPO) and MDA inPyropiayezoensisgametophyte during the course of infection byPythiumporphyraeat different times (0, 1, 3, 5, 7, 9 days) were measured. The result indicated that the infection ofPyt.Porphyraecould break the dynamic balance of ROS in cells that leads to its significant increase(P<0.01), and the osmotic balance was broken. Pro content was raised markedly(P<0.01), and the activity of protective enzymes such as PAL, PPO was found to be enhanced appreciably(P<0.01), as a result the cells membrane was damaged, and MDA content was changed. Based on these data, we inferred an outline that defensive compounds and protective enzymes ofPyr.yeozensisrespond toPyt.porphyraeinfection as follows: the content of ROS in cells ofPyr.yeozensiswould increase while induced by the infection of the pathogen. When the host cells received much ROS, the content of Pro was increased and the activity of PAL and PPO was enhanced indicating that the defensive system and the activity of the protective enzymes were activated. At last the cell membrane of the host were damaged by the excess ROS, leading to the lipid peroxidation of the cells membrane and high MDA levels. The results provided the fundamental data for understanding the mechanism of red rot disease resistance inP.yezoensis.
Pyropiayezoensis;Pythiumporphyrae; infection;defensive compounds; protective enzymes; malondialdehyde
国家自然科学基金项目(31372517);国家高技术研究计划项目(2012AA10A406);山东省自主创新专项(2013CXC80202);国家科技基础条件平台—水产种质资源平台运行服务项目资助
2014-12-31;
2015-03-26
张晓南(1989-),女,硕士生。E-mail:zhangxiaonan1215@163.com
❋❋通讯作者: E-mail: yxmao@ouc.edu.cn
Q946.5
A
1672-5174(2015)12-057-08
10.16441/j.cnki.hdxb.20140442
