S-1联合奥沙利铂新辅助化疗用于局部进展期结直肠癌的有效性和安全性研究
2015-03-28袁翔袁维堂杨晓艳叶志强
袁翔 袁维堂 杨晓艳 叶志强
(郑州大学第一附属医院 河南郑州 450052)
结直肠癌(colorectal cancer,CRC)为全球性肿瘤,其新发病率正逐渐上升。近年来,随着我国生活水平的提高及人口老龄化的加快,CRC的发病率正呈逐年增加趋势[1]。目前,对于CRC的治疗仍是以手术切除为主,化疗为辅的综合性治疗。但由于CRC症状时常不太明显,许多发现时已达晚期或不能直接手术切除。新辅助化疗是在术前给予全身化疗,达到缩小肿瘤,降低肿瘤分期,最终达到可切除的程度。S-1作为一种新型的5-Fu的增效减毒口服抗肿瘤制剂,已广泛应用治疗胃癌等疾病的治疗中,在日本,S-1已批准应用于结直肠癌的治疗[5-8]。在我国,此类研究尚较少。因此,本研究着重研究S-1在新辅助化疗治疗结直肠癌有效性及安全性。
1 资料和方法
1.1 一般资料 选择2013年1月至2015年1月郑州大学第一附属医院肛肠外科接受新辅助化疗的局部进展期结直肠癌的患者61例。将其根据随机双盲对照原则分成 A(30例)、B(31例)两组。入组标准:①有明确组织病理诊断为结直肠癌,TNM分期为ⅡB~ⅢB期;②MRI、CT等检查证实未见远处转移,CT、电子纤维肠镜提示局部进展期结直肠癌,无法行R0切除;③之前均未接受过放化疗治疗及手术治疗;④除结直肠癌外未发现其他组织器官肿瘤;⑤无严重心脑血管、呼吸等系统病变,KPS评分>70分;⑥血常规、血生化、尿常规等检验结果基本正常;⑦均同意签署自愿参加该研究知情同意书。本研究已通过郑州大学第一附属医院伦理论证委员会许可同意。两组一般资料比较,差异无统计学意义(P>0.05)。见表1。
1.2 研究方法 A组30例患者行SOX方案化疗,B组31例患者行FOLFOX6方案化疗。用药方案:A组:静脉滴注奥沙利铂(130 mg/m2)d1,口服 S-1[80 mg/(m2·d)]d1~d14,d14~d21停药,3 周为 1 个周期,总疗程为3个周期;B组:OXA(85 mg/m2)d1,CF(200 mg/m2)d1~ d2,5 - Fu(400 mg/m2)d1,5 - Fu(2 400 mg/m2)持续46 h,2周为1个周期,总疗程为3个周期。3个周期化疗结束后,所有患者均行CT、血常规、肝肾功能及肿瘤标志物检查。后根据相关复查结果评估手术指征及手术评价。

表1 两组一般资料比较
1.3 观察指标及评价标准
1.3.1 药物不良反应评价 按美国国立癌症研究所(NIC)制定的国际通用化疗不良反应术语标准CTCAE v4.0分为1~4级[2],1级为无明显症状或较轻,不需要干预;2级为有症状,需要临床干预,但不影响日常活动;3级为症状较重,需要住院等积极干预治疗,危害健康;4级为严重危害健康,威胁生命。
1.3.2 术前化疗效果评价 按国际通用的实体瘤疗效评价标准2009年修订版标准RECIST1.1进行评价[2],分为完全缓解(CR)、部分缓解(PR)、无明显变化(NC)、进展(PD),CR与PR为治疗有效。
1.3.3 手术评价 新辅助化疗3个周期后行手术治疗,分为R0切除,R1切除,不可切除,远处转移。
1.3.4 术后并发症评价 A、B两组术后并发症按结直肠癌术后并发症Clavien分级进行评价[1]。1级为无需任何药物治疗干预,如术后疼痛、较轻的切口感染等;2级为需要药物进行干预,如较重的切口感染、肠梗阻、较轻的吻合口漏等;3级为需要进一步治疗或有创治疗干预,如需要手术的吻合口漏、严重的肠梗阻等;4级为危及生命,需要进行ICU监护;5级为死亡。
1.4 统计学方法 采用SPSS 17.0统计学软件进行数据处理分析,定性资料的组间比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 药物不良反应 A组均为低级不良反应(1、2级),而B组则出现较多的严重不良反应(3、4、5级),其中B组有4例患者因白细胞较低中断化疗1次,A组则无。两组患者药物不良反应比较,A组优于B组,差异有统计学意义(χ2=5.876,P=0.015)。见表2。
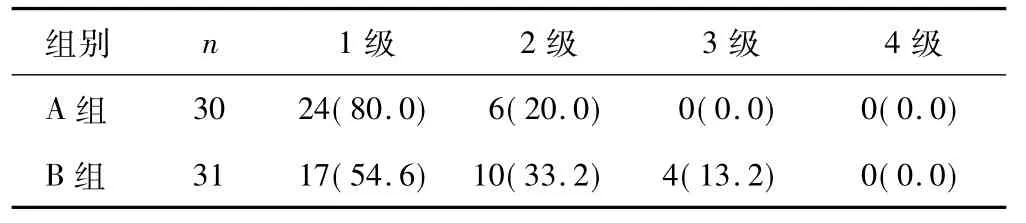
表2 两组不良反应比较[n(%)]
2.2 术前化疗效果及R0切除率 两组患者术前化疗效果及R0切除率比较,差异无统计学意义(P>0.05)。见表3。
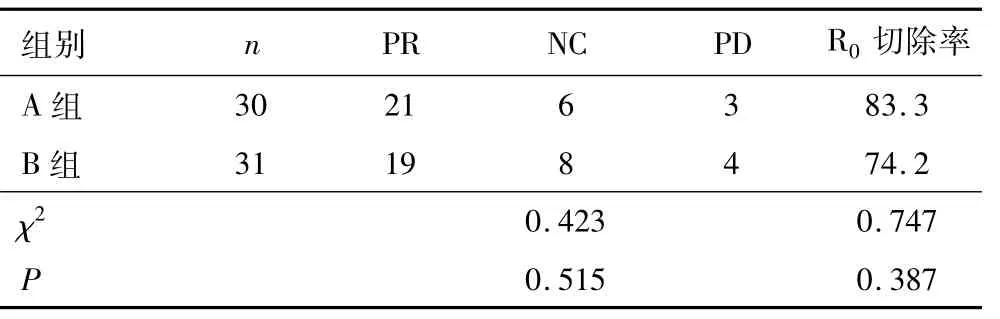
表3 两组术前化疗效果比较(n,%)
2.3 术后并发症 A、B两组患者术后并发症发生情况比较,差异无统计学意义(χ2=1.761,P=0.184)。见表4。

表4 两组术后并发症比较[n(%)]
3 讨论
目前,随着人们生活水平的提高及人口老龄化的加剧,CRC已逐渐成为最常见的恶性肿瘤之一。检查、检验技术的提高仍未减低CRC的分期。据统计,现经确诊的CRC大多数已是进展期。因此,“以手术为主,化疗相结合”的综合性治疗方案仍是当前CRC治疗标准方案。但由于许多患者发现时已是进展期,体内可能有微小转移灶,直接手术切除,术后可能会转移复发,效果较差。以此,术前新辅助化疗,杀灭微小转移灶,降低肿瘤分期,达到可R0切除的方案已逐渐应用在临床。特别是“新辅助化疗+手术治疗+术后化疗”方案,是治疗局部进展期CRC的方向,正越来越受到人们的关注[3-6]。
目前,国内CRC新辅助化疗的一线治疗方案以FOLFOX6为主,但由于注射的氟尿嘧啶用药时间长,毒副作用较大,不良反应较重,许多患者不能耐受,有些患者甚至终止化疗,这对疾病的本身及患者心理都产生了很大的负面影响。S-1作为一种口服高效减毒的5-Fu类抗肿瘤药物,在用药的效果及安全性上已得到了肯定,而且与注射的氟尿嘧啶相比,毒副作用大大降低,用药方便,已逐渐受到关注。在日本,S-1已作为治疗胃癌、结直肠癌的一线治疗用药[7-9]。本研究通过对郑州大学第一附属医院肛肠外科接受新辅助化疗的局部进展期结直肠癌的61例患者分别进行SOX方案与FOLFOX6方案比较,找寻SOX方案与当前国内一线结直肠化疗方案在疗效及安全性方面的差异,评估SOX方案是否可作为CRC新辅助化疗的一线方案。
本研究结果表明,A组均为低级不良反应(1、2级),而B组则出现较多的严重不良反应(3、4、5级),其中B组有4例患者因白细胞较低中断化疗1次,A组则无。两组患者药物不良反应比较,A组优于B组,表明S-1联合奥沙利铂方案的化疗毒性反应明显低于FOLFOX6方案,患者耐受性良好。在术前化疗效果评估方面,两组差异无统计学意义,表明S-1联合奥沙利铂方案行术前新辅助化疗与FOLFOX6方案疗效相当,而S-1联合奥沙利铂方案每次化疗住院时间短,主要为口服用药,较FOLFOX6方案更为方便,患者易于接受。在R0切除率及术后并发症方面,两组差异无统计学意义,表明S-1联合奥沙利铂方案术前新辅助化疗不降低术后R0切除率,可达到与FOLFOX6方案相同的术前化疗效果,且不增加术后风险,安全系数与FOLFOX6方案相当。
综上所述,S-1联合奥沙利铂方案作为术前新辅助化疗方案治疗局部进展期结直肠癌疗效肯定,毒副作用较小,患者耐受性良好,而且用药方便,同时不降低手术R0切除率,不增加术后风险,因此可作为局部进展期结直肠癌治疗的一线化疗方案。
[1] Chau I,Cunningham D.Adjuvant eherapy in colon cancer - what,when and how [J].Ann Oncol,2006,17(9):1347 -1349.
[2] Schwartz L H,Bogaerts J,Ford R,et al.Evaluation of lymph nodes with RECIST 1.1[J].Eur JCancer,2009,45(2):261 -267.
[3] Duk JL,Tae SS,Do H L,et al.Phase Istudy of neoadjuvant chemoradiotherapy with S-1 and oxaliplatin in patients with locally advanced gastric cancer[J].Cancer Chemother Pharmacol,2012,69(5):1333 -1338.
[4] 顾晋,詹天成,姚云峰.结直肠癌的新辅助化疗[J].中国普外基础与临床杂志,2007,14(6):628 -629.
[5] 邱国钦,许丽贞,林智才.替吉奥联合顺铂治疗进展期胃癌的近期疗效观察[J].临床肿瘤学杂志,2011,16(8):728 -731.
[6] 袁梅琴,钟海钧,杨云山.S-1治疗进展期胃癌的研究进展[J].国际肿瘤学杂志,2011,38(4):289 -291.
[7] Kitani K,Okajima K,Sato K,et al.Preoperative chemoradiotherapy with S - 1 for advanced low rectal cancer[J].Gan To Kaqakku Ryoho,2011,38(12):2122 -2124.
[8] Sadahiro S,Suzuki T,Tanaka A,et al.Phase I/II study of preoperative concurrent chemoradiotherapy with S-1 for locally advanced resectable rectal adenocarcinoma[J].J Clin Oncol,2011,81(5 -6):306 -311.
[9] Wang M,Wu M,Wang W,et al.Docetexal plus S -1 versus oxaliplatin plus S-1 for first-line treatment of patients with advanced gastric cancer:retrospective study[J].Oncol Res Treat,2014,(37):24 -28.
