花生乳状液界面吸附蛋白提取工艺及其乳化性质的研究
2015-03-27胡存书章绍兵王子伟殷丽君
胡存书,章绍兵,王子伟,殷丽君
(河南工业大学 粮油食品学院,河南 郑州 450001)
0 引言
从20 世纪50 年代起,美国学者已将水剂法应用于花生的研究,同时利用它制备花生油和蛋白质[1].国内学者也陆续对此法展开了研究,并在工艺上进行了改良[2-4].但是在花生水剂法加工过程中容易形成大量稳定的乳状液,严重影响了油脂与蛋白质的分离.但是采用蛋白酶可以有效破乳[5-7],这说明蛋白质可以稳定此类乳状液.
为进一步了解水剂法花生乳状液的特性,探索花生蛋白质的乳化机制,有必要将界面吸附蛋白提取出来,研究其分子结构及性质.要提取界面吸附蛋白,必须先用水洗乳状液除去花生未吸附蛋白,进而在不影响花生蛋白结构性质的同时,除去花生乳状液中绝大部分的油脂.作者将冷冻-解冻和小分子表面活性剂Tween-20 的置换作用相结合,对水洗后花生乳状液进行破乳去油,研究了各种因素对破乳率的影响.对于破乳得到的水相,采用不同方式回收吸附蛋白,并研究了花生吸附蛋白的乳化特性.
1 材料与方法
1.1 材料
未脱红衣花生仁:市售,粗脂肪含量47.12%,粗蛋白质含量25.33%,水分含量3.37%;花生分离蛋白:参考矫丽媛等[8]的方法自制,蛋白纯度为84.30%;菜籽分离蛋白:参考王子伟[9]的方法自制,蛋白质纯度为85.3%;大豆分离蛋白:山东天九生物技术有限公司,蛋白质纯度85.5%;G15 葡聚糖凝胶:上海索莱宝生物科技有限公司;其他试剂均为分析纯.
1.2 仪器与设备
A-88 型组织均浆捣碎机:江苏金坛医疗器械厂;JMS-50DX 型胶体磨:廊坊市廊通机械有限公司;DT5-4B 型离心机:北京时代北利离心机有限公司;TG1850-WS 台式高速离心机:上海卢湘仪离心机仪器有限公司;FJ200-S 数显高速分散均质机:上海标本模型厂;LGJ-18C 型冷冻干燥机:北京四环科学仪器有限公司;722G 可见分光光度计:上海精科仪器有限公司;SL150 型动态/静态接触角仪:美国科诺工业有限公司.
1.3 试验方法
1.3.1 水洗后乳状液的制备
花生仁和水按1∶10(W/V)置于烧杯中浸泡12 h,用组织捣碎机对花生进行初步粉碎,再用胶体磨进一步粉碎(磨头间隙16 μm),将粉碎后的花生浆移入2 L 烧杯中,置于40 ℃水浴锅中,用10 mol/L 的NaOH 溶液调节体系pH 值为10.5,搅拌90 min 后,将物料冷却至室温,转移到离心机中离心(2 800 g,15 min),离心后用小勺小心取出乳状层,将乳状层和水按1∶4 混匀,置于高速离心机中再离心(20 500 g,30 min),去掉离心管下层水相(除去界面非吸附蛋白),得到水洗后的乳状液(油脂含量(73.47±1.60)%,蛋白质含量(1.05±0.05)%,水分含量(18.66±1.00)%),置于4 ℃冷藏备用.
1.3.2 影响乳状液破乳率的单因素试验
将水洗后的乳状液按1∶1.5 分散在pH=7 的磷酸盐缓冲液体系中,添加一定量的Tween-20,搅拌一段时间后置于-20 ℃冰箱中冷冻24 h,40 ℃水浴2 h 解冻,冷冻-解冻重复两次,然后在一定离心力下离心30 min 破乳.以破乳率(p)为指标,通过单因素试验研究离心力、搅拌时间和Tween-20添加量(Tween-20 体积与乳状液质量比(V/W))对乳状液破乳率的影响.破乳率计算公式:

式中:m1为乳状液破乳后经过离心得到上层清油的质量;m0为乳状液中总油脂质量.
1.3.2.1 离心力对乳状液破乳率的影响
搅拌时间60 min,Tween-20 添加量为1.5%时,乳状液冷冻-解冻后分别在11 400 g、15 700 g、20 500 g 和36 200 g 条件下离心30 min,测定破乳率.
1.3.2.2 搅拌时间对乳状液破乳率的影响
搅拌时间分别为0、30、60、90 和120 min,Tween-20 添加量为1.5%,乳状液冷冻-解冻后在20 500 g 下离心30 min,测定破乳率.
1.3.2.3 Tween-20 添加量对乳状液破乳率的影响
Tween-20 添加量分别为0.5%、1%、1.5%、2%和2.5%,搅拌时间60 min 时,冷冻-解冻后在20 500 g 下离心30 min,测定破乳率.
1.3.3 界面吸附蛋白的回收
参照Chabrand 等[10]的方法,并有适当改变.乳状液经过冷冻解冻离心后除去上层清油,向剩余水相中加入一定体积的氯仿/甲醇(体积比为2∶1),振荡20 min 后,在2 800 g 条件下离心15 min,用吸管吸取上层溶液,旋转蒸发除去残余有机溶剂,得到界面吸附蛋白粗提液.粗提液经过处理得到几种不同的蛋白质样品,通过福林酚法测定蛋白质含量.
1.3.3.1 透析
粗提液经过相对分子质量为3 000 的透析袋在4 ℃下放置48 h,中间换水6 次,将透析过后的样品冷冻干燥,得到透析蛋白.
1.3.3.2 硫酸铵盐析
向粗提液中加入硫酸铵使其饱和浓度达到90%,4 ℃下放置2 h,2 800 g 离心15 min,将沉淀用相对分子质量为3 000 的透析袋透析,向透析袋外液蒸馏水中加入BaCl2溶液,至没有沉淀析出,表明透析完全,透析袋中液体经冷冻干燥得到硫酸铵盐析蛋白.
1.3.3.3 G15 层析
粗提液经过G15 葡聚糖凝胶处理,上样量300 mg,流速2.5 mL/min,检测波长280 nm,收集峰样品经过冷冻干燥,得到G15 层析蛋白.
1.3.3.4 酸沉
调节粗提液pH 至4.5,在4 ℃下静置2 h,2 800 g 条件下离心15 min,得到的沉淀水洗2 次,经冷冻干燥得到酸沉蛋白.
1.3.4 乳化性的测定
参考Chelulei 等[11]测定蛋白质乳化活性的方法.用pH=9 的硼酸-硼砂缓冲溶液配制浓度为0.05%蛋白质溶液(由于提取的界面吸附蛋白纯度比较低,配制蛋白质溶液时,适当增加界面吸附蛋白的质量,使其实际浓度与花生分离蛋白的浓度一致),量取10 mL 并加入4 mL 花生油,用高速均质机在20 000 r/min 条件下均质1 min.分别在0 min 和10 min 时,迅速从乳化液底部量取0.5 mL,用浓度为0.1%的SDS 溶液将其稀释到25 mL 的容量瓶中,在500 nm 下读取吸光值,分别记为0时刻的吸光值A0和10 min 时吸光值A10,以0.1%SDS 溶液作空白.乳化活性(EAI)和乳化稳定性(ES)可以用公式计算:

式中:c 为乳化前蛋白质的浓度,g/mL;φ为乳化剂中油的含量,0.285 7;n 为稀释倍数,50;10 000=m2/cm2;ΔT 为时间差,min.
1.3.5 溶解性的测定
参考Petrucelli 等[12]的方法测定蛋白质的溶解度,有所改动.将浓度为0.2%的蛋白质溶液在室温下搅拌30 min 后,用1 mol/L 的NaOH 或HCl 溶液调节蛋白质溶液pH 值7 至11,然后继续搅拌30 min 至pH 值稳定,在2 800 g 下离心15 min 取上清液.采用福林酚法测定蛋白质含量,上清液中蛋白质含量与样品中蛋白质含量的比值为蛋白质的溶解度.
1.3.6 界面张力的测定
参考M.Joshi 等[13]测定蛋白质界面张力的方法.用pH=9 的硼酸-硼砂缓冲溶液配制5 mg/mL的蛋白质溶液,进样器吸取1 mL 溶液,然后向油水饱和体系中挤出1 滴蛋白质溶液,通过动态/静态接触角仪分析其界面张力,以pH=9 的硼酸-硼砂缓冲溶液作参比.
1.4 数据处理
试验结果以两次以上试验的平均值±标准偏差表示,使用SPSS Statistics 17.0 进行单因素方差分析,p<0.05 代表差异显著.
2 结果与分析
2.1 离心力对乳状液破乳率的影响(图1)
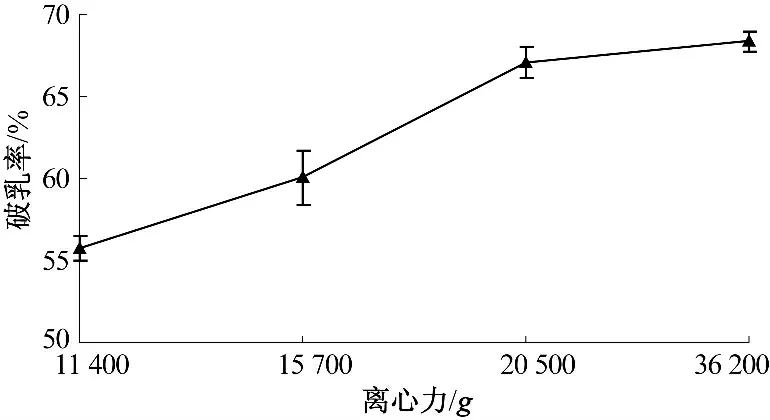
图1 离心力对乳状液破乳率的影响Fig.1 The influence of centrifugal force on emulsion demulsification rate
由图1 可知,破乳率随着离心力的增加而逐渐增大,当离心力增加到20 500 g 时,破乳率显著提高,达到67.1%;而离心力进一步增大到36 200 g时,破乳率虽然有所增大,但是增加不明显.这是由于乳状液冷冻解冻破乳时,油脂与蛋白质之间结合得比较疏松,离心力增加,有助于乳状液中油脂和蛋白质的分离,从而提高破乳率,达到一定程度后,离心力的增大并不能显著提高乳状液的破乳率.因此,选用离心力为20 500 g 较为合适.
2.2 搅拌时间对乳状液破乳率的影响(图2)

图2 搅拌时间对乳状液破乳率的影响Fig.2 The influence of stirring time on emulsion demulsification rate
由图2 可知,乳状液的破乳率随着搅拌时间的延长而增加,60 min 时破乳率最高,60 min 以后随搅拌时间继续延长,破乳率有下降趋势.搅拌是为了让乳状液分散在磷酸盐缓冲溶液中,与Tween-20 充分接触,从而提高破乳率,但是过度的搅拌,会使乳状液进一步乳化,减小破乳率,因此,选择搅拌60 min 较为合适.
2.3 Tween-20 添加量对乳状液破乳率的影响(图3)

图3 Tween-20 添加量对乳状液破乳率的影响Fig.3 The influence of Tween-20 amount on the emulsion demulsification rate
由图3 可知,随Tween-20 添加量的增加,破乳率先上升后下降,在1.5%时破乳率最高.Tween-20 是一种小分子非离子型表面活性剂,它可以置换出乳状液中的大分子蛋白质,使乳状液稳定性下降;但体系中添加过多的Tween-20 将会导致油脂的进一步乳化.因此,最终选择Tween-20添加量为1.5%.
通过单因素试验,乳状液按1∶1.5 分散在pH=7 的磷酸盐缓冲液体系中,添加1.5%的Tween-20,搅拌60 min 后置于-20 ℃冰箱中冷冻24 h,40 ℃水浴中解冻2 h,冷冻-解冻两次后,在20 500 g 条件下离心30 min,乳状液破乳率最高达到(75.21±0.15)%.
2.4 不同蛋白质溶解性的比较
水洗后的乳状液破乳除去大部分油脂后,再经过氯仿/甲醇萃取脱除残余油脂,得到界面吸附蛋白的粗提液,分别尝试采用透析、硫酸铵盐析、G15 层析和酸沉收集蛋白质样品.不同处理方式得到的界面吸附蛋白纯度如表1 所示.

表1 不同处理方式得到的界面吸附蛋白纯度Table 1 The purities of interface adsorbed proteins obtained by different treatments
由表1 可知,通过透析收集的蛋白质样品纯度最低,而酸沉可使粗提液中界面吸附蛋白质沉降下来,从而能得到纯度较高的蛋白质样品.因此,文中研究酸沉获得界面吸附蛋白的溶解性和乳化性.
溶解性是蛋白质的重要功能特性之一.4 种蛋白质pH 在7~11 之间的溶解性变化情况如图4 所示,当pH 在7~11 时,界面吸附蛋白可能因为在界面上发生了部分变性,更多的疏水基团暴露在外,因疏水相互作用导致蛋白质聚沉,从而降低了蛋白质的溶解性.

图4 不同蛋白质的溶解性Fig.4 The solubility of different proteins
2.5 不同蛋白质乳化性质比较(图5、图6)

图5 不同蛋白质的乳化活性Fig.5 The emulsifying activity of different proteins
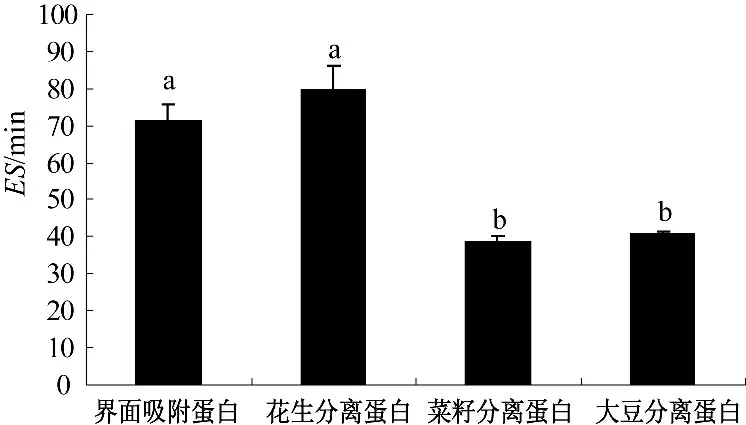
图6 不同蛋白质的乳化稳定性Fig.6 The emulsifying stability of different proteins
由图5 和图6 可知,在这4 种蛋白质乳化性质的比较中,界面吸附蛋白的乳化活性最高,其乳化稳定性与花生分离蛋白相当,并显著高于菜籽分离蛋白和大豆分离蛋白.蛋白质是一种两亲性化合物,在乳化过程中蛋白质分子迅速地吸附在油滴上并形成吸附蛋白膜.在油水模拟乳化过程中,界面吸附蛋白中非极性亲油基团能够迅速与油滴结合,在其表面形成一层或几层蛋白膜,严密地将油滴裹住,从而使油滴与油滴之间隔开,阻止了小油滴间的聚集形成大的油滴;界面吸附蛋白中极性的亲水性基团与外部水结合,能够使被界面吸附蛋白包裹着的油滴稳定的分布在水中而不析出,形成了稳定的O/W 型乳状液.尽管界面吸附蛋白的溶解性显著低于其他几种蛋白质,但其乳化性能优良,这说明溶解性不是影响蛋白质乳化性能的决定因素,蛋白质的乳化性与其分子结构特征密切相关.
2.6 不同蛋白质界面张力的比较(图7)

图7 不同蛋白质的动态界面张力Fig.7 The dynamic interfacial tension of different proteins
界面张力是两相在界面上相互排斥和各自尽量缩小彼此接触面积而形成的相互作用力.在油水体系中,蛋白质充当表面活性剂,可以降低油水之间的界面张力.由图7 可知,界面吸附蛋白降低界面张力的速率最高,所呈现的界面活性是最好的.这说明虽然界面蛋白质因为溶解性差迁移到油水界面的速率较低,但因为其分子已是部分展开状态,一旦吸附到界面上构象无需再发生较大改变,所以与其他球状蛋白质相比,其降低界面张力的速度仍是最快的.周春霞等[14]在研究蛋白分子在乳化过程中的动力吸附过程发现,蛋白分子吸附到油水界面和降低界面张力的速率越高,蛋白的乳化效率越高,也就是蛋白的乳化活性越高.这与前面研究界面吸附蛋白乳化性质的结果是相符的.
3 结论
水洗后乳状液破乳最佳工艺为:Tween-20 添加量1.5%、搅拌时间60 min,在20 500 g 条件下离心破乳,乳状液破乳率为(75.21±0.15)%.
水洗后乳状液破乳得到界面吸附蛋白粗提液,通过比较酸沉、硫酸铵盐析、透析和G15 层析等方式得到的界面吸附蛋白的纯度,得到最好的处理方式是酸沉,其蛋白质纯度为(64.68±0.21)%.
与花生蛋白、菜籽蛋白以及大豆蛋白相比,花生界面吸附蛋白的溶解性较差,但乳化性质最好,降低界面张力的速率最快.
[1]Sugarman N.Process for extraction oil and protein simultaneously from oil-bearing material:US,2762820[P].1956.
[2]朱凯艳.利用水相同时提取花生油和蛋白工艺的研究[D].无锡:江南大学,2012.
[3]阎中林,王萍.水剂法提取核桃楸种仁油技术试验研究[J].中国林业产业,2006(11):52-53.
[4]赵翔,陆启玉,章绍兵,等.水剂法同时提取花生油和蛋白质的工艺研究[J].农业机械,2012(12):35-37.
[5]王瑛瑶.水酶法从花生中提取油与水解蛋白的研究[D].无锡:江南大学,2005.
[6]赵翔.花生水剂法提油过程中形成乳状液的酶法破乳研究[D].郑州:河南工业大学,2012.
[7]罗述博.水酶法提取籽瓜种子油脂及水解蛋白的研究[D].呼和浩特:内蒙古农业大学,2012.
[8]矫丽媛,吕敬军,陆丰升.花生分离蛋白提取工艺优化研究[J].食品科学,2010,31(20):196-201.
[9]王子伟.菜籽肽的酶法制备及其抗凝血活性研究[D].郑州:河南工业大学,2014.
[10]Chabrand R M,Kim H J,Zhang C,et al.Destabilization of the emulsion formed during aqueous extraction of soybean oil[J].Journal of the American Oil Chemists' Society,2008,85(4):383-390.
[11]Chelulei C S,王璋,许时婴.大孔吸附树脂提取苦味乳清蛋白水解物及其功能性质和生物活性的研究[J].食品科学,2006,27(8):103-107.
[12]Petruccelli S,A ón M C.Relationship between the method of obtention and the structural and functional properties of soy proteins isolates.1.Structural and hydration properties[J].Journal of Agricultural and Food Chemistry,1995,43(3):854.
[13]Joshi M,Adhikari B,Aldred P,et al.Interfacial and emulsifying properties of lentil protein isolate[J].Food Chemistry,2012,134(3):1343-1353.
[14]周春霞,杨晓泉,温其标.大豆11S 球蛋白在空气-水界面上的吸附动力学[J].食品与生物技术学报,2006,25(6):58-62.
