亚麻籽饼粕中亚麻蛋白的初步泡沫分离
2015-03-27李轩领陈元涛
李轩领,张 炜,陈元涛,陈 亮
(青海师范大学 化学系,润德亚麻籽工程技术研究中心,青海 西宁 810008)
0 引言
亚麻(Linum usitatissimum),又称胡麻,是一种油纤兼用的作物,在我国新疆、青海、甘肃、宁夏、内蒙古、河北、黑龙江都有大面积种植[1].亚麻籽由于其较高的亚麻油含量,已经成为了一种重要的油料作物,其经过溶剂浸提或机械压榨取油后的残余物经粉碎或压片处理即为亚麻籽饼粕.亚麻籽饼粕中蛋白质含量为32%~49%[2],是一种很好的蛋白资源,含有人体所需的全部必需氨基酸.与大豆相比,亚麻籽中含有更多的天门冬氨酸、谷氨酸、异亮氨酸、蛋氨酸和精氨酸[3].然而目前亚麻饼粕除限量用于动物饲料外,一般作为肥料或者废物处理,这不仅造成了资源浪费,而且亚麻籽饼粕的潜在价值远远没有开发出来.
目前,提取亚麻籽饼粕中蛋白常用的方法是碱提酸沉[4]、超声波辅助提取[5]以及酶解法提取[6].其原料一般采用脱胶脱脂的亚麻籽饼粕,亚麻籽胶被直接酶解除去或者当成无用的废料丢弃,这样不仅会降低蛋白的提取率,加大蛋白的提取难度,而且对于亚麻籽胶也是一种很大的浪费.所以需要一种新的分离方法,在保留亚麻籽胶的同时将亚麻蛋白分离出来.
泡沫分离是20 世纪初兴起的一种以气泡为分离介质,运用表面吸附原理对表面活性物质进行分离的新技术.最初,它主要用于矿物的浮选和痕量物质的分离、提取方面.目前已较多应用在植物提取物的蛋白[7]、皂苷[8-9]等的分离提取中.前期研究表明,亚麻籽胶也有很好的发泡特性[10],但由于亚麻籽胶与亚麻蛋白发泡能力不一样,可以通过改变pH、添加NaCl 等实现它们的有效分离.
笔者直接使用未脱胶的亚麻籽饼粕,在本实验室已有的试验成果基础上使用响应面法[11]优化泡沫分离亚麻籽饼粕提取物,使提取出的亚麻蛋白得到浓缩,并为以后亚麻籽胶和亚麻蛋白的泡沫分离打下基础,旨在提高亚麻籽饼粕的开发利用率.
1 材料与方法
1.1 材料
亚麻籽饼粕:青海润德生物科技有限公司;牛血清蛋白标准品(批号:20120202):上海源叶生物科技有限公司;葡萄糖标准品:Sigma 公司;苯酚、硫酸、考马斯亮蓝G250、磷酸、乙醇均为试剂纯.
1.2 仪器与设备
TU-1901 双光束紫外可见分光光度计:北京普析通用仪器有限责任公司;恒温泡沫分离装置:自制(图1),恒温泡沫分离柱(内径35 mm,外径40 mm,柱高400 mm,最大装液量为400 mL);LZB 型玻璃转子流量计:南京顺来达测控设备有限公司;FB45/7 空压机:上海捷豹压缩机制造有限公司;F5J2A 双层玻璃反应釜:上海申生科技有限公司;IKA RV-10 旋转蒸发仪:广州仪科实验室技术有限公司;PB10 pH 计:梅特勒-托利多上海仪器有限公司;Sartorius BSA224S-CW 分析天平:赛多利斯科学仪器北京有限公司;HK-2A 超级恒温水浴:南京大学应用物理研究所.

图1 恒温泡沫分离装置Fig.1 Constant-temperature foam separation device
1.3 试验方法
1.3.1 亚麻蛋白的提取
取亚麻籽饼粕2 g,加入蒸馏水(料液比1∶100),机械搅拌,加热至85 ℃并在此温度下提取1 h,离心机离心10 min,储存备用.
1.3.2 测定方法
总糖含量的测定:苯酚-硫酸法[12].
蛋白质含量的测定:考马斯亮蓝法[13].
1.3.3 亚麻籽饼粕提取液的泡沫分离
取一定量亚麻籽饼粕提取液,倒入自制泡沫分离装置中,通入空气进行泡沫分离,至没有泡沫产生为止,鼓泡后收集泡沫层,测定泡沫层和残留液体积,测定原液、残留液和泡沫层中的蛋白质含量和总糖含量.
1.3.4 亚麻饼粕中亚麻蛋白分离效果表征
亚麻蛋白的分离效果可用富集比和蛋白质回收率来表征.计算公式如下:
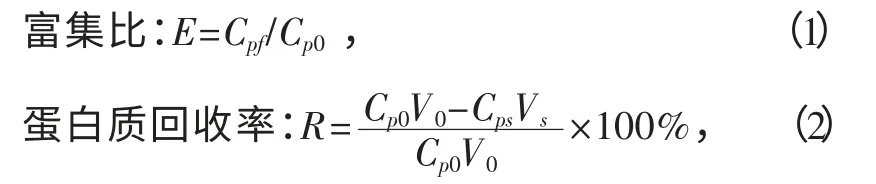
式中:Cp0、Cps分别是亚麻籽饼粕提取液中初始蛋白质量浓度和残留液蛋白质量浓度,mg/mL;Cpf为泡沫层中的蛋白质量浓度,mg/mL;V0和Vs分别为亚麻籽饼粕提取液初始体积和残留液体积,mL.
2 结果与分析
2.1 亚麻蛋白质量浓度对亚麻蛋白泡沫分离效果的影响
在pH=4、装液量为200 mL、未添加NaCl 的条件下,选取不同亚麻蛋白质量浓度的亚麻籽饼粕提取液进行泡沫分离,研究不同料液质量浓度对泡沫分离效果的影响,结果见图2.
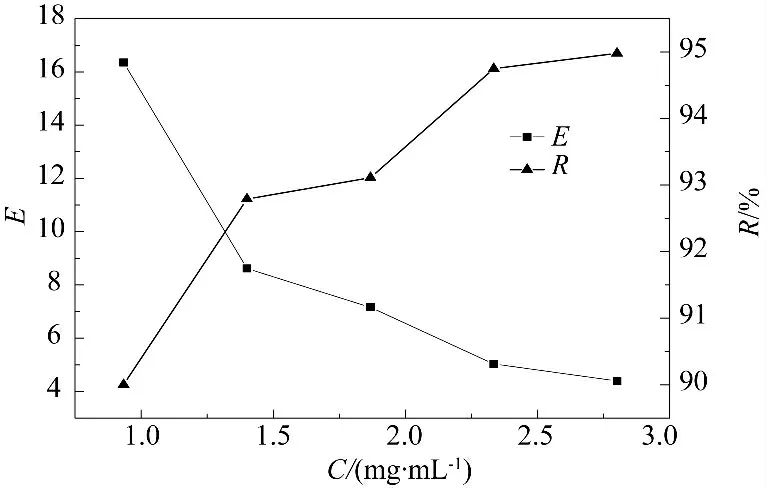
图2 亚麻蛋白质量浓度对亚麻蛋白泡沫分离效果的影响Fig.2 Influences of flaxseed protein mass concentration on the foam separation effect
从图2 可以看出,当料液质量浓度较低时回收率较低,富集比较高,这是因为在质量浓度较低的情况下,泡沫夹带较少,所以鼓出去的泡沫较少,泡沫层中蛋白质量浓度较高,富集比高.由于质量浓度较低,溶液中蛋白质随泡沫鼓出量减少,回收率降低,然而由于pH 值是4,导致蛋白质表面活性改变,所以可以看出质量浓度对回收率的影响不是很大.质量浓度较高的话,泡沫夹带变多,泡沫层中夹带较多的水和多糖等,导致泡沫层体积变大,富集比降低.
2.2 pH 值对亚麻蛋白泡沫分离效果的影响
在亚麻蛋白质量浓度为2 mg/mL、装液量为200 mL、未添加NaCl 的条件下,选取不同pH 的亚麻籽饼粕提取液进行泡沫分离,研究不同pH 值对泡沫分离效果的影响,结果见图3.

图3 pH 值对亚麻蛋白泡沫分离效果的影响Fig.3 Influences of pH value on the foam separation effect
由图3 可以看出,当pH 值在3 左右时富集比和回收率均达到最大,这是由于该pH 值接近蛋白质等电点.pH 值如果变大的话,蛋白质表面电荷改变,发泡特性变差,更容易与亚麻籽胶等多糖发生反应,影响亚麻蛋白品质,并使得回收率和富集比都大幅减小.如果pH 值太小,试验中蛋白质会变性成固体析出,不能进行泡沫分离.
2.3 装液量对亚麻蛋白泡沫分离效果的影响
在pH=4、亚麻蛋白质量浓度为2 mg/mL、未添加NaCl 的条件下,选取不同装液量的亚麻籽饼粕提取液进行泡沫分离,研究不同装液量对泡沫分离效果的影响,结果见图4.

图4 装液量对亚麻蛋白泡沫分离效果的影响Fig.4 Influences of solution loading amount on the foam separation effect
从图4 可以看出,当装液量大于200 mL 时富集比出现较明显下降,而回收率持续增加,这说明装液量大于200 mL 时,产生的泡沫在分离塔停留时间较短,泡沫夹带较多,导致富集比减少,回收率增加.而装液量过少的话,泡沫停留时间较长,泡沫中携带的液体回流至原液中较多,使得蛋白浓度变大,富集比增加,同时由于能够鼓出分离塔料液变少,回收率也减少.
2.4 NaCl质量分数对亚麻蛋白泡沫分离效果的影响
在pH=4、亚麻蛋白质量浓度为2 mg/mL、装液量为200 mL 条件下,选取添加不同质量分数NaCl的亚麻籽饼粕提取液进行泡沫分离,研究不同NaCl 对泡沫分离效果的影响,结果见图5.
由图5 可以看出,NaCl 质量分数在0.9%时富集比和回收率达到最大值,这可能和溶液浓度有一定的关系.当蛋白质量浓度为2 mg/mL,NaCl 质量分数达到0.9%时,其电荷已经可以使蛋白质表面活性达到最大,所以增大NaCl 质量分数不能再使回收率和富集比增加,反而会使其回收率和富集比大幅减少.
2.5 响应曲面法
采用响应面法对泡沫分离工艺参数进行4 因素3 水平试验设计,具体设计及结果见表1.
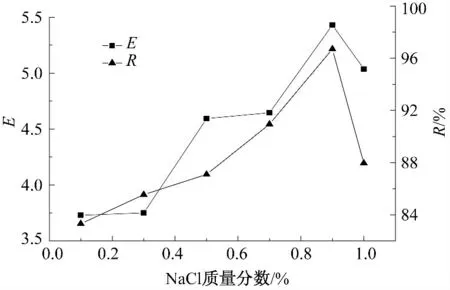
图5 NaCl 质量分数对亚麻蛋白泡沫分离效果的影响Fig.5 Influences of NaCl mass fraction on the foam separation effect
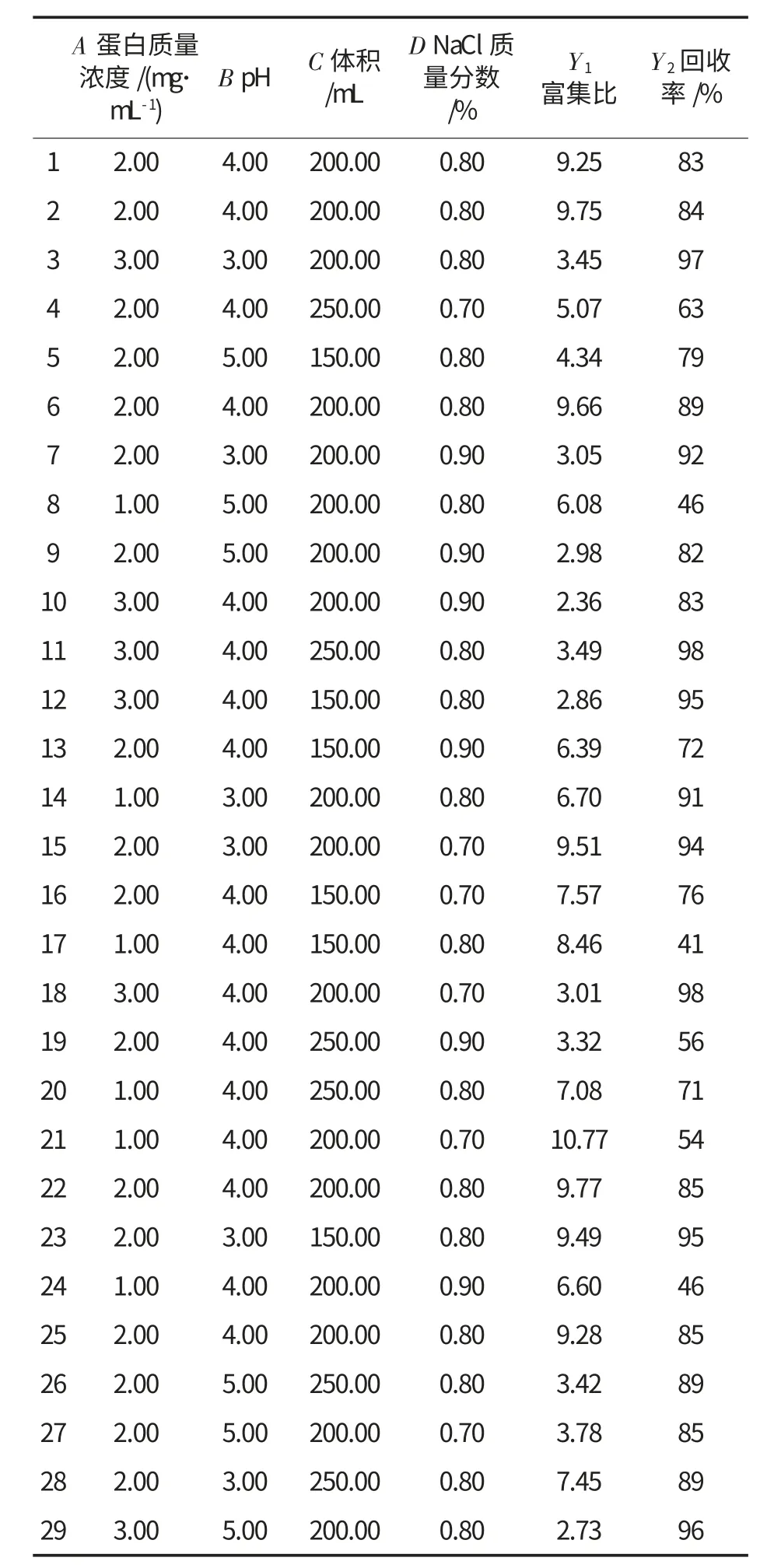
表1 方案设计及试验结果Table 1 Design and results of response surface experiments
2.5.1 富集比回归模型
利用Design-Expert 8.0.6 软件对表1 的试验数据进行多元回归拟合,得到亚麻蛋白质富集比对亚麻蛋白质量浓度、装液量、pH 及NaCl 质量分数的二次多项回归模型为:
E=9.54-2.32×A-1.36×B-0.77×C-1.25×D-0.026×AB+0.50×AC+0.88×AD+0.28×BC+1.41×BD-0.14×CD-2.24×A2-2.31×B2-1.57×C2-2.14×D2.
对该模型进行显著性检验及回归模型系数显著性分析,结果见表2,响应曲面图见图6.由表2可知,A、B、C、D、BD,A2、B2、C2、D2表现出极显著影响,而AB、AC、AD、BC 和CD 对试验影响较小.模型整体表现为极显著,表明该模型有显著意义.
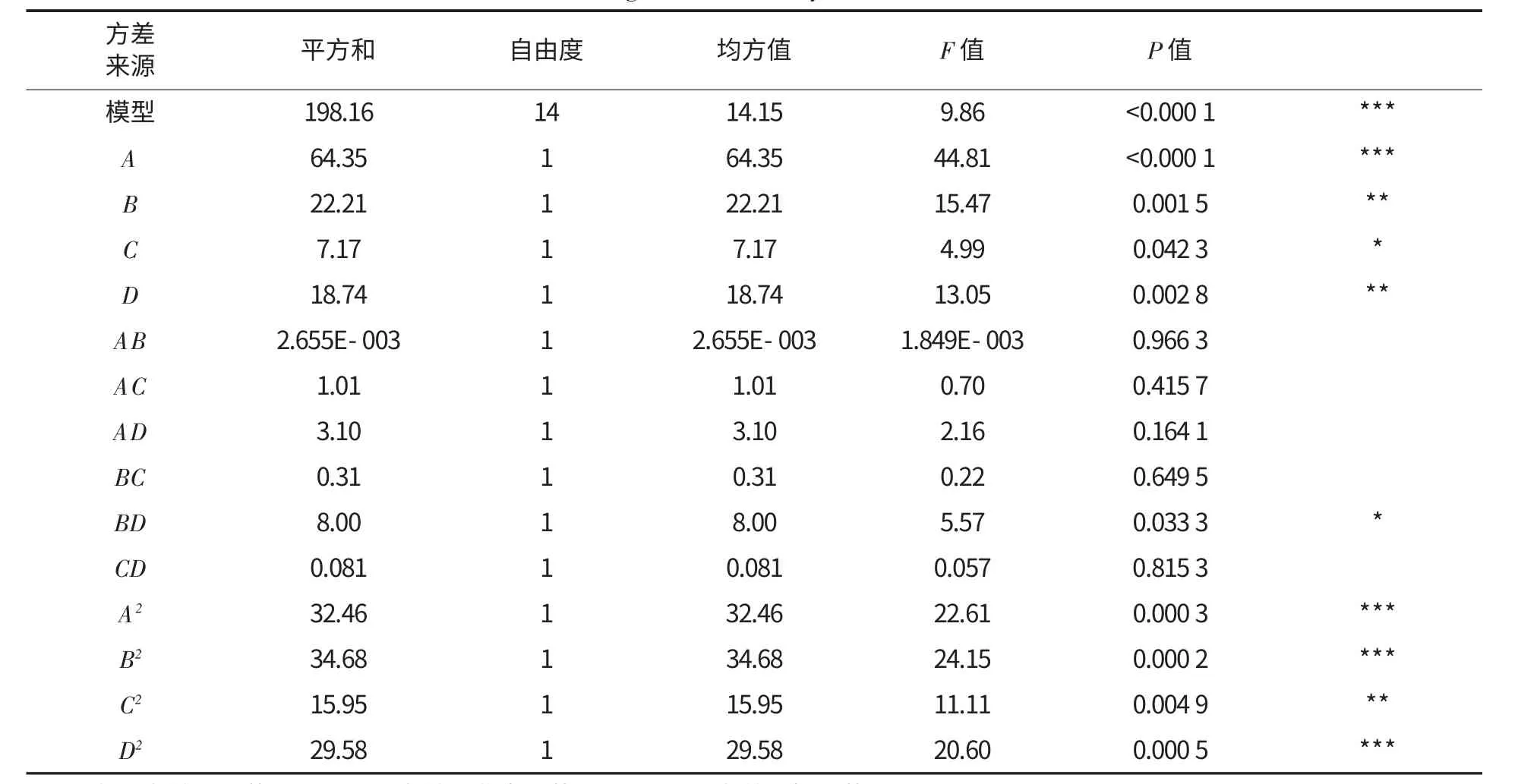
表2 富集比模型的方差及显著性分析Table 2 Variance and significance analysis of enrichment ratio model
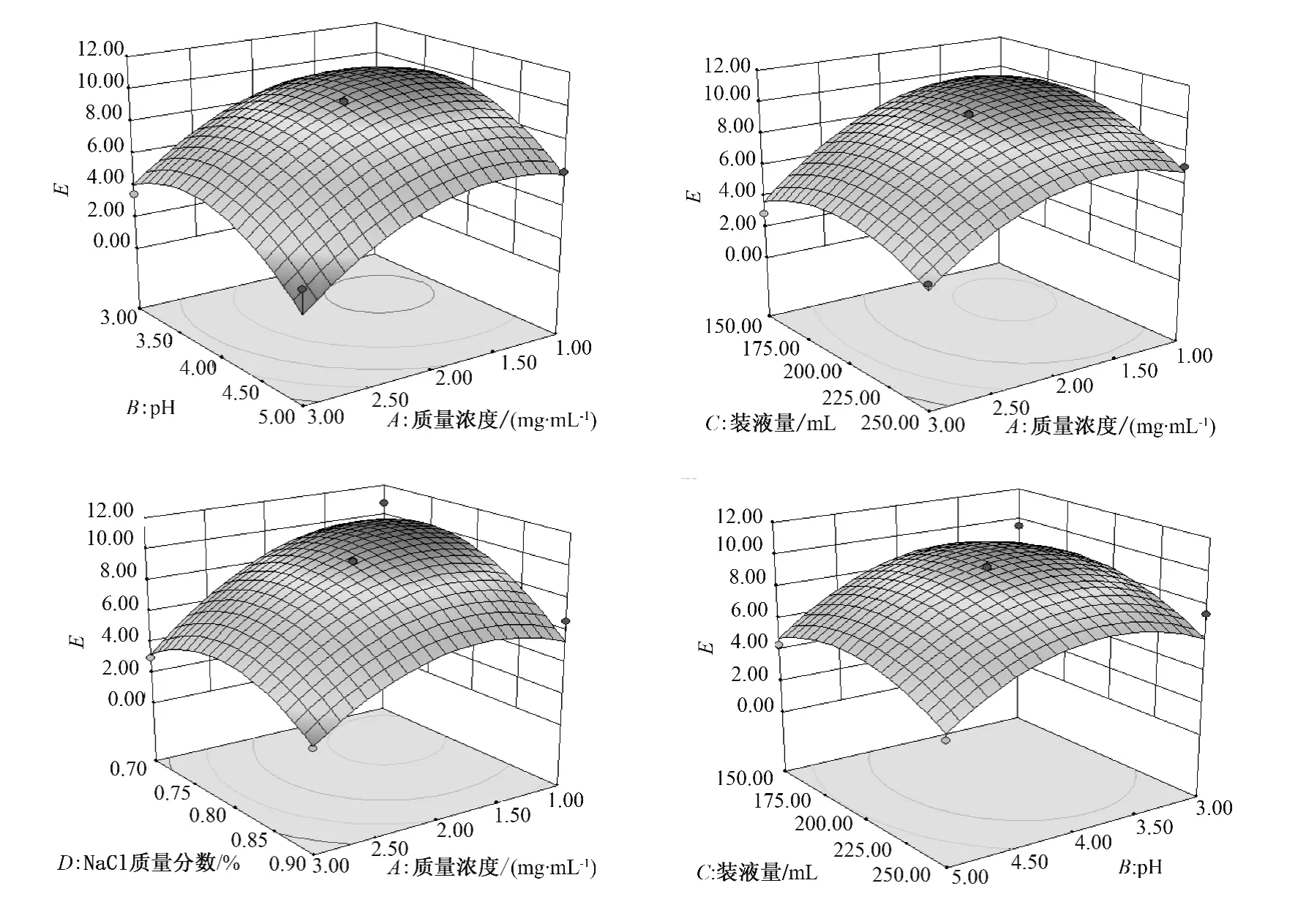

图6 富集比的响应曲面图Fig.6 Response surface of enrichment ratio
等高线图可以直观地反映出两变量交互作用的显著程度,圆形表示两因素交互作用不明显,而曲率半径较大的椭圆则表示两因素交互作用显著,并且曲率半径越大,交互作用越显著,即椭圆越扁平,交互作用越显著.由图6 可以看出,质量浓度和pH 之间,离子强度和装液量之间交互作用显著,其余几项交互作用不明显.并且NaCl 浓度对富集比影响不是很大,而蛋白质量浓度和pH 对于富集比有显著影响.
2.5.2 回收率回归模型
利用Design-Expert 8.0.6 软件对表1 试验数据进行多元回归拟合,得到亚麻蛋白质回收率对亚麻蛋白质量浓度、装液量、pH 及NaCl 浓度的二次多项回归模型为:

对该模型进行显著性检验及回归模型系数显著性分析,结果见表3,响应曲面图见图7.由表3可知,A、B、AB、B2、D2表现出极显著影响,而C、D、AC、AD、BC、CD、A2、C2对试验影响较小.模型整体表现为极显著,表明该模型有显著意义.

表3 回收率模型的方差及显著性分析Table 3 Variance and significance analysis of recovery model
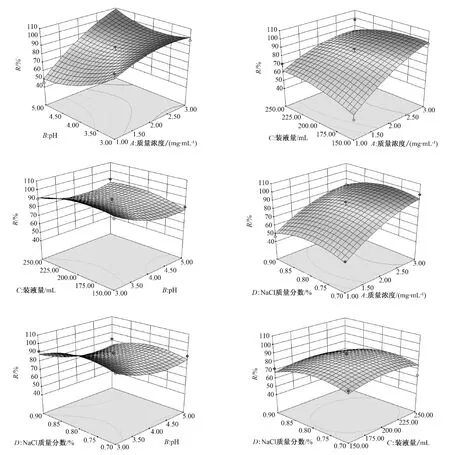
图7 回收率的响应曲面Fig.7 Response surface of recovery
通过图7 可以看出,质量浓度变大回收率升高,说明质量浓度对回收率有显著影响,而pH 值为3 时回收率最大.装液量以及NaCl 质量分数对于回收率影响有限,但是有显著的交互影响.pH在蛋白质量浓度较低时对回收率有显著影响,当蛋白质量浓度升高后影响不显著,说明溶液蛋白质量浓度过高产生的发泡程度过于显著,导致回收率升高、富集比显著下降.
2.6 试验结果验证
通过Design Expert 软件分析,泡沫分离法提取亚麻蛋白的最佳工艺条件为:蛋白质量浓度为1.77 mg/mL,pH 值为3.0,装液量为186 mL,NaCl质量分数为0.75%.在该条件下亚麻蛋白的富集比为10.07,回收率达到97%.
为了检验响应曲面法模型的可靠性,采用上述优化条件进行验证试验,为了方便试验,将泡沫分离工艺参数修正为:料液浓度1.8 mg/mL,pH 值3.0,装液量190 mL,NaCl 浓度为0.75%.在此条件下进行泡沫分离,实际测得的亚麻蛋白质的富集比为9.80,回收率为95.8%,与理论值比较接近.因此,建立的二次型模型与实际情况基本吻合.
验证试验中泡沫层体积仅为10 mL,残留液中多糖浓度与原液中多糖浓度相比基本没有变化.计算得到多糖的损失率仅为6.7%,说明本试验可以把亚麻籽饼粕提取液中亚麻蛋白与亚麻籽胶进行初步分离.
3 结论
使用泡沫分离法对亚麻籽饼粕的提取液进行鼓泡分离,最终得出分离亚麻蛋白最佳条件为:蛋白质量浓度1.8 mg/mL,pH 值3.0,装液量190 mL,NaCl 质量分数0.75%.在此条件下,亚麻蛋白质的富集比为9.80,回收率为95.8%,多糖的损失率仅为6.7%.由此表明,采用泡沫分离技术可以实现未脱胶亚麻籽饼粕中亚麻蛋白的分离纯化,是亚麻蛋白初级分离的一种有效方法.
[1]陈海华,许时婴,王璋.亚麻籽胶的研究进展与应用[J].食品与发酵工业,2002,28(9):64.
[2]Yoshie-Stark Y,Mueller K,Kawarada H,et al.Functional properties of linseed meal fractions:application as nutraceutical ingredient[J].Food Science and Technology Research,2011,17(4):301-310.
[3]施树.胡麻分离蛋白的提取及其性质的研究[D].重庆:西南大学,2008.
[4]许光映,胡晓军,张清华,等.从亚麻籽仁饼中提取分离蛋白的工艺条件[J].山西农业科学,2012,40(8):874-877.
[5]胡爱军,田方园,卢秀丽,等.亚麻饼粕蛋白的超声辅助提取工艺研究[J].食品与发酵科技,2013,49(3):30-32.
[6]张慧君,孙岩,王丽娜,等.响应面优化酶解法提取亚麻粕蛋白的工艺研究[J].食品工业,2013(8):24.
[7]杨博,王永华,姚汝华.蛋白质的泡沫分离[J].食品与发酵工业,2001,27(2):76-79.
[8]魏凤玉,方菊,张静,等.连续泡沫分离法纯化无患子总皂苷的研究[J].中草药,2011,42(9):1728-1731.
[9]修志龙,张代佳,贾凌云.泡沫分离法分离人参皂苷[J].过程工程学报,2001(3):289-293.
[10]李轩领,张炜,陈元涛,等.泡沫分离法纯化亚麻胶中的酸性多糖[J].食品科技,2014,39(5):226-230.
[11]张瑞,邢军,张娟,等.响应面法优化万寿菊中类胡萝卜素的提取工艺[J].食品工业科技,2012,33(22):319-322.
[12]张惟杰.糖复合物生化研究技术[M].2 版.杭州:浙江大学出版社,1999:193.
[13]Liau C Y,Lin C S.A modified coomassie brilliant blue G250 staining method for the detection of chitinase activity and molecular weight after polyacrylamide gel electrophoresis[J].J Biosci Bioeng,2008,106(1):111-113.
