基于高代姊妹系组群研究小麦-簇毛麦染色体T6VS.6AL易位的遗传效应
2015-03-26别同德高德荣庄丽芳赵仁慧陈甜甜张伯桥
别同德, 高德荣,2, 张 晓, 庄丽芳, 赵仁慧, 陈甜甜, 张伯桥
(1.江苏里下河地区农业科学研究所/农业部长江中下游小麦生物学与遗传育种重点实验室,江苏 扬州 225007;2.主要粮食作物产业化湖北省协同创新中心,湖北 荆州 434023;3.南京农业大学作物遗传与种质创新国家重点实验室,江苏 南京 210095)
簇毛麦(Haynaldia villosa,2n=14,VV)是小麦野生近缘种,具有多花、多实、抗多种病害等有利性状,是小麦遗传改良重要基因资源[1]。陈佩度等利用英国剑桥植物园引进的簇毛麦育成了抗白粉病小麦-簇毛麦T6VS.6AL易位系[2]。由于6V染色体短臂上载有抗白粉病基因Pm21,对现有已知白粉病小种均表现免疫,受到国内外小麦育种界关注。上世纪90年代以来,T6VS.6AL易位系在小麦抗白粉病育种中得到广泛利用,迄今已育成南农9918、内麦9号、石麦14、扬麦18等20余个高抗白粉病小麦品种[3]。
为研究T6VS.6AL易位的遗传效应,Li等[4]利用5个组合14个回交高代品系研究了T6VS.6AL易位的农艺和品质效应。由于单组合内样本少、品系间各性状变异幅度较大、各品系生态适应型不同等复杂因素,T6VS.6AL易位的遗传效应多为倾向性结论。
程顺和等[5]认为品种育成初期存在剩余变异,存在种性再加工的可能性和必要性。一个品种的育成一般需要10多代的选择和纯化,单一品种内不同个体间遗传组成已高度一致,但天然的纯系是没有的,品种基因组内仍然会存在较低频率的异质性,这种异质性也表现为表型上的细微差异。由异质位点衍生的高代姊妹系间构成了天然的近等基因系关系。与寡样本近等基因系(NIL)相比,我们认为针对同一异质位点构建较大样本量的高代姊妹系组群,可以弱化或中和其他异质位点(遗传背景)的影响,有利于凸显目标异质位点的各类遗传效应。
扬麦18是利用T6VS.6AL易位系育成的抗白粉病弱筋小麦新品种。基于本研究需要,自2007年开始,对扬麦18参加区域试验的原始种子(参试名称:扬03G12)进行了株行种植和抗病鉴定,在其中发现少量白粉病抗性分离株行,对这些抗白粉病单株、感白粉病单株进行多年自交纯化,构建了抗病系组群和感病系组群,为准确评估T6VS.6AL易位的遗传效应提供了宝贵材料。
本研究将通过上述抗病系组群与感病系组群的比较,系统分析T6VS.6AL易位对小麦农艺和品质性状的影响,以期为T6VS.6AL易位的育种利用提供有益的建议。
1 材料与方法
1.1 试验材料
扬麦18是由江苏里下河地区农业科学研究所培育的高抗白粉病品种,由南农P045与扬麦88-128的杂种F1与扬麦158回交5次,再与宁麦9号回交3次获得。簇毛麦(2n=14,VV)种质来自英国剑桥植物园。抗性供体南农P045是由南京农业大学细胞遗传研究所培育的T6VS.6AL抗白粉病易位系。抗白粉病、感白粉病高代姊妹系由参加区域试验的扬麦18原始种子中抗性杂合株自交纯化获得。
1.2 试验方法
1.2.1 抗白粉病和感白粉病姊妹系细胞学和分子标记鉴定 根尖细胞(RTC)制片参照Gill等[6]的方法。簇毛麦基因组DNA提取参照Sharp等[7]的方法。基因组原位杂交(GISH)程序参照Zhang等[8]的方法。GISH图像通过SPOT CCD获取。
分子标记鉴定采用Bie等[9]开发的6V染色体短臂末端特异性EST-STS标记6VS-381,其正向引物序列为5′-CCAGTCGGAGAGGATCTCAA-3′,反向引物序列为5′-TGGGCCTCTTGATCTTGACT-3′。PCR反应体系25 μl,包括50 ng模板DNA,左右引物终浓度各0.2 μmol/L,200 mmol/L dNTP,1 U Taq DNA聚合酶,1×聚合酶专用Buffer(TaKaRa公司生产)。PCR反应程序:94℃预变性3 min;然后94℃变性30 s,60℃退火40 s,72℃延伸1 min,35个循环;最后72℃延伸5 min。PCR产物经8%非变性聚丙烯酰胺凝胶电泳、银染显色参照Sourdille等的方法[10]。
1.2.2 田间试验、农艺性状数据采集和统计分析
大田试验每个株系种3行,行长1.5 m,行距25 cm,每行40株。保持试验区内肥水运筹一致,抗感株系穿插种植以减少局部肥水不均给统计值带来的偏差。与此同时,各株系在大棚中鉴定白粉病抗性。成熟前,每株系随机抽取30株,考查株高、穗长、旗叶长度、每穗小穗数、小穗密度(用1 cm穗长中小穗数表示)、单株总粒数、每穗粒数、每株穗数等主要农艺参数。完熟后,测定千粒质量和株行产量。各类农艺参数按白粉病抗性表现分为抗、感2个组群进行方差分析,因2个组群样本量均大于30,故采用μ测验法进行抗、感组群间差异显著性检测,数据统计采用Microsoft Excel软件。
1.2.3 品质测试和统计分析 参照AACC 26-20方法,用国产无锡布勒实验磨(MLU-202)制备面粉。润麦(将小麦调整至目标水分含量14.5%,磨粉前再上调0.5%)时间为12~18 h,所需润麦加水量(ml)=[(100-原始水分)/(100-所需水分)-1]×样品质量(g)。
面粉溶剂保持力(SRC)按AACC 56-11方法分别测定水SRC、50%乳酸SRC、5%碳酸钠SRC和50%蔗糖SRC,重复2次。
籽粒蛋白质含量采用瑞典Perten公司生产的DA7200整粒型近红外分析仪测定,样品用量15 g左右,重复2次。
籽粒硬度采用瑞典Perten公司生产的SKCS-4100型单粒谷物特性测定仪测定,硬度指数是无量纲单位,硬度值大于60为硬质,小于40为软质,40~60为混合麦。样品用量为100~300粒。
湿面筋含量和面筋指数利用瑞典Perten公司生产的2200型面筋洗涤仪进行测定,参照国家标准GB/T14608-93进行,结果换算成14%湿基条件下的面筋含量。重复2次。
粉质仪参数利用德国 Brabender公司生产的810104型电子粉质仪,按AACC 54-21方法测定吸水率、面团形成时间、稳定时间、断裂时间、粉质质量指数等面团流变学特性参数。结果由系统软件自动分析。重复2次。
SDS沉淀值采用张晓等[11]开发的微量法进行测定,重复2次。
各类品质参数按抗病系组群和感病系组群进行方差分析,因用于品质测定的2个组群至少有1组样本量不足30,故采用两尾t测验法进行差异显著性检测,数据统计采用Microsoft excel软件。
2 结果与分析
2.1 抗白粉病姊妹系、感白粉病姊妹系细胞学与分子标记鉴定
随机选择遗传稳定的抗白粉病姊妹系、感白粉病姊妹系各5个,对各品系RTC进行GISH鉴定。结果显示,抗病系RTC的GISH图像中均出现一对整臂易位染色体,外源染色体臂末端呈现较强杂交信号,为6VS末端特征GISH-带纹,表明携带Pm21基因的T6VS.6AL易位染色体为纯合状态(图1a)。考查感病系RTC制片的GISH图像,均没有发现簇毛麦染色体(图1b),说明T6VS.6AL易位染色体的存在与否直接导致了姊妹系间的抗性差异。
利用簇毛麦6VS染色体末端 EST-STS标记6VS-381对抗白粉病姊妹系、感白粉病姊妹系进行鉴定,结果显示所有抗病品系均含有6VS染色体特异的381 bp扩增条带,而所有感病品系均没有该扩增条带(图2),说明姊妹系间的抗感差异来自6VS的存在与否,这与GISH鉴定结果一致。由于簇毛麦6VS染色体在小麦背景中不发生重组,6VS-381可用于小麦遗传背景中T6VS.6AL易位染色体的分子标记追踪。

图1 抗白粉病姊妹系、感白粉病姊妹系的GISH鉴定Fig.1 Cytogenetic identification of powdery mildew resistant and susceptible sib-lines of wheat by GISH

图2 抗、感白粉病姊妹系的分子标记鉴定Fig.2 Identification of powdery mildew resistant and susceptible wheat sib-lines by molecular marker
2.2 抗白粉病姊妹系、感白粉病姊妹系主要农艺参数比较
对抗病系组群和感病系组群各农艺参数进行方差分析和差异显著性比较,u测验结果表明:抗病系千粒质量、株高、穗长和旗叶长度均极显著高于感病品系;抗病系的每穗小穗数显著高于感病品系,但小穗密度极显著低于感病品系(表1)。
比较抗白粉病姊妹系、感白粉病姊妹系的每穗粒数、每株穗数、单株总粒数和株系产量,均未发现显著差异,说明T6VS.6AL易位对上述性状没有显著不良影响。
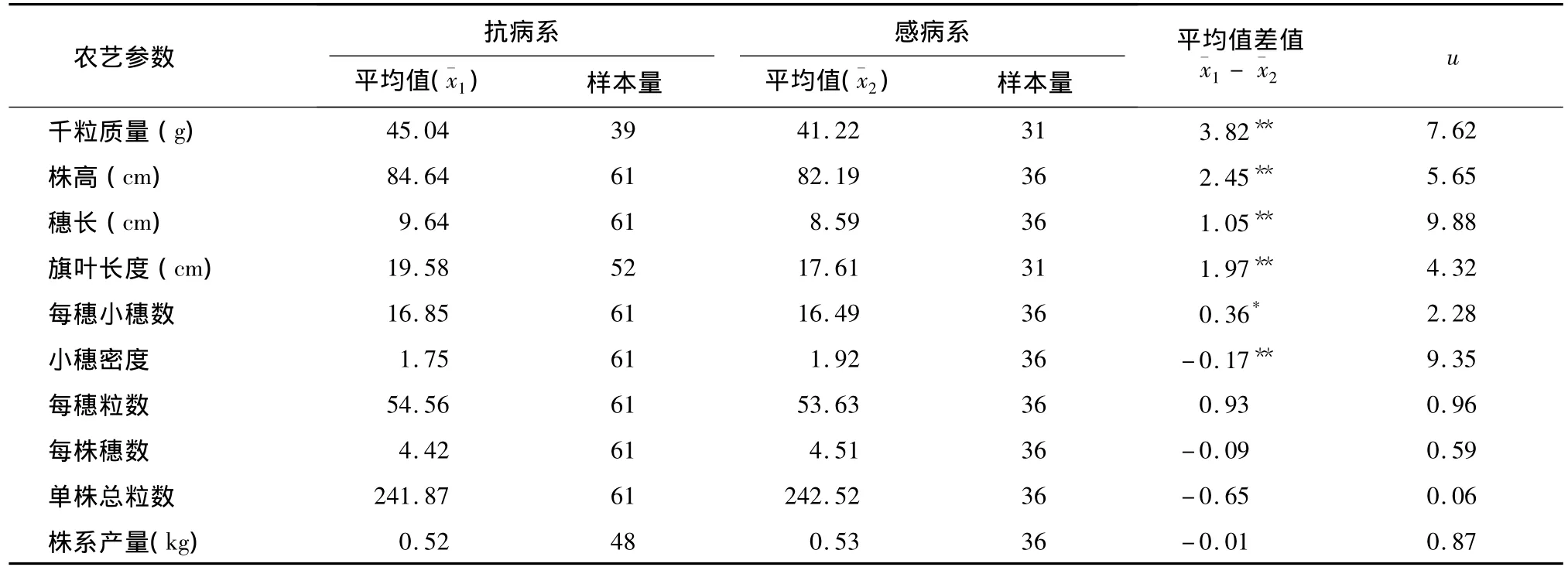
表1 抗白粉病姊妹系、感白粉病姊妹系主要农艺参数的u测验结果Table 1 U-test of agronomic traits between resistant and susceptible wheat sib-lines
2.3 抗白粉病姊妹系、感白粉病姊妹系的品质性状比较
对抗白粉病姊妹系、感白粉病姊妹系组群进行各类品质参数的检测结果表明,在SRC、硬度、湿面筋含量、SDS沉淀值、蛋白质含量以及所有粉质仪参数中,仅蔗糖SRC和硬度2个指标在抗、感姊妹系间差异达显著水平(表2)。尽管抗病系硬度显著低于感病系,但二者均属于偏软质小麦类型,说明T6VS.6AL易位对硬度的影响有限。在4种SRC中,仅蔗糖SRC在抗、感组群间差异达显著水平。总体来看,T6VS.6AL易位不会影响小麦品质类型。
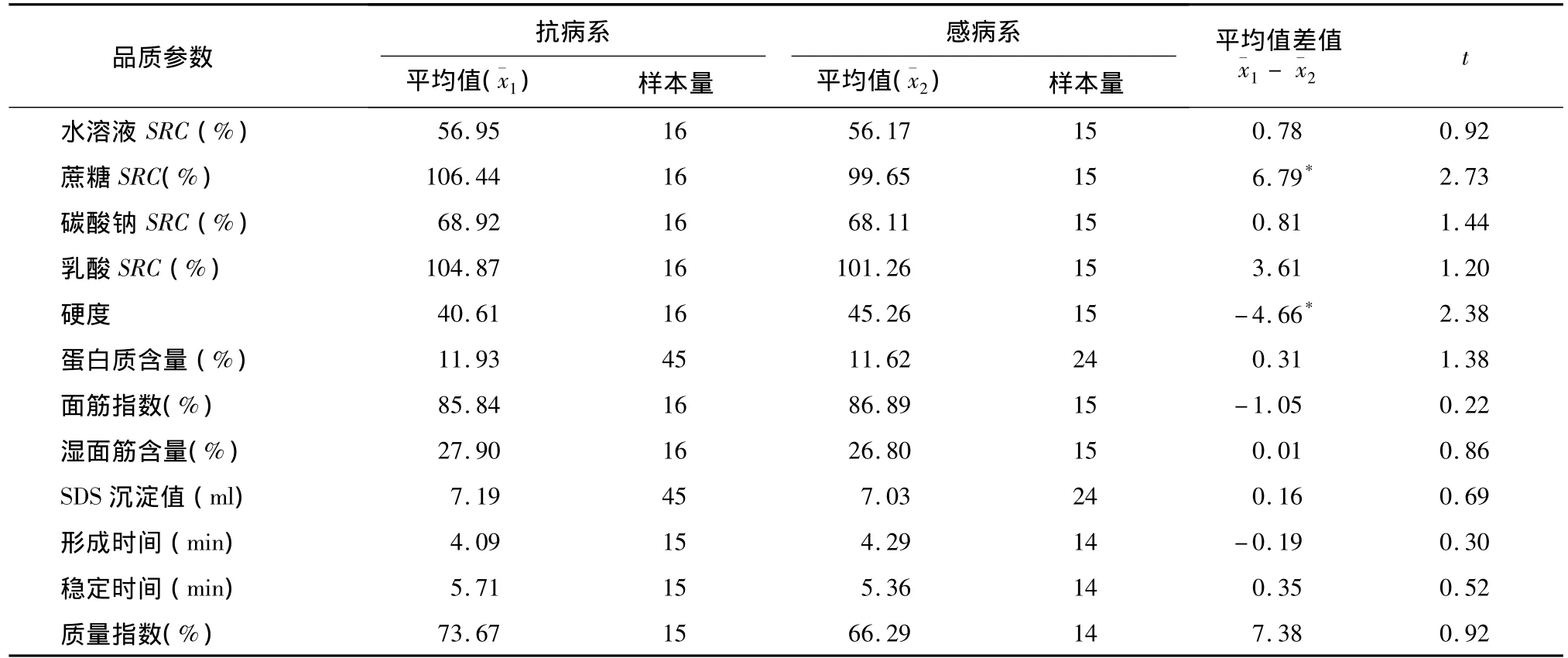
表2 抗、感白粉病姊妹系的主要品质参数t测验结果Table 2 T-test of quality traits between resistant and susceptible wheat sib-lines
3 讨论
本研究利用高代姊妹系组群比较方法,系统分析了T6VS.6AL易位对小麦主要农艺和品质性状的影响。研究发现,T6VS.6AL易位对千粒质量的提高作用明显,增幅高达9.3%,近似于一个主基因效应,这有利于提高品种的商品性,这是继抗白粉病性状之后T6VS.6AL易位在产量要素方面的一个重要利好。在育种实践中,通过合理的选择,育种家有可能做到在保持穗数、粒数两要素持平的前提下适当增加千粒质量,达到增产的目的。
株高是小麦的重要性状,一般而言,高秆品种抗倒性不及矮秆品种。研究结果显示,T6VS.6AL易位对株高有极显著正向效应,但增幅较小(3.0%)。因此,当以株高为80~90 cm的推广品种为轮回亲本时,这样的增幅是完全可以接受的。其次,由于株高的数量性状特征,影响株高的QTL位点在双亲间存在多样性,人工选择的介入可以有效培育株高与轮回亲本相似或更低的新品种。
T6VS.6AL易位对小麦旗叶长度也具有极显著正向效应且增幅较大(11.2%),这可能会影响群体的通风透光。在育种实践中,育种家更倾向于筛选旗叶短窄挺立的材料,以增强群体的通风透光性。本试验组合中由于最后一个轮回亲本宁麦9号叶型宽大披散,加上T6VS.6AL易位对叶长的增效作用,使得在扬麦18原始群体中筛选理想叶型更为困难。因此,在利用T6VS.6AL易位系进行滚动回交育种时,应尽可能选择剑叶相对挺拔短窄的小麦品种作为最晚轮回亲本。
T6VS.6AL易位对小穗密度具有极显著负向效应而对每穗小穗数有显著正向效应,但这种效应并没有反映在每穗粒数上。每株穗数、单株总粒数以及株系产量在抗、感组群间差异不显著,说明T6VS.6AL易位对产量没有显著影响。综上所述,在高产育种中选择的作用不容忽视。
在品质方面,T6VS.6AL的显著性效应仅体现在蔗糖SRC值的提高和硬度的降低,对蛋白质含量、湿面筋含量、SDS沉淀值、粉质仪参数(面团形成时间、稳定时间)等均没有显著影响,这不同于Li等[4]的研究结果。本研究中,蔗糖SRC和硬度2个指标在抗白粉病、感白粉病组群间差异虽达到显著水平,但不足以影响小麦品质类型,抗白粉病姊妹系、感白粉病姊妹系均属偏软质小麦类型。因此,在育种实践中,相较于品质效应,应更重视T6VS.6AL易位对农艺参数的影响。
在滚动回交育种时,轮回亲本的选择尤为重要。早世代轮回亲本在育成品种中所占基因组份额小,晚世代轮回亲本在育成品种中所占基因组份额大,因此更应重视对晚世代轮回亲本的选择。本研究中,宁麦9号作为晚世代轮回亲本,与早世代轮回亲本扬麦158相比,具有结实性更好、穗数更多、产量更高和抗黄花叶病等优势,这些有利性状均通过晚世代回交选育快速固定于新品种扬麦18中。由于T6VS.6AL易位对于株高和叶长有不利影响,建议选择中矮秆、叶型相对短窄挺拔、丰产性和广适性较好的品种作为较晚世代轮回亲本。同时还应注意避免过度回交,有限回交将为选择留下较大空间,为在导入供体目的基因的前提下育成品种(系)的综合农艺性状全面超越轮回亲本提供可能。
[1] BIE T D,CAO Y P,CHEN P D.Mass production of intergeneric chromosomal translocations through pollen irradiation of Triticum durum-Haynaldia villosa amphiploid[J].Journal of Integrative Plant Biology,2007,49(11):1619-1626.
[2] CHEN P D,QI L L,ZHOU B,et al.Development and molecular cytogenetic analysis of wheat-Haynaldia villosa 6VS/6AL translocation lines specifying resistance to powdery mildew[J].Theoretical and Applied Genetics,1995,91(6-7):1125-1128.
[3] CAO A Z,XING L P,WANG X Y,et al.Serine/threonine kinase gene Stpk-V,a key member of powdery mildew resistance gene Pm21,confers powdery mildew resistance in wheat[J].Proc Natl Acad Sci USA,2011,108(19):7727-7732.
[4] LI G P,CHEN P D,ZHANG S Z,et al.Effects of the 6VS.6AL translocation on agronomic traits and dough properties of wheat[J].Euphytica,2007,155(3):305-313.
[5] 程顺和,张伯桥,高德荣.小麦育种策略探讨[J].作物学报,2005,31(7):932-939.
[6] GILL B S,FRIBE B,ENDO T R.Standard karyotype and nomenclature system for description of chromosome bands and structural aberrations in wheat(Triticum aestivum)[J].Genome,1991,34:830-839
[7] SHARP P J,CHAO S,DESAI D,et al.The isolation,characterization and application in Triticeae of a set of wheat RFLP probes identifying each homoeologous chromosome arm[J].Theor Appl Genet,1989,78(3):342-348.
[8] ZHANG P,LI W,FRIBE B,et al.Simultaneous painting of three genomes in hexploid wheat by BAC-FISH[J].Genome,2004,47 (5):979-987.
[9] BIE T,ZHAO R,JIANG Z,et al.Efficient marker-assisted screening of structural changes involving Haynaldia villosa chromosome 6V using a double-distal-marker strategy[J].Mol Breeding,2015,35 (1):34.doi:10.1007/s11032-015-0211-y.
[10]SOURDILLE P,CHARMET G,TROTTET M,et al.Linkage between RFLP molecular markers and the dwarfing genes Rht-B1 and Rht-D1 in wheat[J].Hereditas,1998,128(1):41-46.
[11]张 晓,李 曼,江 伟,等.小麦三个品质性状微量检测方法的应用与评价[J].麦类作物学报,2014,34(12): 1651-1655.
