芝麻根际生长素产生菌SA4 的分离与鉴定
2015-03-26苏利梅胡名扬
陆 娟,苏利梅,胡名扬,唐 俊
( 阜阳师范学院 生物与食品工程学院,安徽阜阳 236037)
植物根际促生菌( plant growth promoting rhizobacteria,简称PGPR) 是指可以促进植物生长、防治病害、增加作物产量的根际微生物,主要包括假单胞菌、芽孢杆菌、农杆菌等20 多个种属的微生物[1]。普遍认为PGPR 的促生机制主要包括: (1)产生吲哚乙酸( IAA)、赤霉素、细胞分裂素和乙烯等调节植物生长的信号物质[2,3]; (2) 进行非共生固氮[4]; ( 3) 通过产嗜铁素[5]、抗生素[6]和氰化物[7]抵抗病原菌;(4)溶解磷矿物及其它养分[8-10]。目前,已有从玉米[11]、樱桃[12]、棉花[13]、小麦[14]、香蕉[15]、燕麦[16]等植物根际分离筛选出PGPR 的报道。2010 年,康贻军等从多地土壤样品中筛选出14 株PGPR,它们具有体外抑菌、产NH3、产IAA、产HCN、产嗜铁素、解磷、溶钾、固氮以及产抗生素等多种促生能力[17]。生长素是一类含有一个不饱和芳香族环和一个乙酸侧链的内源激素,常指吲哚乙酸,是最早发现的促进植物生长的激素。本研究从芝麻根际筛选具有产IAA 能力的促生菌并进行分子鉴定,丰富了植物根际促生菌资源库,并为进一步开展生长素产生的相关机理研究及开发微生物菌剂奠定基础。
1 材料与方法
1.1 材料
芝麻根取自阜阳师范学院操场后的芝麻地。
1.2 培养基
细菌培养基:胰蛋白胨10 g,酵母膏5 g,氯化钠10 g,琼脂粉15 g,蒸馏水1 000 mL,pH 7.0,121℃灭菌20 min。
鉴定培养基:胰蛋白胨10 g,酵母膏5 g,氯化钠10 g,L-色氨酸100 mg,蒸馏水1 000 mL,pH 7.0,121 ℃灭菌20 min。
1.3 Salkowski 比色液的配制
先向50 mL 蒸馏水中加入1 mL FeCl3溶液(0.5 mol/L),再缓缓加入30 mL H2SO4溶液(98%),轻轻搅拌均匀备用。
1.4 方法
1.4.1 芝麻根际微生物的分离纯化
无菌操作称取芝麻根及附着土壤1 g,无菌水冲洗2 ~3 次,放入99 mL 无菌水中,充分振荡15 min,静置3 ~5 min 后得10-1的土壤悬浊液,10 倍梯度稀释,各吸取0.1 mL 稀释液涂布于细菌培养基,37 ℃培养24 h,挑取不同类型的单菌落多次划线培养进行纯化,4 ℃保存备用。
1.4.2 菌株产IAA 能力的测定
分别将分离纯化的菌株接种于含有L-色氨酸的鉴定培养基中,37 ℃、185 r/min 培养24 h。测量并调各菌悬液的OD530值为0.5。取各菌悬液1 mL分别放入无菌试管中,再加入Salkowski 比色液1 mL,室温避光保存1 h 后观察,以无菌水为阴性对照,颜色变红者,表明能产生IAA,颜色越红产IAA的能力越强。
1.4.3 菌株SA4 对黄瓜种子和玉米种子的促生作用
从根际微生物中筛选出具有产IAA 能力的菌株7 株,其中菌株SA4 产IAA 的能力最强。挑取SA4 单个菌落接种于鉴定培养基中,37 ℃摇瓶培养24 h,5 000 r/min 离心4 min,弃上清,加入无菌水20 ml,振荡2 ~3 min,重复离心、加水、振荡3次,将菌转移到200 ml 无菌水中,制成菌悬液,测菌悬液OD600,并调整至0. 4 ~0. 5 的范围内[18]。在已灭菌培养皿的滤纸上放入15 粒黄瓜种子,并加入菌悬液5 mL,以无菌水为对照,每隔24 h 向各培养皿中加入菌悬液或无菌水1 mL。分别于48 h、72 h、80 h 时测黄瓜主根根长,并在80 h 时测其根总重量。每组重复3 次。菌株SA4 对玉米种子的促生作用操作类似于对黄瓜种子的促生作用,仅玉米种子粒数(10 粒)、后期菌液和无菌水添加量(2 mL)、测定时间( 培养第7 d 时测其主根根长及根重)不同。
1.4.4 菌株SA4 的初步鉴定
常规鉴定:将菌株SA4 在细菌培养基上划线培养,观察菌落形态,并进行革兰氏染色观察。
16S rRNA 基因序列的测定与分析: 提取菌株SA4 基因组,以通用引物(27f:5’-AGAGTTTGATCMTGGCTCAG-3’,1492r:5’-TACCTTGTTACGACTT-3’)进行PCR 扩增,50 μL 的PCR 反应体系含有:PCR buffer 25 μL,200 nmol /L dNTPs 1 μL,正向引物反向引物各2 μL,模板1 μL,Taq DNA 聚合酶1 μL,MgCl23 μL,超纯水15 μL。PCR 反应程序:94℃预变性1 min;94 ℃变性30 s,67 ℃退火30 s,72℃延伸2 min,34 个循环。PCR 产物用1% 琼脂糖凝胶( EB 染色) 电泳检测。PCR 产物由上海生工生物工程有限公司进行序列测定,并利用BLASTN软件进行序列分析,寻找具有较高同源性的16S rRNA 序列,采用mega 5.0 进行多序列比对,用邻近法构建16S rRNA 系统发育树,Bootstrap 值为1 000。
2 结果与分析
2.1 芝麻根际微生物的分离纯化与产IAA 能力的测定
从芝麻根际分离筛选出7 株菌株,依次命名为SA1、SA2、SA3、A4、SA5、SA6、SA7。分别将7 株菌株接种于含有L-色氨酸的鉴定培养基中培养、调OD530,用Salkowski 比色液进行各菌株产IAA 能力的测定,得出菌株SA4 的颜色最红,即该菌株产IAA 的能力最强。
2.2 菌株SA4 对黄瓜种子和玉米种子的促生作用
黄瓜种子和玉米种子经过菌株SA4 处理后,主根生长明显( 图1)。黄瓜种子在经过菌株SA4 处理80 h 后,主根的长度约是对照组的3 倍,总根重约是对照组的2 倍;玉米种子在经过菌株SA4 处理7 d 后,主根的长度约是对照组的3 倍,总根重也约是对照组的3 倍(图2、表1)。结果表明,菌株SA4对黄瓜种子和玉米种子具有明显的促生作用。

图1 菌株SA4 对(A)黄瓜种子和(B)玉米种子的促生作用

图2 菌株SA4 对黄瓜主根根长的影响

表1 菌株SA4 对黄瓜根重和玉米根长、根重的影响
2.3 菌株SA4 的初步鉴定
菌株SA4 菌落为淡黄色,较为干燥( 图3-A);革兰氏染色结果表明SA4 菌呈红色短杆状( 图3-B),属于革兰氏阴性菌。
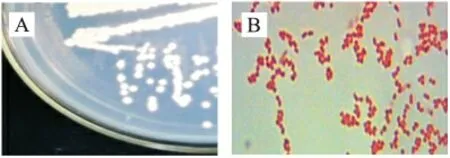
图3 (A)菌株SA4 菌落形态及(B)革兰氏染色
将提取的基因组进行琼脂糖凝胶电泳,结果如图4-A,提取的SA4 基因组片段大小约23 kb;以该基因组为模板,采用细菌16S rDNA 通用引物进行PCR 扩增,获得产物大小约为1.5 kb( 图4-B),将PCR 产物进行测序,所得序列已提交至Genebank(登录号为KR138702); 并将测得的序列通过BLASTN 软件进行比对,比对结果显示菌株SA4 属于假单胞菌属(Pseudomonas sp.),与假单胞菌属基因序列NC_021491.1 等的同源性高达99%,但在系统发育树中SA4 与恶臭假单胞菌( Pseudomonas putida)、黄褐假单胞菌( Pseudomonas fulva) 和蒙氏假单胞菌( Pseudomonas monteilii) 等菌都不能聚在一起(图5),表明菌株SA4 可能是假单胞菌属中的其它种。
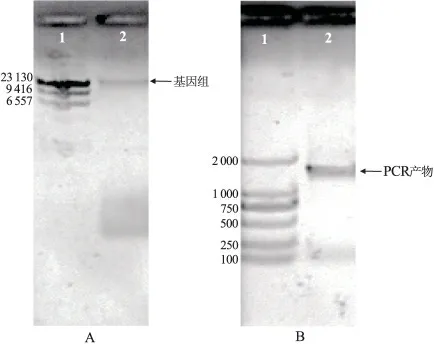
图4 菌株SA4 基因组DNA 及PCR 产物凝胶电泳

图5 基于16S rDNA 序列构建的系统发育树
3 讨论
许多PGPR 都可以产生生长素IAA,它可以促进植物根系的生长发育,进而促进植物有效地吸收土壤中的营养。本试验从芝麻根际分离筛选出7株产IAA 的菌株,其中菌株SA4 产生长素的能力最强,它对黄瓜种子和玉米种子具有明显的促生作用,黄瓜种子在经过菌株SA4 处理80 h 后,主根的长度约是对照组的3 倍,总根重约是对照组的2倍;玉米种子在经过菌株SA4 处理7 d 后,主根的长度约是对照组的3 倍,总根重也约是对照组的3倍。菌株SA4 革兰染色呈阴性杆状,经分子鉴定属于假单胞菌属。假单胞菌的促生作用也有类似的报道。刘晓东等研究发现从玉米根际筛选的假单胞菌KM2、KM19 菌株对玉米具有明显的促生作用[11],与本文结果相似。Glick 等研究发现: 产低水平IAA 的恶臭假单胞菌( Pseudomonas putida)GR12-2 可使油菜幼苗初生根伸长增加20% ~30%,而产高水平IAA 的PGPR 却可以导致油菜幼苗大量次生根的发育[18]。刘佳莉等研究发现具有1-氨基环丙烷-1-羧酸( ACC) 脱氢酶活性的假单胞菌A-4 可以有效增加燕麦的株高、鲜重、根长、根重,并可以提高燕麦的盐碱抗性[16]。
本研究发现,芝麻根际微生物中存在促生菌,丰富了重要微生物资源库。进一步将通过生理生化试验鉴定菌株SA4,并深入研究温度、pH 等不同因素对SA4 分泌生长素的影响,明确该菌株产生长素的最佳条件,为该菌株在农业上的应用奠定基础。
[1]胡江春,薛德林,马成新,等. 植物根际促生菌(PGPR)的研究与应用前景[J]. 应用生态学报,2004,15(10): 1963-1966.
[2]Glick B R. The enhancement of plant growth by freeliving bacteria [J]. Canadian Journal of Microbiology,1995,41(2): 109-117.
[3]Arshad M,Frankenberger Jr W T. Microbial production of plant hormones[J]. Plant and Soil,1991,133(1):1-8.
[4]Boddey R M,Dobereiner J. Nitrogen fixation associated with grasses and cereals: Recent progress and perspectives for the future[J]. Nutrient Cycling in Agroecosystems,1995,42(1-3): 241-250.
[5]Scher F M,Baker R. Effect of Pseudornonas putida and a synthetic iron chelator on induction of soil suppressiveness to Fusarium wilt pathogens [J]. Phytopathology,1982,72: 1567-1573.
[6]Shanahan P,O'Sullivan D J,Simpson P,et al. Isolation of 2,4-diacetylphloroglucinol from a fluorescent pseudomonad and investigation of physiological parameters influencing its production[J]. Applied and Environmental Microbiology,1992,58 (1): 353-358.
[7]Flaishman M A,Eyal Z,Zilberstein A,et al. Suppression of Septoria tritici blotch and leaf rust of wheat by recombinant cyanide-producing strains of Pseudomonas putida[J]. Molecular Plant-Microbe Interactions,1996,9(7): 642-645.
[8]de Freitas J R,Banerjee M R,Germida J J. Phosphatesolubilizing rhizobacteria enhance the growth and yield but not phosphorus uptake of canola ( Brassica napus L.) [J]. Biology and Fertility of Soils,1997,24(4):358-364.
[9]Mantelin S,Touraine B. Plant growth-promoting bacteria and nitrate availability: impacts on root development and nitrate uptake [J]. Journal of Experimental Botany,2004,55(394): 27-34.
[10]Adesemoye A O,Torbert H A,Kloepper J W. Enhanced plant nutrient use efficiency with PGPR and AMF in an integrated nutrient management system[J]. Journal of Microbiology (Canadian),2008,54(10): 876-886.
[11]刘晓东,王补全,李 伟. 玉米根际促生菌的筛选及其对玉米生长发育的影响[J]. 安徽农业科学,2010,38(10): 5043-5045.
[12]陈 波,丁延芹,马海林,等. 樱桃根际促生菌的筛选与鉴定[J]. 微生物学通报,2012,39(12): 1746-1754.
[13]马娅莉,刘海燕. 棉花根际促生菌的鉴定和促生效果[J]. 安徽农业科学,2012,40(32): 15689-15691.
[14]刘秀花,梁 峰. 小麦根际促生菌的筛选与促生作用研究[J]. 安徽农业科学,2006,34 (20): 5300-5301,5308.
[15]李文英,彭智平,于俊红,等. 香蕉根际促生菌的研究展望[J]. 热带作物学报,2011,32(1): 182-187.
[16]刘佳莉,方 芳,史煦涵,等. 2 株盐碱地燕麦根际促生菌的筛选及其促生作用研究[J]. 草业学报,2013,22(2): 132-139.
[17]康贻军,程 洁,梅丽娟,等. 植物根际促生菌的筛选及鉴定. 微生物学报,2010,50(7) : 853-861.
[18]Glick B R,Liu C,Ghosh S,et al. Early development of canola seedlings in the presence of the plant growth promoting rhizobacterium Pseudomonas putida GR 12-2[J]. Soil Biology and Biochemistry,1997,29( 8):1233-1239.
