对皖北地区白酒曲粉中酵母菌的分离筛选
2015-03-26孙晓璐张新红王明跃
孙晓璐,张新红,王明跃,张 源
(阜阳职业技术学院 生化工程学院,安徽 阜阳 236031)
皖北地区,实属中原腹地,物产富足,适合于白酒的生产与酿造,以沿淮河酿酒带涌现出以“淡雅型”风格为主体的酿造白酒,深受广大消费者的喜爱,独树一帜。目前,以古井贡、口子窖、金种子,迎驾、高炉家等多家生产白酒的优秀企业为代表,成为皖酒系列的一张名片。
在酿造白酒过程中所需的大曲是白酒生产的骨架,而大曲的生产是靠传统工艺自然接种,网罗自然界中的各种微生物在上面生长而制成的,是大曲酒生产中的糖化发酵剂,因此大曲中的微生物类群及为丰富,是多种微生物的混合体系,主要包括霉菌、细菌和酵母菌,在这样一个庞大而复杂的微生物环境下,通过糖化、发酵、生香的综合作用让我们的白酒具有甘洌爽口,回味悠长,充分体现了大曲酒的酒体特征[1]。
而大曲中的酵母菌则是近年来酿酒工作者研究的热点,据相关文献报道,主要有酒精酵母、假丝酵母、产酯酵母等多种酵母菌,在发酵、代谢过程中对白酒的风格形成起到重要作用[2]。因此分离、鉴定大曲中的酵母菌,可以为研究酵母菌在发酵过程中生物特性的研究奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1 菌种来源
皖北地区某酒厂提供的中温的大曲。
1.1.2 试剂
孟加拉红、青霉素钠、TTC、95%乙醇、苯酚红、美蓝、氯化钠、葡萄糖、酵母膏、牛肉膏、Tris。
1.1.3 实验器材
立式压力蒸汽灭菌器、SPX-328 型生化培养箱、DHG-9070 电热恒温鼓风干燥箱、电子分析天平、ZHJH-C1112C 超净工作台、微波炉、荧光倒置显微镜、冷藏箱、微量移液器。
1.1.4 培养基
YPD 培养基。
1.2 实验方法
1.2.1 初筛实验
通过富集培养,涂布平板,从长势较好的培养基中挑取表面光滑、湿润、菌落颜色为乳白色的单菌落挑出一环,放入9 mL 的无菌水试管中进行梯度稀释,配制成10-1的菌悬液,以此类推,配制成10-2,10-3,10-4……菌悬液。混匀后,分别从上述试管中吸取1mL 涂布于YPD 培养基中,每个梯度设置三个平行样,28 ℃下培养24 h[3]。
1.2.2 复筛实验
从经过初筛后培养的菌落中挑出长势较好的菌种,采用分区划线法接入YPD 培养基,28 ℃下培养24 h,对菌种进行进一步分离纯化培养,筛选出生长较好的酵母菌进行镜检[4-5]。
1.2.3 镜检
通过染色剂的染色对筛选出的菌株进行光学显微镜的镜检,并通过荧光倒置显微镜进行拍摄。
2 结果与分析
2.1 对酵母菌的形态观察
2.1.1 酵母菌菌落的观察
通过对曲粉的初筛和复筛后得到两株的酵母菌F1 与F2,酵母菌落形态各有不同,从而在外观上判定有大致的方向,其菌落形态特征如下表1。
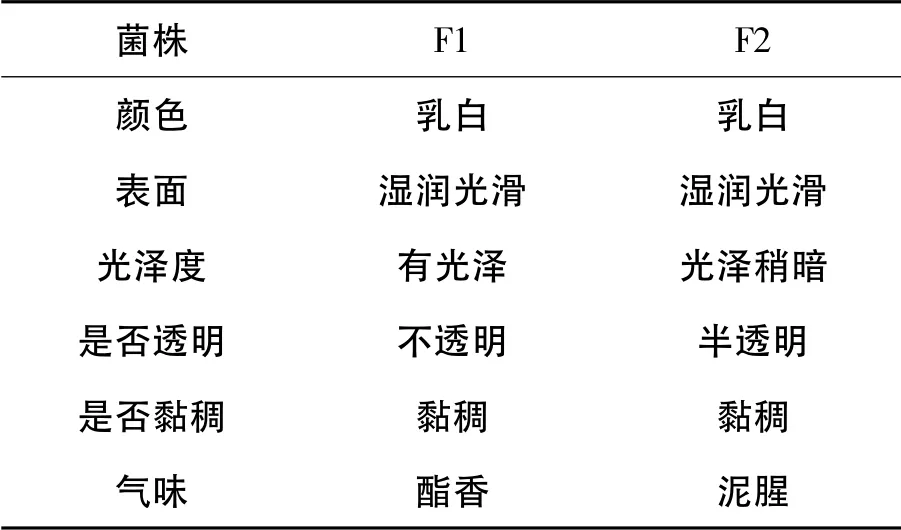
表1 酵母菌菌落形态观察
两株菌落在生长过程中具有明显的生态学特征,并且差异较大,F1 菌体具有光泽圆润的菌落,是典型的产酯酵母菌。产酯酵母对乙醇亲和力很强,以乙醇作碳源能发育很好,而且又有较强的氧化特性,在生产白酒时,可以利用产酯酵母提高酒的主体香含量,如乙酸乙酯、己酸乙酯、乳酸乙酯等,以及乙酸甲酯、辛酸乙酯等次要香味物质,是形成白酒的主体风味物质[6]。
2.1.2 酵母菌的个体观察
通过涂布平板,划线法对培养的菌株进行分离纯化,将筛选出来的经过感官评定和形态观察后的酵母菌F1 与F2 分别进行简单染色,使用荧光倒置显微镜进行镜检,镜检用油镜观察,镜检酵母菌形态描述见表2。

表2 酵母菌个体观察
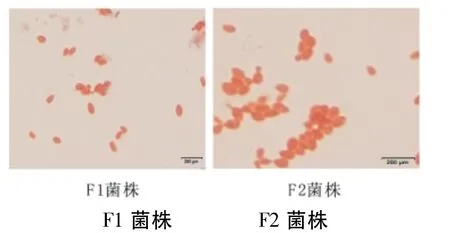
图1 酵母菌的形态
图1结果显示,菌落形态较大较厚,出现乳白色或红色菌体,表面湿润、粘稠,易被挑起。具有芽体,形成成串的细胞。从大曲粉中分离纯化得到的酵母菌呈卵圆形、圆形或柠檬形,通过荧光倒置显微镜的检验,酵母菌菌落个体较大,形状为椭球状,菌种生活壮实[7];而F2 菌株在生长过程中出现了易风干的特性,因此,在今后的实际应用中,需要注意对F2 菌株进行保湿贮藏。
2.2 对两株酵母菌的生化指标的测定
2.2.1 发酵液中pH 值的测定
现将F1 与F2 酵母菌接种至制备好的三角发酵瓶中,做平行样,分别为F1-1,F1-2,F1-3 和F2-1,F2-2,F2-3 放入28 ℃摇床进行培养,发酵进行1 d对其进行取样测定,结果如表3所示。
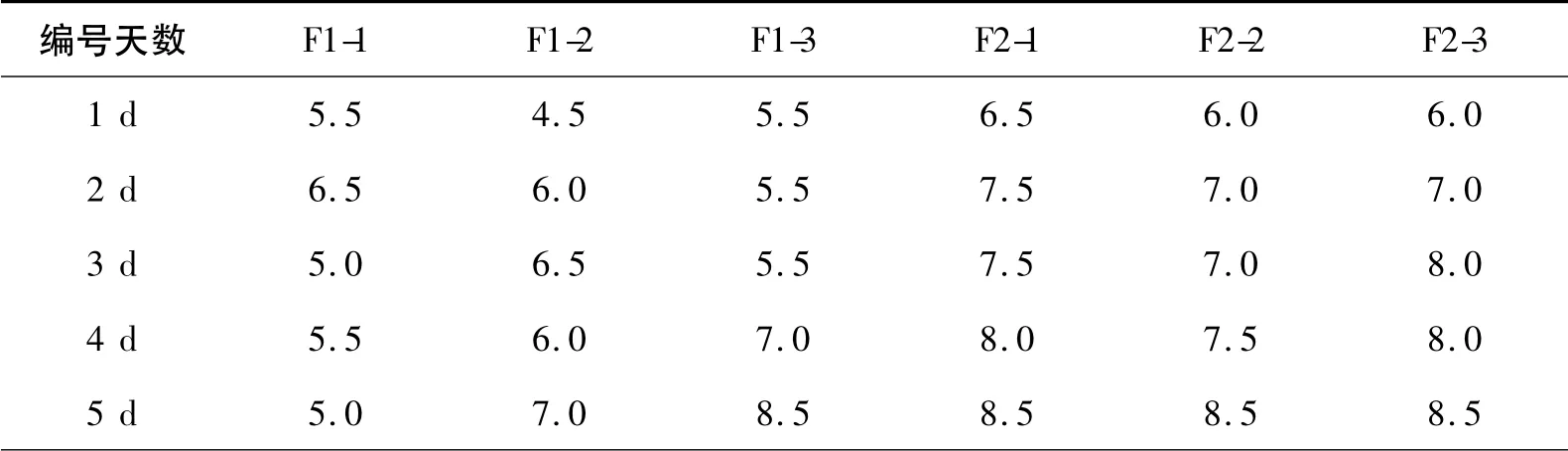
表3 pH 值的变化情况
从所示数据可以看出,适宜酵母菌生长的pH范围为4.0 ~6.0。酵母菌F1 在1 ~3 d 的pH 值处于一个相对稳定的状态,偏酸性,适宜酵母菌的生长;第4 d、第5 d 处于上升状态,中性偏碱性,不太适宜酵母菌的生长,这个过程中也可能是随着细胞代谢的作用下培养基中有机酸等物质被酵母菌利用,致使酸性物质减少[8],出现pH 值上升的现象;同时,F1 酵母发酵液在发酵的第3 d 时产生一定的酯香味。同样,在对F2 酵母菌的发酵液测定得到的结果是pH 值一直处于逐渐上升状态,其发酵液中酯香味较浓,可能是代谢过程中的酸性物质利用率较高,致使酸性物质和醇相结合转化出大量酯类物质。
2.2.2 发酵中残糖含量的测定
将放入摇床培养的发酵液每天进行一次取样,测定在发酵过程中酵母菌对糖分的利用的变化情况,以发酵液中残糖含量的变化为指标,详细残糖变化情况见表4。

表4 发酵过程中残糖含量的变化
由表4中可看出F1-1 号瓶中残糖的含量较高,残糖持续消耗,到第5 d 时还有少许残糖的存在;F1-2号与F1-3 号瓶中第1 ~2 d 有残糖存在,随着残糖逐渐消耗,到第3 ~5 d 时已无残糖存在;而F2-1 号与F2-2 号瓶中第1 ~2 d 有残糖存在,到第3 d 残糖消耗完。这个过程说明在在发酵过程中,在厌氧环境中经过糖酵解途径( EMP) 将葡糖降解成丙酮酸,然后脱羧生成乙醛,在乙醇脱氢酶催化下还原成大量乙醇[9]。因此,酵母菌的代谢情况比较旺盛,对发酵液中糖分的分解速度很快,在实际生产过程中需要及时填补料,从而保证发酵的有效进行。
3 结果与讨论
大曲酒是白酒中一种主导香型,浓郁的酒香和大曲中的各种微生物密切相关,了解大曲中酵母菌种类,对于深入探究白酒的酿造机理具有积极意义。本文采用酵母菌的形态学、生理学的方法从曲粉中获得两株酵母菌,菌落乳白色,湿润光滑有光泽,具有明显酯香味,是典型的酿酒酵母特征[10]。在通过重要生理生化指标的测定后得知,F1 酵母菌在培养1 ~3 d 时进入了对数生长期,繁殖能力较强,生长速度较快,此时,将大曲投入到白酒生产中,能迅速繁殖到发酵所需数量,充分利用原料,提高发酵程度; 当pH 值为4.5 ~6.5 时生长状态较好,残糖含量较多。
F2 酵母菌在培养1 ~2 d 时,酵母菌生长达到最佳状态,pH 值为6.5 ~7.0 时生长状态良好,对糖分消耗量开始增加,使得发酵液中残糖含量减少,说明在这个阶段,酵母菌开始转入发酵期,此时,对发酵池的各项培养条件要进行时时观测,确保发酵过程的顺利进行; 其发酵液中酯香味较浓重,推测是代谢过程中的酸性物质利用率较高,转化出大量酯类物质,但是根据相关文献报道[11],酵母菌在酿造过程中表现出很强的乙醇形成能力,还可以产生丁醇、戊醇、乙酸戊酯等挥发性化合物,对白酒的香型形成产生重要影响。因此,在白酒大曲中分离并研究相关产酯酵母在实际生产中具有一定的现实指导意义。
[1]张 磊,施 思,张文学,等.浓香型白酒大曲中酵母的分离和鉴定[J].酿酒科技,2010(5):39-40.
[2]蒲 春,胡沂淮,贾亚伟,等.产酯酵母的筛选及其发酵特性研究[J].酿酒科技,2013(3):47-49,53.
[3]李建武,余端元,袁明秀. 生物化学实验原理和方法[M].北京:北京大学出版社,1994:311-315.
[4]顾国贤. 酿造酒工艺学[M]. 北京: 中国轻工业出版社,1996:3-5.
[5]徐 军,罗惠波,崔德宝,等.大曲中酵母菌的分离及其鉴定[J].酿酒,2008,35(3):95-97.
[6]许超德,李绍兰.核酸分子系统学方法在酵母菌分类中的应用进展. 微生学通报[J]. 2004,31(3): 126-129.
[7]诸葛健,王正祥. 工业微生物实验技术手册[M]. 北京:中国轻工业出版社,1994.
[8]褚学英,惠丰立,李晓辉.大曲中主要酵母菌的分子鉴定[J].中国酿造,2008(3):27-29.
[9]Osho A.Ethanol and sugar tolerance of wine yeasts isolated from fermenting cashew apple juice[J]. Journal of Biotechnology,2005,4(7): 660-662.
[10]吴衍庸.酒曲微生物分析与白酒香型初探[J]. 酿酒科技,2004(5):38-39.
[11]钟桂芳. 发酵木糖产酒精高温酵母菌株构建的研究[D]. 中国农业大学硕士论文,2001.
