湖北省恩施地区二叠系低丰度草莓状黄铁矿的两种成因
2015-03-26曹丰龙韦恒叶
曹丰龙,韦恒叶
(1.东华理工大学核资源与环境重点实验室,江西南昌 330013;2.东华理工大学地球科学学院,江西南昌330013)
沉积物,特别是海洋沉积物中普遍含有黄铁矿,黄铁矿的形态和草莓状黄铁矿粒径分布可以指示沉积水体的氧化还原条件(Wilkin et al.,1996a; Wignall et al.,1998,2005;Bond et al.,2004; Nielsen et al.,2004;常华进等,2009;Bond et al.,2010;遇昊等,2011;Wei et al.,2012)。其原理主要是由于在缺氧水体中容易形成草莓状黄铁矿,且草莓状黄铁矿在缺氧环境中形成时间比较短,其直径就较小;而在氧化环境中不容易形成草莓状黄铁矿,且其形成时间较长,直径较大。基于这个原理,Wilkin等(1996a)最先利用草莓状黄铁矿粒径大小来反演沉积水体的氧化还原条件,Bond等(2010)将这项指标进一步发展,利用草莓状黄铁矿直径大小定量的研究沉积水体的氧化还原条件,其认为直径小于5 μm且分布较窄的反映硫化缺氧环境,直径为4~6 μm且分布较窄的为非硫化缺氧环境,直径为6~10 μm且分布较宽时反映贫氧环境。Wignall等(1998)认为氧化环境中草莓状黄铁矿的平均直径一般为7.5 μm,且最大直径一般大于13 μm。
然而,草莓状黄铁矿的另外一种参数——草莓状黄铁矿丰度是否也与水体的氧化还原参数有关?一般认为还原环境中生成的草莓状黄铁矿丰度较高(Wignall et al.,1998),较为丰富的草莓状黄铁矿通常解译为缺氧环境。那么反过来,草莓状黄铁矿的缺乏,或缺失是否就是一个非还原的氧化环境?在研究华南二叠系海相碳酸盐岩和硅质岩的草莓状黄铁矿研究过程中,一些还原环境的地层中也同样缺失草莓状黄铁矿。据此,本文将从黄铁矿形成条件、形成过程、形成环境以及后期的成岩变化方面,以氧化环境作为对比,总结还原环境中缺乏草莓状黄铁矿的原因。
1 地质背景
研究区位于湖北省西部恩施地区,该地区在中二叠统栖霞组沉积时期以及上二叠统大隆组沉积时期是一个盆地环境(冯增昭等,1997)。盆地中沉积了大量的有机质,形成黑色岩系沉积,是该区烃类有机质富集的重要时期,也是我国南方油气资源的富集层位之一。栖霞组的黑色岩系是一个贫氧、局部缺氧的环境(Wei et al.,2012);而大隆组的黑色岩系是一个非氧化、贫氧、甚至缺氧的环境(遇昊等,2012)。这些氧化还原方面的研究是本文分析氧化还原对草莓状黄铁矿丰度影响的基础。
2 分析方法
制作岩石薄片,对岩石薄片涂石墨碳后进行扫描电镜分析。薄片抛光并涂C,扫描电镜为JSM-5610LV型,电子束电压20 kV。草莓状黄铁矿丰度的估算是一个定性化的方法,本文的重点在于对比分析草莓状黄铁矿的大量出现层位以及缺失层位的氧化还原条件。结合前人的地球化学指标,重点分析其缺失的成因。
3 氧化环境和还原环境中缺乏草莓状黄铁矿的现象
3.1 氧化环境中缺乏草莓状黄铁矿
鄂西地区恩施剖面二叠系栖霞组下部的碳酸盐岩地层中存在贫氧环境的层段以及氧化环境的层段(Wei et al.,2012,图1)。贫氧环境的沉积物中普遍见到草莓状黄铁矿,其直径大小约为7 μm (Wei et al.,2012,图2a,b),而氧化环境的沉积物中几乎不存在草莓状黄铁矿,而是团块状的铁的硫化物(图2c,d),对其打能谱结果发现,铁与硫的摩尔比为Fe∶S=30.48∶69.52,其比约为1∶2,硫的含量稍高,应该为黄铁矿(FeS2)。团块状的黄铁矿其内部存在微孔,说明黄铁矿团块最初的结构是草莓状黄铁矿(Sawlowicz,1993),而不是自形晶黄铁矿。在氧化环境下,碳酸盐岩沉积物中大的黄铁矿一般分布在碳酸盐岩碎屑颗粒之间的泥质含量较高的细粒组分中。这种细粒组分往往吸附较多的有机质,而有机质的硫酸盐还原细菌分解之后形成硫化氢,硫化氢进而与发生反应,最终生成黄铁矿。也就是说早成岩时期有机质的细菌硫酸盐还原形成的硫化氢比较有限。有意思的是,在有无草莓状黄铁矿界线之下的样品Es39,其黄铁矿的形态有草莓状黄铁矿(图2b,Fram1)、过大生长草莓状黄铁矿(图2b,Fram2)以及实心体黄铁矿(图2b,Fram3)。其中,Fram2是由Fram1经成岩作用过大生长演变而来,而Fram3由Fram2经成岩作用的再次生长演变而来。过大生长草莓状黄铁矿内部与不存在草莓状黄铁矿的样品Es40的黄铁矿形态一样,均保留有微孔,说明这两种黄铁矿的成因很可能相同,都是草莓状黄铁矿经成岩作用形成。
3.2 还原环境中缺乏草莓状黄铁矿
湖北省恩施赵家坝剖面上二叠统大隆组下部发育硅质岩、泥质硅质岩和硅质泥质岩,而上部发育硅质灰岩、石灰岩夹泥岩。在大隆组上部的石灰岩层段中主要为缺氧—贫氧环境,富含草莓状黄铁矿;而在大隆组下部的硅质层段中当时沉积水体为还原的环境(遇昊等,2012),不含草莓状黄铁矿。利用扫描电子显微镜观察有无草莓状黄铁矿界线上下的Zj16样品和Zj15,Zj12,Zj5和Zj3样品(图3),界线之上Zj6样品为泥质硅质岩,草莓状黄铁分布较为丰富(图4a,b),而界线之下的样品Zj15同样为泥质硅质岩,却几乎完全没有发现黄铁矿颗粒(图4c),再往下的样品Zj12(图4d)和Zj5(图4e)虽然没有草莓状黄铁矿,但发现了1~2 μm单颗粒状黄铁矿,而到了Zj3硅质岩样品(图4f)与Zj15一样,同样没有发现黄铁矿。样品 Zj16与Zj15不同之处在于Zj16样品向上过渡为石灰岩沉积。而含单颗粒黄铁矿的Zj12,Zj5样品与不含黄铁矿的Zj15,Zj3样品不同之处在于前者的有机碳含量极高。
4 讨论
4.1 草莓状黄铁矿的形成条件与形成过程
形成黄铁矿(FeS2)的物质条件主要为活性铁和S,活性铁主要由陆地地表径流带来的硅酸盐矿物以及热液活动提供,而S则主要是由硫化氢提供,硫化氢是有机质的细菌硫酸盐还原的产物。黄铁矿(主要分为草莓状黄铁矿与自形晶黄铁矿)的形成过程分两种情况(图5):
(1)在原地活性铁的浓度较高的条件下,活性铁Fe2+与HS-发生反应生成四方硫铁矿(mackinawite,Fe9S8),四方硫铁矿通过结构中铁的散出转变为胶黄铁矿(greigite,Fe3S4),其过程并不涉及结构中硫的重组(Taylor et al.,1979)。胶黄铁矿为磁性矿物,在磁性吸引力的作用下,将那些胶黄铁矿颗粒聚合形成草莓状。胶黄铁矿通过结构中失去铁转变为黄铁矿(Wilkin et al.,1996b),转变过程中磁性逐渐减弱。也即,草莓状黄铁矿的形成前后经由无序的FeS、四方硫铁矿、胶黄铁矿以及黄铁矿的过程(Sweeney et al.,1973;Raiswell,1982; Morse et al.,1987;Wilkin et al.,1997a)。草莓状黄铁矿形成以后,受到后期成岩作用的影响,部分或全部草莓状黄铁矿发生过大生长,形成自形晶黄铁矿。需要补充的是,四方硫铁矿是由无序的FeS转变而来,而无序的FeS由活性铁与HS-发生反应生成(Rickard,1989)。
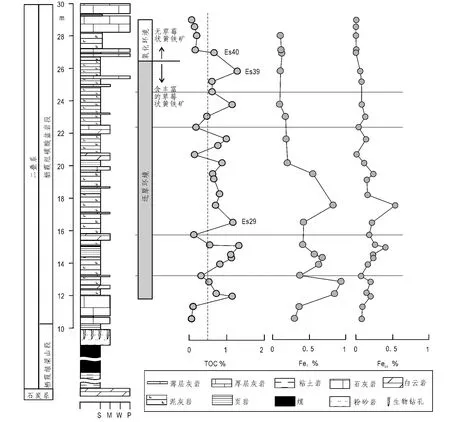
图1 湖北恩施剖面草莓状黄铁矿的分布与氧化还原条件以及有机碳TOC、总体(FeT)和黄铁矿铁(Fepy)变化特征Fig.1 The framboidal pyrite distribution and redox condition changes,and the characteristics of TOC,total iron(FeT) and pyritic iron(Fepy)profile at the Enshi section,Hubei province.
2)在原地活性铁的浓度较低的条件下,自形晶黄铁矿可以从溶液中快速直接的形成,而不需要从任何铁的硫化物母体中转变而来(Howarth,1978; Howarth et al.,1979;Luther et al.,1982;Rai-swell,1982;Giblin et al.,1984)。此种黄铁矿可以在两种条件下形成。一种是在较高的有机碳、快速的硫酸盐还原反应以及低的pH值条件下形成。在酸性条件下,溶液对于铁的一硫化物(iron monosulfide,FeS)来说是未饱和的,而对于黄铁矿来说却是饱和的(Howarth,1979;Berner et al.,1979),此时黄铁矿可以从溶液中直接结晶形成晶核,经晶体生长而成。而在高的pH值碱性条件下,溶液对于FeS和黄铁矿来说均为饱和状态,此时优先结晶FeS,形成四方硫铁矿(Goldhaber et al.,1974)。另外一种是在早期成岩作用的晚期(Raiswell,1982),孔隙水系统处于较为封闭环境,与上覆水体联通不畅,原地活性铁的浓度较低,伴随着硫酸盐还原反应速率的降低,铁与HS-直接形成黄铁矿。

图2 湖北恩施剖面Fig.2 Section of Enshi area in Hubei province
4.2 草莓状黄铁矿的形成环境与后期变化
有机质在热动力学上是不稳定的,在任何环境下,其有向最低自由能演化的趋势。从形成有机质的水体至最终埋藏的过程中,有机质先后经历O2的氧化分解阶段、硝酸盐还原分解阶段、硫酸盐还原分解阶段以及甲烷菌分解阶段(Demasion et al.,1980),相对应的氧化物其氧化能力依次降低。其中,有机质的细菌硫酸盐还原反应生成H2S,与活性铁发生反应生成黄铁矿。也即,黄铁矿的形成一般发生在硫酸盐还原带。黄铁矿的形成途径可以是由活性铁与硫化氢的直接结晶形成,也可以由FeS经四方硫铁矿及胶黄铁矿转变而来(Raiswell,1982)。而由FeS形成的四方硫铁矿及随后的胶黄铁矿,一般形成于紧靠氧化/还原界面之下的位置(Kaplan et al.,1963)或者形成于氧化还原界面之上的微还原环境(Jrgensen,1977a,1977b)。还原微环境是指在氧化环境中,局部富含有机质的封闭环境,有机质分解后能形成硫酸盐还原环境,可以形成草莓状黄铁矿。FeS经四方硫铁矿转变为胶黄铁矿及其随后转变为黄铁矿过程均需要有氧化物的存在(Berner,1967;Sweeney,1973;Taylor et al.,1979;Wilkin,1996b),同时又需要硫化氢的供应,而氧化还原界面环境和还原微环境符合这两个条件,且氧化还原界面细菌硫酸盐还原速率达到最大(Wilkin,1997a)。因此,草莓状黄铁矿一般形成于氧化还原界面稍靠下的位置或者还原的微环境。其中,大部分的草莓状黄铁矿形成于前者,微环境中形成的草莓状黄铁矿只是少数。除了通过中间产物四方硫铁矿和胶黄铁矿转变形成的草莓状黄铁矿以外,直接结晶形成的自形晶黄铁矿没有特定的位置,在硫酸盐还原反应带内均可以形成这种自形晶黄铁矿。在氧化环境中,这种直接结晶形成的黄铁矿只形成于沉积物中;在硫化缺氧环境中,则既可以形成于水体也可以形成于沉积物中,且在沉积物中形成的这种黄铁矿一般以草莓状黄铁矿过大生长边以及充填草莓状黄铁矿内部孔隙的形式出现(Wilkin et al.,1997b)。然而,对于FeS和黄铁矿均为饱和状态的溶液中,FeS优先结晶形成。因此,在可以形成草莓状黄铁矿的环境中,不经过中间产物直接结晶形成的自形晶黄铁矿数量较少,这方面的研究程度相对较低。

图3 湖北恩施赵家坝剖面草莓状黄铁矿的分布与氧化还原条件、总有机碳TOC及总铁含量FeT的关系Fig.3 The framboidal pyrite distribution and redox conditions,and the TOC,V/(V+Ni) and FeTprofile at the Zhaojiaba section,Hubei province
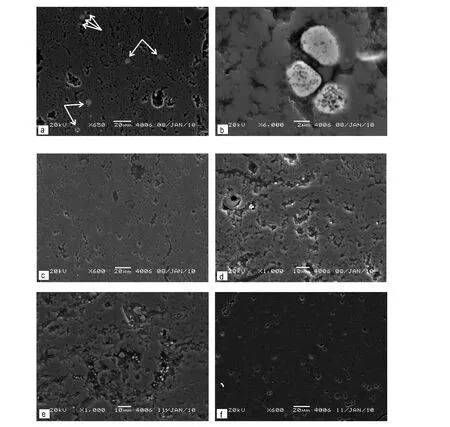
图4 湖北恩施赵家坝剖面大隆组泥质硅质岩还原环境中Fig.4 In the reducing environments of muddy cherts at the Zhaojiaba section,Hubei province
在氧化环境下,沉积物—水界面之上的水体中富含O2,硫酸盐还原带位于氧化还原界面之下十几或几十厘米处,大部分的草莓状黄铁矿形成于氧化还原界面稍靠下的位置,少量的草莓状黄铁矿形成于氧化还原界面之上的还原微环境。而在硫化缺氧环境中,沉积物—水界面上覆水体中富含游离的H2S,氧化还原界面位于沉积物—水界面之上的水体中,草莓状黄铁矿形成于水体中氧化还原界面稍靠下的位置。
4.3 恩施剖面栖霞组氧化地层草莓状黄铁矿缺乏的原因
湖北恩施剖面栖霞组地层中,存在氧化环境和贫氧环境(图1),贫氧环境中形成草莓状黄铁矿的氧化还原界面分布在沉积时期沉积物—水界面之下的沉积物中,只不过其氧化还原界面所处的深度要比氧化环境中氧化还原界面的深度较浅,距离沉积物—水界面距离较近,孔隙水与上覆水体的联通较好,从上覆水体中带来较为充足的活性Fe的来源,有利于草莓状黄铁矿的形成。而氧化环境中,氧化还原界面距离沉积物—水界面较远,孔隙流体与上覆水体的连通性较差。在有机质含量较低的情况下,细菌硫酸盐还原产生硫化氢,在氧化还原界面稍靠下的地层中利用原地活性Fe形成草莓状黄铁矿,随着原地活性Fe的消耗以及埋深的逐渐增加,孔隙流体相对FeS逐渐变得不饱和,而相对黄铁矿则变得过饱和,此时,黄铁矿直接沉淀(Raiswell,1982),导致草莓状黄铁矿外围二次生长或者充填其内部孔隙(例如图2b),形成草莓状黄铁矿的次生加大,破坏草莓状黄铁矿的形态(例如图2c,d)。在有无草莓状黄铁矿界线上下的样品Es40和Es39(图1)之间,它们的有机碳含量均较高,细菌硫酸盐还原分解后可以形成较多的硫化氢,总铁、活性铁及高活性铁含量几乎相同(Wei et al.,2012),Es39样品中存在较多的草莓状黄铁矿。界线上下不同之处在于有机碳含量的变化,界线之下的地层中富含有机质,有机质分解后消耗大量的氧,导致其沉积水体的氧化还原状态为贫氧环境(Wei et al.,2012),界线之上的地层中有机碳含量较低,有机质分解消耗的氧较少,导致其沉积水体的氧化还原状态为氧化环境。草莓状黄铁矿的缺乏可能是由于有机碳含量的降低,导致细菌硫酸盐还原反应强度的降低,产生的硫化氢数量减少,从而硫化氢与铁反应生成的草莓状黄铁矿含量降低。同时,在后期的成岩过程中,一些草莓状黄铁矿的过大生长破坏了草莓状黄铁矿原来的形状,造成草莓状形态的黄铁矿含量降低。
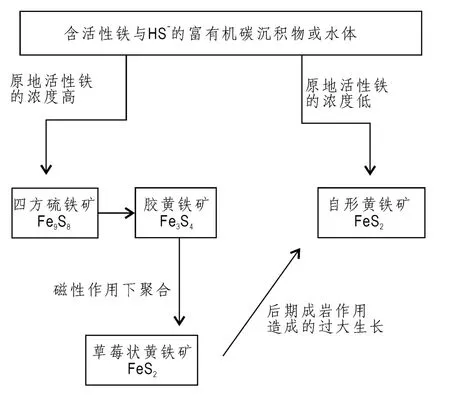
图5 黄铁矿形成的过程(修改自Raiswell,1982)Fig.5 The process of pyrite formation
4.4 恩施赵家坝大隆组还原地层草莓状黄铁矿缺乏的原因
湖北恩施赵家坝剖面大隆组地层中为贫氧、甚至缺氧的环境(遇昊等,2012)。在贫氧地层中,既有草莓状黄铁矿丰富的层段,又有不含草莓状黄铁矿的层段。不含草莓状黄铁矿层段中含有自形晶黄铁矿小颗粒。与此对应的是,在不含草莓状黄铁矿中,铁的含量很低(<0.5%,遇昊等,2012),而含草莓状黄铁矿的层位铁的含量一般大于1.1%。说明铁的浓度对草莓状黄铁矿的影响有着密切的关系,铁的浓度只有达到一定量之后才会生成草莓状黄铁矿(Raiswell,1982)。黄铁矿单晶的出现说明黄铁矿微晶可以在铁含量较低的情况下形成。从另一个层面上说就是铁浓度较低情况下,有机质的细菌硫酸盐还原反应生成的硫化氢与铁直接生成自形的黄铁矿,而不是先形成胶黄铁矿。后者是形成草莓状黄铁矿的必须条件。
5 结论
在氧化环境中,草莓状黄铁矿的缺乏原因是有机碳含量较低。低有机碳含量造成细菌硫酸盐还原强度降低,形成的硫化氢浓度减少,生成的草莓状黄铁矿丰度降低。同时部分草莓状黄铁矿由于后期成岩作用的影响,局部破坏草莓状黄铁矿的形态,也会造成草莓状黄铁矿丰度的降低。
在还原环境,草莓状黄铁矿的缺乏原始是铁浓度的降低。在铁浓度较低的情况下,有机质的细菌硫酸盐还原反应生成的硫化氢直接与铁生成自形的黄铁矿微晶,由于其磁性较弱,很难聚合形成草莓状,从而导致草莓状黄铁矿丰度的降低。
影响草莓状黄铁矿丰度除了上述两种原因之外,有机质的性质与类型、铁的活性以及氧化还原界线的深浅也会有一定的影响。同时也需要进行更为深入的研究。在这方面累积了一定的原始数据,将会有更为深入的讨论。
冯增昭,杨玉卿,金振奎,1997.华南二叠系岩相古地理[M].北京:石油大学出版社.
常华进,储雪蕾,冯连君,等.2009.华南老堡组硅质岩中草莓状黄铁矿——埃迪卡拉纪末期深海缺氧的证据[J].岩石学报,25 (4):1001-1007.
遇昊,陈代钊,韦恒叶,等.2011.二叠纪末期海洋缺氧:来自黄铁矿形态的证据[J].地质科学,46(1):83-91.
遇昊,陈代钊,韦恒叶,等.2012.鄂西地区上二叠乐平统大隆组硅质岩成因及有机质富集机理[J].岩石学报,28(3):1017-1027.
Berner R A.1967.Thermodynamic stability of sedimentary iron sulfides[J].American Journal of Science,265(9):773-785.
Berner R A,Baldwin T,Holdren Jr G R.1979.Authigenic iron sulfides as paleosalinity indicators[J].Journal of Sedimentary Petrology 49(4):1345-1350.
Bond D,Wignall P B,Racki G.2004.Extent and duration of marine anoxia during the Frasnian-Famennian(Late Devonian)mass extinction in Poland,Germany,Austria,and France[J].Geological Magazine 141(2):173-193.
Bond D,Wignall P B.2010.Pyrite framboid study of marine Permian–Triassic boundary sections:A complex anoxic event and its relationship to contemporaneous mass extinction[J].GSA Bulletin,122 (7-8):1265-1279.
Demaison G J,Moore A G T.1980.Anoxic Environments and Oil Source Bed Genesis[J].The American Association of Petroleum Geologists Bulletin 64(8):1179-1209.
Giblin A E,Howarth R W.1984.Porewater evidence for a dynamic sedimentary iron cycle in salt marshes[J].Limnology and Oceanography 29(1):47-63.
Goldhaber M B,Kaplan I R.1974.The sulfur cycle[M]//In:Goldberg,E.D.(ed.),The Sea,vol.5.New York:Wiley:569-655.
Howarth R W.1978.A rapid and precise method for determining sulfate in seawater,estuarine waters and sediment pore waters[J].Limnology and Oceanography,23(5):1066-1069.
Howarth R W.1979.Pyrite:Its rapid formation in a salt marsh and its importance in ecosystem metabolism[J].Science,203(4375):49-51.
Howarth R W.Teal J M.1979.Sufate reduction in a New England salt marsh[J].Limnology and Oceanography,24(6):999-1013.
Jrgensen B B.1977a.Bacterial sulfate reduction within reduced microniches of oxidized marine sediments[J].Marien Biology,41(1): 7-17.
Jrgensen B B.1977b.The sulfur cycle of a coastal marine sediment (Limf jorden,Denmark)[J].Limnol.Oceanogr,22(5):814-832.
Kaplan I R,Emery K O,Rittenberg S C.1963.The distribution and isotopic abundance of sulfur in recent marine sediments off southern California[J].Geochimica et Cosmochimica Acta,27(4):297-331.
Luther III G W,Giblin A,Howarth R W,et al.1982.Pyrite and oxidized iron mineral phases formed from pyrite oxidation in salt marsh and estuarine sediments[J].Geochimica et Cosmochimica Acta,46 (12):2665-2669.
Morse J W,Millero F J,Cornwell J C et al.1987.The chemistry of the hydrogen sulfide and iron sulfides systems in natural waters[J].Earth-Science Reviews,24(1):1-42.
Nielsen J K,Shen Y.2004.Evidence for sulfidic deep water during the Late Permian in the East Greenland Basin[J].Geology 32(12): 1037-1040.
Raiswell R.1982.Pyrite texture,isotopic composition and the availability of iron[J].American Journal of Science,282(8):1244-1263.
Rickard D T.1989.Experimental concentration-time curves for the iron (II)sulphide precipitation process in aqueous solutions and their interpretation[J].Chemical Geology,78(3-4):315-324.
Sawlowicz Z.1993.Pyrite framboids and their development:a new conceptual mechanism[J].Geologische Rundschau,82(1):148-156.
Sweeney R E,Kaplan I R.1973.Pyrite framboid formation:laboratory synthesis and marine sediments[J].Economic Geology,68(5): 618-634.
Taylor R.Rummery T E,Owen D G.1979.On the conversion of mackinawite to greigite[J].Journal of Inorganic and Nuclear Chemistry,41(4):1683-1687.
Wei H Y,Chen D Z,Wang J G,et al.2012.Organic accumulation in the lower Chihsia Formation(Middle Permian)of South China:Constraints from pyrite morphology and multiple geochemical proxies[J].Palaeogeography,Palaeoclimatology,Palaeoecology,353-355:73-86.
Wignall P B,Newton R.1998.Pyrite framboid diameter as a measure of oxygen deficiency in ancient mudrocks[J].American Journal of Science,298(7):537-552.
Wignall P B,Newton R,Brookfield M E.2005.Pyrite framboid evidence for oxygen-poor deposition during the Permian–Triassic crisis in Kashmir[J].Palaeogeography,Palaeoclimatology,Palaeoecology,216(3):183-188.
Wilkin R T,Barnes H L,Brantley S L.1996a.The size distribution of framboidal pyrite in modern sediments:An indicator of redox conditions[J].Geochimica et Cosmochimica Acta,60(20):3897-3912.
Wilkin R T,Barnes H L.1996b.Pyrite formation by reactions of iron monosulfides with dissolved inorganic and organic sulfur species[J].Geochimica et Cosmochimica Acta 60(21):4167-4179.
Wilkin R T,Barnes H L.1997a.Formation processes of framboidal pyrite[J].Geochimica et Cosmochimica Acta,61(2):323-339.
Wilkin R T,Barnes H L.1997b.Pyrite formation in an anoxic estuarine basin[J].American Journal of Science,297(6):620-650.
