急性心肌梗死后抑郁大鼠前炎症细胞因子肿瘤坏死因子α和白细胞介素1β的变化规律
2015-03-26关梓桐张文洁李悦李卫红杜庆红徐雅
关梓桐 张文洁 李悦 李卫红 杜庆红 徐雅
传统中医认为“心主神明”即心主宰人的精神、意识和情志。并认为心主血脉,即血是心主神志的物质基础,而周身之血脉为心所主,此观点为心主神明提供了理论基础。因此本研究团队猜想,心脏疾病后患者精神神志是否会出现异常表现。目前临床发现心肌梗死患者中30%~60%伴有中度抑郁,15%~20%伴有抑郁症。又有证据表明心肌梗死预后不良在抑郁症状中占有很大比重[1]。抑郁症可加速缺血性心脏病的进展和增加心血管病的发病率和死亡率,是心血管疾病的一种危险因素[2-5]。目前心梗后抑郁发生病理机制的最新研究认为,心梗后抑郁的发生与炎症反应相关,但其机制尚不明确。另有研究显示,应用抗炎药如己酮可可碱(pentoxifylline,PTX)可减少心肌梗死后脑边缘系统的细胞凋亡[6],从而进一步印证炎症反应与心梗后抑郁的关系。为揭示心肌梗死后心脑神志的生物学关系及评估大鼠心肌梗死后前炎症因子肿瘤坏死因子-α(tumor necrosis factor,TNF-α)和白细胞介素(interleukin,IL)-1β的变化规律,本实验以大鼠心肌梗死模型为切入点,观察心肌梗死后大鼠行为变化特征与炎症因子循环水平变化规律的关系。
1 材料与方法
1.1 实验动物
100只8周龄SPF级雄性Wistar大鼠,体质量200~220 g,均购自北京维通利华实验动物技术有限公司,合格证号:SYXK(京)2012-0001。于北京中医药大学动物中心严格按照北京中医药大学动物伦理委员会有关实验动物伦理审查和管理规定进行。按照随机的原则将100只动物分成4组,其中模型组(AMI group)40只,术后成活19只,死亡21只,成活率为47.50%,其中死亡大鼠死亡原因为术中或术后心律失常。给药组(PTX group)35只,术后成活15只。假手术组(Sham group)15只。正常组(normal group,N group)10只。
1.2 主要实验设备和仪器
心电图解析系统SP-2006_LAN(北京软隆生物技术有限公司);自发行为动物检测系统(JLBehv-LAR-1,上海吉量软件科技有限公司);强迫游泳分析系统(EthoVision XT,Noldus公司,荷兰)。
1.3 实验试剂
己酮可可碱(Enzo Life Sciences公司,批号:L 02465)。
1.4 心肌梗死动物模型建立
心肌梗死动物模型的建立,对比后参考Trueblood的方法[7]并在其基础上予以改进,将Wistar大鼠用10%的水合氯醛(0.4 mL/100g)麻醉后,仰位固定于手术台上,采用生物信号定量分析系统SP-2006_LAN(北京软隆生物技术有限公司)记录大鼠术前及术后标准体表心电图。正中剃毛,碘酒常规消毒,手术刀正中切开,用止血钳钝性分离肋间肌肉,自左侧4~5肋间开胸,暴露心脏,在肺动脉圆锥及左心耳之间,距左冠状动脉起点2~3 mm处,用3~0无创缝合线结扎左冠状动脉前降支,立刻将心脏送回胸腔,挤出胸腔内气体,待心率及呼吸平稳后用5~0缝合线缝合,假手术组在心脏左冠状动脉左前降支处穿线不接扎,余过程与模型建立相同。正常组不予以任何手术处理。术后模型组及假手术组大鼠肌注青霉素钠注射液80 000 U/天,共3天,以防止感染。动物清醒后按常规饲养。模型成功标准为心电图显示Ⅱ导联出现ST段弓背抬高0.2 mV以上(见图1、图2)。假手术组术后ST段的抬高不明显(见图3、图4)。术后1~7天给药组连续7天每日上午10点进行腹腔注射PTX(0.2 mL/100g),模型组给等体积的生理盐水。
1.5 行为学观察
1.5.1 蔗糖水消耗实验[8]蔗糖水消耗实验于大鼠手术前,手术后2周进行。本实验是以大鼠蔗糖水摄取量降低作为指标,用于评估大鼠快感缺乏[9-10]。实验前48小时,训练大鼠适应饮用蔗糖水。同时给予每只大鼠两瓶水:一瓶为1%蔗糖水,一瓶为纯净水。大鼠禁食禁水24小时,而后在安静避光的环境下进行蔗糖水消耗实验。然后每笼分别给予已定量的蔗糖水(1%蔗糖水)和纯净水两瓶液体,60分钟后取走液体并分别称重。蔗糖水消耗百分比=蔗糖水消耗量/总液体消耗量×100%

图1 模型组术前心电图

图2 模型组术后10分钟心电图
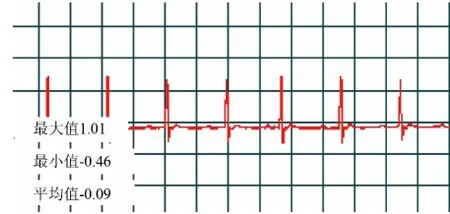
图3 假手术组术前心电图
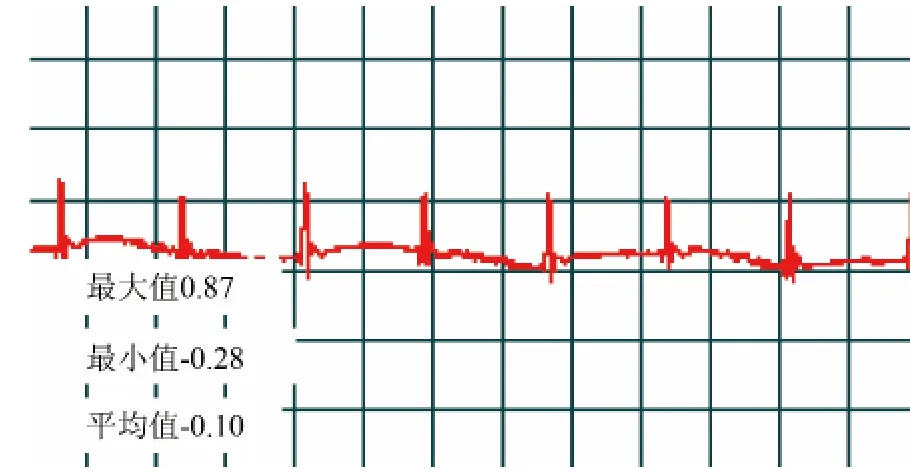
图4 假手术组术后10分钟心电图
1.5.2 自发行为实验 自发行为实验所用装置为不透明的材料所制成,箱体为正方体,通过箱体所带摄像头来观察大鼠在箱体的运动状态。根据参考文献[11],本实验于大鼠手术后第2周进行。实验时将大鼠轻慢置于中心方格内,关闭箱门,观察大鼠在5分钟内的活动总路程,活动总时间和站立次数。
1.5.3 强迫游泳实验 本实验为行为绝望实验法,其基本原理为当大鼠放置在一个有限的空间使之游泳,观察大鼠在水中的行为,大鼠不动时间越长,表示抑郁程度越高。本实验于手术后30天进行,参考文献[12-13]将每只大鼠于下午13:00在安静状态下分别置于水温24~25℃,水深30 cm,21 cm×21 cm×50 cm的有机玻璃缸中,进行预游泳,每只大鼠游泳时间为15分钟。24小时后进行正式游泳实验。同时间,同条件下让每只大鼠强迫游泳5分钟,并同时使用强迫游泳分析系统(EthoVision XT,Noldus公司,荷兰)记录大鼠游泳时间、挣扎时间及不动时间并对指标进行分析。
1.6 组织学检测
TNF-α,IL-1β在大鼠血浆内和脑组织内浓度。术后33天取材。用10%的水合氯醛(0.4 mL/100g)麻醉大鼠,腹主动脉取血4 mL,注入肝素钠离心管并离心,取上清液,-80℃保存;断颈法处死大鼠,取脑组织,将脑组织于-80℃保存。大鼠腹主动脉取血于用肝素钠采血管内,离心机3000 rpm离心10分钟,取上清液,大鼠脑组织匀浆。用Rat TNF-αElISA KIT试剂盒检测(Multi Science)和Rat IL-1βElISA KIT试剂盒检测(Multi Science)。
1.7 统计学处理
所有数据应用SPSS 20.0统计软件包进行分析。数据以均数±标准差±s)表示。数据均服从正态分布,并采用单因素方差分析(one-way ANOVA),两两比较时采用LSD法,P<0.05为差异具有统计学意义。
2 实验结果
2.1 各组大鼠蔗糖水消耗实验比较
各组大鼠蔗糖水消耗百分比经正态检验,均符合正态分布,方差齐性检验P>0.05,组间两两比较采用LSD法。假手术与正常组相比,大鼠蔗糖水消耗百分比没有明显差异(P>0.05)。模型组与假手术组相比,模型组大鼠蔗糖水消耗百分比明显减少,差异有统计学意义(P<0.05)。PTX组与模型组相比,PTX组大鼠蔗糖水消耗百分比明显高于模型组大鼠,差异有统计学意义(P<0.05)。见表1。
表1 心梗术后各组大鼠蔗糖水消耗百分比±s)

表1 心梗术后各组大鼠蔗糖水消耗百分比±s)
注:与假手术组相比,a P <0.05;与模型组相比,b P <0.05
组别 n 蔗糖水消耗百分比(%)10 84.55 ±9.93假手术组 11 84.44 ±8.43模型组 9 63.15 ±9.22a PTX 组 8 74.89 ±5.17正常组b
2.2 各组大鼠自发行为实验比较
各组大鼠三项自发行为指标经正态检验,均符合正态分布,方差齐性检验P>0.05,组间两两比较采用LSD法。假手术与正常组相比,大鼠的活动总路程,总时间和站立次数差异无统计学意义(P>0.05)。模型组与假手术组相比,模型组大鼠的活动总路程,总时间和站立次数明显减少,差异有统计学意义(P<0.05)。PTX组和模型组相比,PTX组大鼠的活动总路程,总时间和站立次数明显高于模型组大鼠,差异有统计学意义(P<0.05)。见表2。
表2 心梗后各组大鼠自发行为实验指标±s)
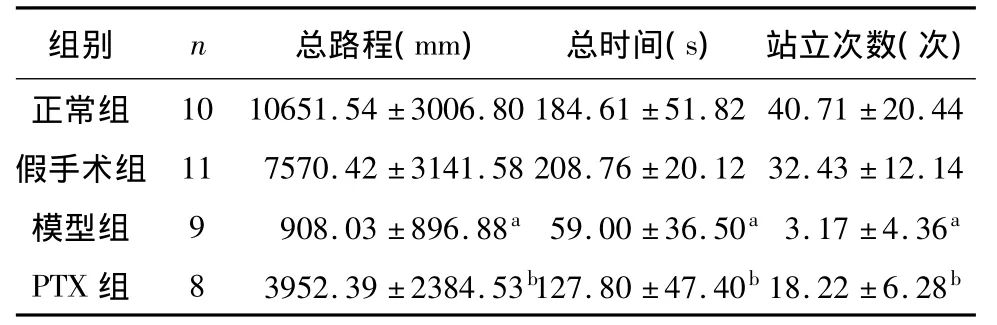
表2 心梗后各组大鼠自发行为实验指标±s)
注:与假手术组相比,a P <0.05;与模型组相比,b P <0.05
组别 n 总路程(mm) 总时间(s) 站立次数(次)44假手术组 11 7570.42 ±3141.58 208.76 ±20.12 32.43 ±12.14模型组 9 908.03 ±896.88a 59.00 ±36.50a 3.17 ±4.36a PTX 组 8 3952.39 ±2384.53b127.80 ±47.40b 18.22 ±6.28正常组 10 10651.54 ±3006.80 184.61 ±51.82 40.71 ±20.b
2.3 各组大鼠强迫游泳实验比较
各组大鼠强迫游泳三项指标经正态检验,均符合正态分布,方差齐性检验P>0.05,组间两两比较采用LSD法。假手术组与正常组相比,大鼠的游泳时间,不动时间和挣扎时间差异无统计学意义(P>0.05)。模型组与假手术组相比,模型组大鼠游泳时间和挣扎时间明显减少,但不动时间增加,差异有统计学意义(P<0.05)。PTX组与模型组相比,PTX组大鼠的游泳时间和挣扎时间明显高于模型组大鼠,但不动时间明显低于模型组大鼠,差异有统计学意义(P<0.05)。见表3。
表3 心梗后各组大鼠强迫游泳实验行为指标± s ,S)
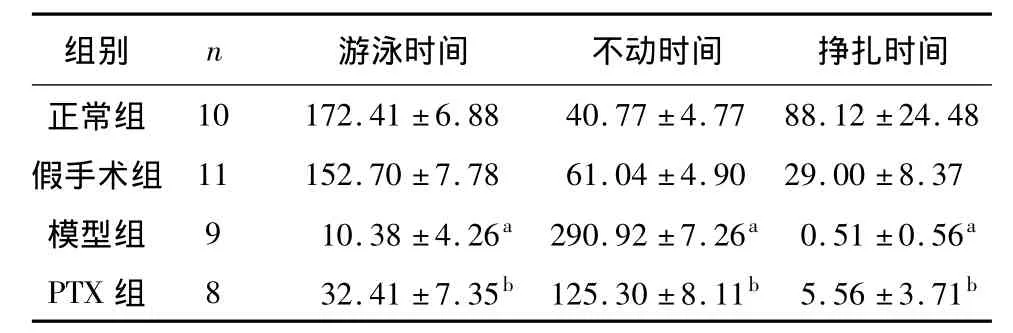
表3 心梗后各组大鼠强迫游泳实验行为指标± s ,S)
注:与假手术组相比,a P<0.05;与模型组相比,b P<0.05
10 172.41 ±6.88 40.77 ±4.77 88.12 ±24.48假手术组 11 152.70 ±7.78 61.04 ±4.90 29.00 ±8.37模型组 9 10.38 ±4.26a 290.92 ±7.26a 0.51 ±0.56a PTX 组 8 32.41 ±7.35b 125.30 ±8.11b 5.56 ±3.71游泳时间 不动时间 挣扎时间正常组组别 n b
2.4 各组大鼠血浆内IL-1β 和TNF-α 浓度
各组大鼠血浆内IL-1β和TNF-α浓度经正态检验,均符合正态分布,方差齐性检验P>0.05组间两两比较采用LSD法。假手术组与正常组相比,大鼠血浆内IL-1β和TNF-α浓度无统计学意义(P>0.05)。模型组与假手术组相比,模型组大鼠血浆内IL-1β和TNF-α浓度均增加,差异有统计学意义(P<0.05)。PTX组和模型组相比,PTX组大鼠血浆内IL-1β和TNF-α浓度均低于模型组大鼠,差异有统计学意义(P<0.05)。见表4。
表4 心梗后各组大鼠血浆内IL-1β和TNF-α浓度指标±s)

表4 心梗后各组大鼠血浆内IL-1β和TNF-α浓度指标±s)
注:与假手术组相比,a P <0.05;与模型组相比,b P <0.05
组别 n IL-1β TNF-α 10 106.26 ±13.18 499.00 ±71.42假手术组 11 117.19 ±17.91 478.31 ±191.71模型组 9 147.91 ±24.35a 708.37 ±81.31a PTX 组 8 130.41 ±13.24b 615.87 ±55.66正常组b
2.5 各组大鼠脑内IL-1β 和TNF-α 浓度
各组大鼠脑内IL-1β和TNF-α浓度经正态检验,均符合正态分布,方差齐性检验P>0.05,组间两两比较采用LSD法。假手术组与正常组相比,大鼠脑内 IL-1β和 TNF-α浓度无统计学差异(P>0.05)。模型组和假手术组相比,模型组大鼠脑内IL-1β和TNF-α浓度均增加,差异有统计学意义(P<0.05)。PTX组和模型组相比,PTX组大鼠脑内IL-1β和TNF-α浓度均低于模型组大鼠,差异有统计学意义(P<0.05)。见表5。
表5 心梗后各组大鼠脑内IL-1β和TNF-α浓度指标(±s)
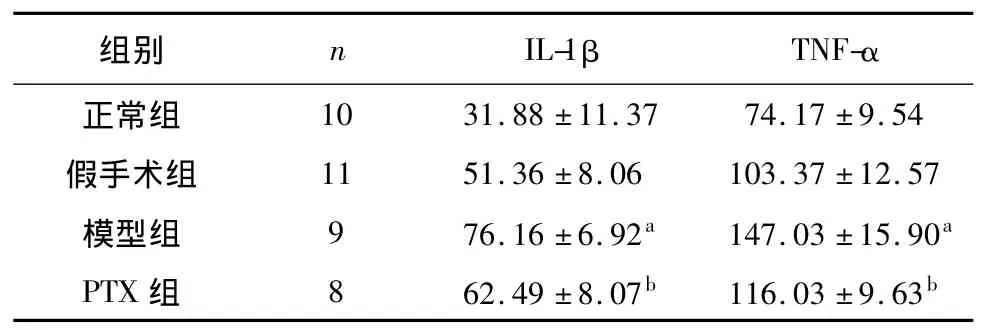
表5 心梗后各组大鼠脑内IL-1β和TNF-α浓度指标(±s)
注:与假手术组相比,a P <0.05;与模型组相比,b P <0.05
组别 n IL-1β TNF-α 10 31.88 ±11.37 74.17 ±9.54假手术组 11 51.36 ±8.06 103.37 ±12.57模型组 9 76.16 ±6.92a 147.03 ±15.90a PTX 组 8 62.49 ±8.07b 116.03 ±9.63正常组b
3 讨论
传统中医认为识神是指人的精神意识思维活动,是以人的意志为转移的,大脑的后天活动,本源于大脑却隶属于心,这是由于心主血脉为大脑的识神活动提供了物质基础。目前临床统计表明心血管疾病并发情绪障碍的概率为8% ~44%[14]。抗抑郁药对心肌梗死的治疗疗效甚微,因此探求心肌梗死后抑郁相关病理机制尤为重要。目前在急性心梗模型的基础研究中,慢性轻度不可预见性应激抑郁模型是目前较为理想的抑郁动物模型之一[15-16]。根据参考文献,抑郁症动物模型至少应符合3个标准[17]:(1)表观信度:例如动物的行为特点看上去是否象人类的抑郁症;(2)内在信度:引起行为改变的原因和因果关系是否和抑郁症一样;(3)预测信度:对人类有效的抗抑郁药是否能可靠地改变动物的这种行为。本实验结果表明大鼠冠状动脉前降支结扎2周后,模型组大鼠与正常组和假手术组大鼠相比,蔗糖水偏好显著减少,表明大鼠快感缺乏;自发行为实验中大鼠的活动总路程、总时间、直立次数均明显减少,表明大鼠的活动度和对外界新鲜环境的好奇度明显下降;游泳时间和挣扎时间明显减少,不动时间增加,表明大鼠具有绝望行为。以上大鼠产生快感缺乏,活动能力下降,产生绝望行为与抑郁症的核心症状(心情低落、兴趣缺乏等)有一定程度的相似性,类似抑郁症患者的症状,因此可以判定大鼠在急性心肌梗死后产生了抑郁行为。
目前心肌梗死后抑郁的发生机制尚未明确,有研究表明,心肌梗死与炎症反应密切相关。心肌局部及全身的炎症反应,影响心肌梗死的病理及预后,并最终导致心肌重塑和疤痕形成。心肌梗死后,由免疫导致的炎症反应,包括补体激活、细胞因子释放、炎症和免疫细胞趋化和浸润,可加重心肌损伤和扩大心肌梗死的范围。前炎症细胞因子的释放与心梗后抑郁的发病病理有关[18-19]。与心肌组织细胞因子浓度升高相平行的是,心梗后脑组织当中细胞因子的浓度也急剧增加[20]。因此本研究可以提出假设在急性心梗使得前炎症细胞因子(如IL-1β、TNF-α)被激活并释放入血,随血液循环透过血脑屏障进入脑组织,刺激脑内神经元,小胶质细胞和血管内皮细胞进一步释放前炎症细胞因子如TNF-α和IL-1β等,引起脑内炎症从而诱发抑郁的产生。根据上述实验结果,模型组大鼠与假手术组大鼠和正常组大鼠相比,其血浆内和脑内IL-1β浓度和TNF-α浓度均明显升高,从而可印证本研究提出的假设。
PTX是甲基黄嘌呤衍生物,是一种非特异性磷酸二酯酶抑制剂,具有抗炎抗纤维化特性,可通过cAMP依赖机制降低促炎细胞因子循环水平,如TNF-α、IL-1β 等[21]。有研究证明 PTX 可能通过改变促炎细胞因子水平从而衰减抑郁行为。据报道促炎细胞因子可诱发抑郁样行为和细胞凋亡。例如:IL-1β 可提高 HPA活性[22],并且诱发抑郁行为[23-25],而 IL1-β 在抑郁症患者循环浓度升高,且IL-1β拮抗剂可抑制IL-1β活性,由此可以认为PTX可减少炎性细胞因子。本实验研究数据表明,PTX可通过抑制炎症因子循环水平而缓解心梗后抑郁的症状,从而印证炎症反应可能是心梗后抑郁发生的可能机制这一猜想。
本研究采用冠状动脉前降支结扎方法建立大鼠急性心肌梗死模型,并通过行为学实验和组织学检测研究表明大鼠在心肌梗死后出现快感缺乏,活动度低下,绝望行为等抑郁行为,且模型组大鼠血浆内和脑内炎症因子IL-1β和TNF-α浓度明显升高。并采用PTX予以治疗。结果表明PTX组大鼠与模型组大鼠相比,不但血浆内和脑内炎症因子IL-1β和TNF-α循环水平浓度降低,且包括蔗糖水偏好显著升高;活动总路程、总时间、直立次数和直立时间均明显升高,游泳时间和挣扎时间明显升高,不动时间显著减少在内的抑郁行为显著减轻,提示炎症反应可能是心梗后抑郁发生的可能机制。
本实验研究急性心肌梗死后产生的炎症因子通过血液循环进入脑组织从而引起脑内炎症而产生抑郁,但目前研关于炎症因子如何改变血脑屏障通透性的机制仍尚未明确,希望通过建立更详细的实验来研究心梗后抑郁的炎症机制。
[1] Bah TM,Kaloustian S,Rousseau G,et al.Pretreatment with pentoxifylline has antidepressant-like effects in a rat model of acute myocardial infarction[J].Behavioural Pharmacology,2011,(22):779.
[2] Bjerkeset O,Romild U,Smith GD,et al.The associations of high levels of C-reactive protein with depression and myocardial infarction in 9258 women and men from the HUNT population study[J].Psychol Med,2011,41(2):345-352.
[3] Burg MM,Barefoot J,Berkman L,et al.Low perceived social support and post-myocardial infarction prognosis in the enhancing recovery incoronary heart disease clinical trial:the effects of treatment[J].Psychosom Med,2005,67(6):879-888.
[4] Egede,LE,Nietert,PJ,Zheng D.Depression and all-cause and coronary heart disease mortality among adults with and without diabetes[J].Diabetes Care,2005,28:1339-1345.
[5] Gilbert AM,Prasad K,Goradia D,et al.Grey matter volume reductions in the emotion network of patients with depression and coronary arterydisease[J].Psychiatry Res,2010,181(1):9-14.
[6] Wann BP,Boucher M,Kaloustian S,et al.Apoptosis detected in the amygdala following myocardial infarction in the rat[J].Biol Psychiatry,2006,59(5):430-433.
[7] Trueblood N A,Xie Z,Communal C.et al.Exaggerated left ventricular dilation and reduced collagen deposition after myocardial infarction in mice lacking osteopontin[J].Circ Res,2001,88(10):1080-1087.
[8] Benelli,FilaferroM,Bertolimi A ,et al.lnfluence of S-adenosyl-1-methionine on chronic mild stress-induced anhedonia in castrated rats[J].Br .JPharmacol,1999,127:645.
[9] Willner P,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic unpredictable mild stress,and its restoration by tricyclic antidepressant[J].Psychopharmacology,1987,93(3):358-364.
[10] Redei EE,Ahmadiyeh N,Baum AE,et al.Novel animal models of affective disorders[J].Semin Clinical Neuropsychiatry,2001,6(1):43-67.
[11] RogóZ,Kabziński M,Sadaj W,et al.Effect of co-treatment with fluoxetine or mirtazapine and risperidone on the active behaviorsand plasma corticosterone concentration in rats subjected to the forced swim test[J].Pharmacological Reports,2012,64(6):1391-1399.
[12] Imai S,Kano M,Nonoyama K,et al.Behavioral Characteristics of Ubiquitin-Specific Peptidase 46-Deficient Mice[J].PLoS ONE,2013,8(3):e58566.
[13] Nagaraja TS,Mahmood R,Krishna V,et al.Evaluation of Anxiolytic effect of ErythrinamysorensisGamb inmice[J].Indian J Pharmacol,2012 ,44(4):489-492.
[14] FLEETRP,BEITMAN B D.Cardiovascular death from panic disorder:a critical review of the literature[J].J Psychosom Res,1999,44(1):71-80.
[15] Tang Y,Liu Y,Qin L,et al.Concentration increase in Hcy and anti-CCP antibody in the serum of depression rat model induced by chronic unpredictable mildstress[J].J Cent South Univ,2012,37(8):790-795.
[16] Gouirand AM,Matuszewich.The effects of chronic unpredictable stress on male rats in the watermaze[J].PhysiolBehav,2005,86(1-2):21-31.
[17] Willner P.Validity,reliability and utility of the chronic mild stress model of depression:a 10-year review and evaluation[J].Psychopharmacology,1997,134(4):319-329.
[18] Lucassen P,Muller M,Holsboer F,et al.Hippocampal apoptosisin major depression is a minor event and absent from subareas at risk for glucocorticoidoverexposure[J].Am J Pathol,2001,158:453-68.
[19] Francis J,Zhang Z,Weiss M,et al.Neural regulation of the proin-flammatory cytokine response to acute myocardial infarction[J].Am JPhysiol Heart CircPhysiol,2004,287(2):791-797.
[20] Francis J,Chu Y,Johnson AK,et al.Acute myocardial infarction induces hypothalamic cytokinesynthesis[J].Am J Physiol,2004,286(6):2264-2271.
[21] Raetsch C,Jia JD,Boigk G,et al.Pentoxifylline down regulates profibrogenic cytokines and procollagen Iexpression in rat secondary biliary fibrosis[J].Gut,2002,50(2):241-247.
[22] Anisman H,MeraliZ.Anhedonic and anxiogenic effects of cytokine exposure[J].Adv Exp Med Biol,1999,461:199-233.
[23] Lacosta S,Merali Z,Anisman H.Influence of interleukin-1beta on exploratory behaviors,plasma ACTH,corticosterone,and central biogenic amines in mice[J].Psychopharmacology,1998,137(4):351-361.
[24] Bonaccorso S,Maier SF,Meltzer HY,et al.Behavioral changes in rats after acute,chronic and repeated administration of interleukin-1 beta:relevance for affective disorders[J].JAffect Disord,2003,77(2):143-148.
[25] Koo JW,Duman RS.IL-1beta is an essential mediator of the antineurogenic and anhedonic effects ofstress[J].Proc Natl AcadS-ci USA,2008,105(2):751-756.
