额尔敦—乌日勒对动脉粥样硬化家兔血管内皮因子内皮素、血小板活化因子的影响
2015-03-26郝蔷薇麻春杰乌兰其其格曾寒泊万宇田海广
郝蔷薇 麻春杰 乌兰其其格 曾寒泊 万宇 田海广
正常的血管内皮细胞可调节血管紧张度,维持血管结构,并可分泌抗凝、抗血小板物质和纤溶蛋白,防止炎症细胞向血管壁黏附聚集[1]。血管内皮细胞分泌的多种因子,是检测动脉粥样硬化(atherosclerosis,AS)斑块易损的重要指标。血小板活化因子(platelet activating factor,PAF)和内皮素(endothelin,ET)是反映血管内皮功能的主要标志物。前期研究表明,额尔敦—乌日勒能够有效干预动脉粥样硬化的形成和发展[2-3],促进eNOS基因的表达,增加其活性,升高内皮细胞生成的一氧化氮水平[4-5],但额尔敦—乌日勒稳定AS家兔易损斑块的作用机制与其对血管内皮因子PAF、ET的影响具有怎样的联系,国内外尚未有报道,故笔者团队对此进行研究。
1 材料与方法
1.1 实验动物与药物
50只健康雄性新西兰家兔[由北京市海淀区兴隆实验动物养殖厂提供,许可证号:SCXK(京)2011-0006]。额尔敦—乌日勒(内蒙古蒙药股份有限公司,生产批号:120706;规格2 g/10粒);辛伐他汀(山东鲁抗医药集团赛特有限责任公司,生产批号:20120703,国药准字 H20083840,规格20 mg/片);青霉素钠注射液(华北制药股份有限公司,国药准字H13020655,生产批号:20120716,规格160万单位/瓶×50瓶/盒);肝素钠注射液(天津生化药业有限责任公司生产,国药准字H12020505,生产批号:20121007,规格 1.25 万单位/2 mL,2 mL/支,2 mL ×10 支/盒)。
1.2 试剂与仪器
PAF、ET的Elisa试剂盒由上海西塘生物科技有限公司提供(生产批号分别为F20412、F20030);PAF、ET-1一抗、二抗均由北京博奥森生物技术有限公司提供(一抗生产批号:bs-1119R,bs-0954R,二抗生产批号:SP-0023)。Thermo酶标仪(美国,型号:Multiskan Ascent),DK-8D数显恒温水浴锅(中国金坛,型号:DK-8D),电热恒温培养箱(中国苏州,型号:DNP9272),高压灭菌锅(中国上海,型号:YXQLS-75SII),生物显微镜和成像系统(中国南京,型号:BM2000型),石蜡包埋机(德国,型号:EG1150H+C),高速立式离心机(日本,型号:CF16RXii)
1.3 造模及分组
普通饲料喂养1周适应环境后,随机分为正常组10只,造模组40只。造模组高脂饲料喂养4周,实验第2周给造模组的家兔耳缘静脉注射牛血清白蛋白生理盐水溶液,4周后对造模的家兔进行球囊拉伤手术[6]。于实验第8周通过检测家兔血脂水平和主动脉病理形态学确定AS易损斑块形成,证实造模成功,并将造模组最终存活的家兔(n=29)完全随机分组,分为模型组(n=10)、额尔敦—乌日勒组(n=10)和辛伐他汀组(n=9)。
1.4 给药方法及标本制备
正常组和模型组均灌服等容积的蒸馏水;额尔敦—乌日勒组按家兔体质量给予额尔敦—乌日勒0.4 g/(kg·d);辛伐他汀组按家兔体质量给予辛伐他汀5 mg/(kg·d),各药分别用蒸馏水制成混悬液喂饲。1次/天,至24周实验结束。第24周末心脏采血,3000 rmp离心10分钟分离血清;同时,随机空气栓塞处死每组家兔,迅速取出主动脉,生理盐水清洗后,中性缓冲福尔马林溶液固定。
1.5 实验指标检测
1.5.1 家兔血清 ET、PAF含量检测 PAF、ET测定均采用酶联免疫吸附(双抗体夹心)法,根据试剂盒提供的试剂与实验步骤要求进行操作,用Multiskan Ascent酶标仪完成测定。
1.5.2 家兔主动脉ET、PAF的表达 按照试剂说明书上步骤采用ABC法检测,两抗体均用抗体稀释液稀释200倍后使用,光镜下观测家兔主动脉血管内皮因子PAF、ET-1的表达。采用图像分析系统对免疫组化染色切片半定量分析,每组随机选取两张切片,每张标本400倍镜下选取5个不重复的视野,测量其阳性染色部位的平均光密度值(average optical density,AOD),作为每张标本的的阳性定量指标。
1.6 统计学处理
采用SPSS 18.0统计软件进行分析,计量资料以均数±标准差±s)表示,若符合正态性分布和方差齐性,则采用单因素方差分析,两组间的比较采用LSD检验;若不符合正态分布或方差齐性,则采用秩和检验,以P<0.05或P<0.01为差异有统计学意义。
2 结果
2.1 各组家兔血清ET、PAF浓度
家兔血清ET符合正态分布,但方差不齐,进行秩和检验分析显示,模型组家兔血清ET水平较正常组明显升高(P<0.01),差异具有统计学意义;与模型组比较,额尔敦—乌日勒能明显降低动脉粥样硬化家兔ET水平(P<0.01),差异具有统计学意义。实验家兔血清PAF数据不符合正态分布,进行秩和检验分析显示,与正常组相比,模型组PAF浓度显著升高(P<0.01),差异具有统计学意义(P<0.01);与模型组相比,额尔敦—乌日勒能显著降低血清PAF的浓度(P<0.01),差异具有统计学意义。见表1。
表1 各组家兔血清ET、PAF浓度的比较±s)
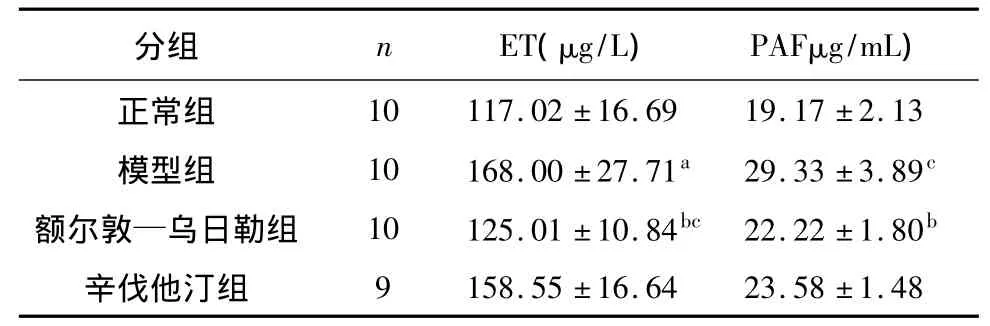
表1 各组家兔血清ET、PAF浓度的比较±s)
注:与正常组相比,a P<0.01;与模型组相比,b P<0.01;与辛伐他汀组比较,c P <0.01
分组 n ET(μg/L) PAFμg/mL)正常组9 158.55 ±16.64 23.58 ±1.48 10 117.02 ±16.69 19.17 ±2.13模型组 10 168.00 ±27.71a 29.33 ±3.89c额尔敦—乌日勒组 10 125.01 ±10.84bc 22.22 ±1.80b辛伐他汀组
2.2 各组家兔主动脉ET、PAF的表达
光镜下可见主动脉血管ET、PAF胞浆内的棕黄色颗粒信号增强为阳性表现。光镜下可见,ET在正常组血管内皮细胞中表达不明显,模型组、额尔敦—乌日勒组及辛伐他汀组表达增强,呈棕黄色,与正常对照相比,模型组棕黄色颗粒表达强烈。免疫组化染色半定量分析染色切片中ET的AOD值符合正态性,方差齐,采用单因素方差及LSD比较。结果显示,模型组家兔主动脉ET的AOD值比正常组明显升高(P<0.01),差异具有统计学意义;与模型组相比,额尔敦—乌日勒组ET的AOD值显著降低(P<0.01),差异具有统计学意义;与辛伐他汀组相比,额尔敦—乌日勒组ET的AOD值显著降低(P<0.05),额尔敦—乌日勒组在降低主动脉血管内皮ET的表达上具有一定的优势。见表2、图1。
光镜下观测PAF染色切片结果显示,与正常对照相比,模型组有强烈的棕黄色颗粒表达,阳性部位在内皮细胞的胞浆、胞膜及胞质里均可见。额尔敦—乌日勒组及辛伐他汀组两组PAF阳性表达主要位于胞浆,胞膜仅有少量表达。染色切片中PAF的AOD值符合正态分布,方差齐,采用单因素方差分析及LSD比较。与正常组相比,模型组家兔主动脉血管PAF的AOD值与正常组相较明显升高,(P<0.01),差异具有统计学意义,与模型组相比,额尔敦—乌日勒组主动脉PAF的AOD值显著降低(P<0.01),差异具有显著性。见表2、图2。
表2 各组家兔主动脉ET、PAF免疫组化染色AOD值的比较(±s)
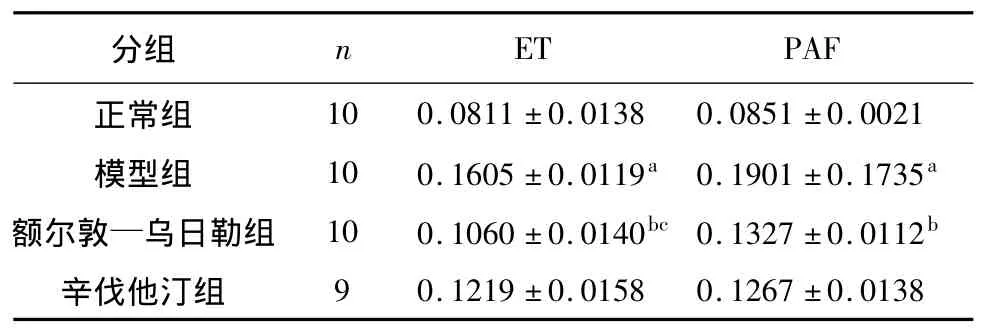
表2 各组家兔主动脉ET、PAF免疫组化染色AOD值的比较(±s)
注:与正常组相比,a P<0.01;与模型组相比,b P<0.01;与辛伐他汀组相比,c P <0.05。
10 0.0811 ±0.0138 0.0851 ±0.0021模型组 10 0.1605 ±0.0119a 0.1901 ±0.1735a额尔敦—乌日勒组 10 0.1060 ±0.0140bc 0.1327 ±0.0112b辛伐他汀组ET PAF正常组分组 n 9 0.1219 ±0.0158 0.1267 ±0.0138
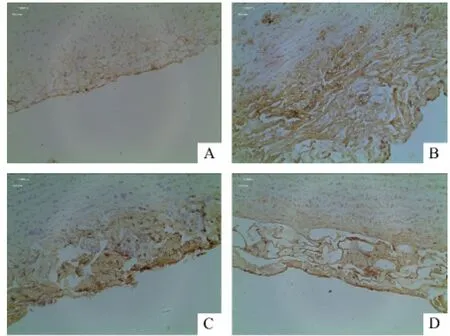
图1 各组家兔主动脉ET免疫组化检测结果(×400)
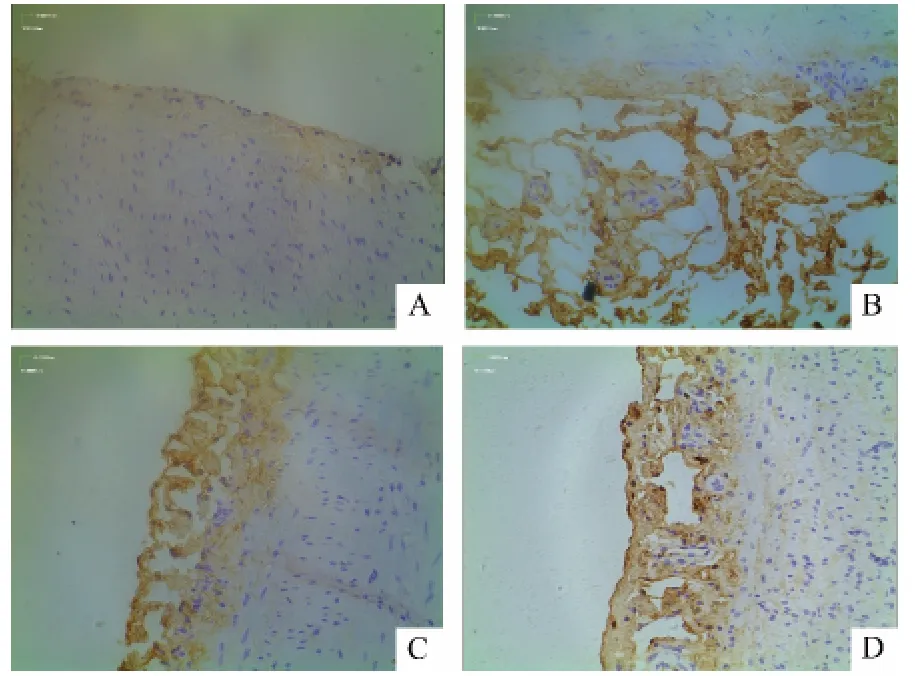
图2 各组家兔主动脉PAF免疫组化检测结果(×400)
3 讨论
动脉粥样硬化的发生、发展与血管内皮功能密切相关,内皮细胞具有抗凝、止血、选择性屏障、细胞通透性等作用,内皮细胞功能障碍可使血液中的脂质等成分堆积于内皮下间隙,从而形成泡沫细胞[7]。血管内皮功能减退是动脉粥样硬化早期病变最敏感的指标,是AS的重要始动因素之一。内皮细胞损伤是诱发AS的重要环节,保护内皮细胞可有效防止AS的发生发展。ET是内皮细胞分泌的主要缩血管因子,维持血管张力,调节血管内皮功能,而 PAF是动脉粥样硬化形成的关键起始因子[8]。
随着民族医药的发展,蒙医蒙药在临床上取得了良好疗效,并具有安全、高效、低毒等优势。AS易损斑块的检测手段多具有损伤性,目前常采用复合因素造模建造雄性家兔AS易损斑块模型,实验8周末通过检测血脂,显示家兔已形成AS易损斑块,为进一步观察蒙药额尔敦—乌日勒对AS易损斑块血清及主动脉ET、PAF的干预作用奠定了基础。实验结果表明额尔敦—乌日勒能降低AS家兔血清及主动脉ET、PAF水平(P<0.01),并且与辛伐他汀组相比,在影响AS易损斑块家兔主动脉ET水平上具有一定的优势(P<0.05),为临床寻找他汀类药物的替代治疗提供了科学的实验依据,亦为临床运用中蒙药治疗AS提供更加完善的实验理论和依据。
总之,额尔敦—乌日勒可能通过降低血管内皮因子ET、PAF的上升水平,降低主动脉组织ET的表达,恢复内皮功能的平衡状态,从而发挥稳定动脉粥样硬化易损斑块的作用。
[1] 李丹,李玉洁,杨庆,等.血管内皮功能障碍与动脉粥样硬化研究进展[J].中国实验方剂学杂志,2012,18(8):272-276.
[2] 麻春杰,董平,都格尔,等.额尔敦—乌日勒在家兔动脉粥样硬化斑块消退中的作用及其对炎症因子的影响[J].世界科学技术—中医药现代化,2011,13(5):894-898.
[3] 董平,麻春杰,温都苏,等.额尔敦—乌日勒对实验性家兔动脉粥样硬化的影响[J].中华中医药学刊,2011,29(5):1012-1015.
[4] 乌兰其其格,麻春杰,董平,等.额尔敦—乌日勒对AS家兔血清NO含量及主动脉eNOS基因表达的影响[J].中华中医药学刊,2015,33(3):603-605.
[5] 董平.珍宝丸抗动脉粥样硬化作用及其机制研究[D].呼和浩特:内蒙古医学院,2011.
[6] 都格尔.额尔敦—乌日勒及其优化方对动脉粥样硬化易损斑块家兔模型的干预作用[D].北京:北京中医药大学,2014.
[7] 邱雅慧.血管内皮细胞的功能以及损伤修复与动脉粥样硬化[J].中国组织工程研究与临床康复,2007,11(10):1927-1929.
[8] Tokumu ra A,Sum ida T,Tou jim a M,et al.Platelet-activating factor(PAF)-like oxidized phospholipids:relevance to atherosclerosis[J].Biofactors,2000,13(1-4):29-33.
