迷迭香活性提取物的药理作用研究进展
2015-03-26周慧灵梁婉娴徐道立陈雨王莹赵丕文
周慧灵 梁婉娴 徐道立 陈雨 王莹 赵丕文
迷迭香Rosmarinus officinalis L.是一种唇形科灌木,原产于地中海沿岸,喜欢生长在干燥温暖的沙质土壤中。迷迭香最早记载于《本草拾遗》,主要具有健胃、发汗、安神、止痛的功效;在欧洲,迷迭香一直被用于日常烹饪、香料提取,现在它也被用作提取抗氧化剂,具有很广泛的用途。近年来的研究表明,迷迭香提取物及其抗氧化组分具有很强的抗癌活性。下面对迷迭香活性提取物及其组分的药理作用进行阐述。
1 抗氧化作用
迷迭香抗氧化组分主要有鼠尾草酚(carnosol),鼠尾草酸(carnosic acid),迷迭香酚(rosmanol),迷迭香酸(rosmarinic acid)等[1-2],它们的结构如图1。
上述几种抗氧化组分按照抗氧化活性从高到低顺序大致排列为鼠尾草酸、迷迭香酸、鼠尾草酚、迷迭香酚[3-4]。迷迭香酸的抗氧化机制有下列两种:(1)通过竞争性结合脂质过氧基,终止脂质过氧化的连锁反应;(2)抑制诱导型一氧化氮合酶(inducibleinitric oxide synthase,iNOS)的蛋白合成及一氧化氮生成。
利用D-半乳糖制造衰老小鼠模型,加入不同剂量迷迭香提取物给予治疗,结果发现给药组能显著提高小鼠血清和心脏组织中的超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase from microorganisms,CAT)的活力,与此同时,给药组丙二醛(malonic dialdehyde,MDA)含量明显降低,以上结果说明迷迭香提取物可以通过提高抗氧化酶活性,提高D-半乳糖致衰老小鼠的抗氧化能力[5]。
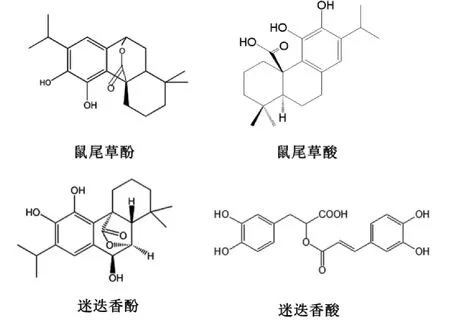
图1 迷迭香活性成分
迷迭香酸对经X射线照射后的永生化的人真皮微血管内皮细胞(human micrangium endothelial cells,HMEC-1)损伤具有明显保护作用。实验表明,用迷迭香酸预处理HMEC-1细胞1小时,可以减轻X射线诱导的增殖抑制和凋亡程度,同时,与不经迷迭香酸预处理相比,细胞内总抗氧化力、还原型谷胱甘肽/氧化型谷胱甘肽比值水平下降程度减轻,也就是说迷迭香酸对X射线照射所致HMEC-1细胞氧化胁迫状态有改善作用[6]。
在应用大鼠进行的研究中,迷迭香酸(rosmarinic acid)能降低自由基损伤后引起的肝线粒体的肿胀度,抑制肝线粒体膜流动性的降低;另外,迷迭香酸对丙二醛(malondialdehyde,MDA)生成的抑制作用和琥珀酸脱氢酶(succinatedehydrogenase,SDH)活性的促进作用均呈剂量-效应关系。这些结果都说明迷迭香酸能降低羟自由基对肝线粒体所致的氧化损伤,从而保护线粒体本身结构的完整性[7]。
2 抗癌作用
2.1 对肝癌细胞的抑制
迷迭香酸能够诱导肝癌细胞HepG2的凋亡[8],其抗癌作用具有多靶点、特异性选择等特点,它的抗癌机理如下:(1)迷迭香酸可以通过对基因的调控实现抗癌作用,如对致癌基因表皮生长因子受体(epidermal growth factor receptor,EGFR)、血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)、抑癌基因 p53、人第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome 10,PTEN)、腺瘤样结肠息肉易感基因(adenomatous polyposis coli,APC)等进行调控;(2)通过对细胞外信号调节激酶/丝裂原活化蛋白激酶(extracellular regulated protein kinases/mitogen-activated protein kinase,ERK/MAPK)等调控,实现其抗癌作用;(3)迷迭香酸可通过影响I相代谢酶细胞色素P450(cytochrome P450,CYP450)、谷胱甘肽巯基转移酶(glutathione S-transferase,GST)、醌还原酶(quinone reductase,QR)、尿苷二磷酸葡萄糖醛酸转移酶等酶的活性来阻止致癌物在体内的代谢活化;(4)迷迭香酸还具有抗氧化、抗炎、抗血管形成等作用,在抑制肝癌的形成上起着非常重要的作用。
5-氟尿嘧啶(5-fluorouracil,5-FU)在临床上能够有效地治疗肝癌,但是它会对机体造成严重的毒副作用并缺乏靶向性。实验表明[9-10],多种药物联用能降低5-FU的毒性,迷迭香酸与5-FU同时使用,能够增强5-FU对HepG2的作用,还可以减轻5-FU对人正常肝细胞的毒性[11]。
2.2 对乳腺癌细胞的抑制
有学者发现,迷迭香中的活性提取成分鼠尾草酚、鼠尾草酸、迷迭香酚都能不同程度地抑制乳腺癌细胞增殖[12-16]。其中,鼠尾草酚对癌细胞系的增殖抑制作用比它对正常细胞的增殖抑制作用强,也就是说,它的增殖抑制作用具有选择性。结合以上三者的结构,发现它们与雌二醇的结构相似。前期研究发现,乳腺癌的发病与性激素雌二醇、雌激素受体有密切的关系[13-15],所以上述成分极有可能在体内起了植物补体(phytoalexin)的作用,可以竞争性地与细胞膜上的雌激素受体结合,从而抑制乳腺癌细胞的增殖。迷迭香酸的结构与雌二醇的结构差别很大,所以它对性激素相关的乳腺癌细胞的增殖基本无抑制作用。
在鼠尾草酚对乳腺癌细胞T47D增殖活性的研究中,鼠尾草酚可使T47D细胞雌激素受体-α(estrogen receptor-α,ERα)和雌激素受体-β(estrogen receptor-β,ERβ)蛋白表达增加,并可明显提高 ERα/ERβ比值,表明鼠尾草酚能抑制ER阳性乳腺癌细胞的增殖[16]。
3 抗菌、抗病毒作用
3.1 对大肠杆菌和金黄色葡萄球菌的抑制作用
孙峋等[17]发现,迷迭香的活性提取成分中,迷迭香酸具有抗菌活性。大肠杆菌和金黄色葡萄球菌的繁殖均会被迷迭香酸抑制,并且对金黄色葡萄球菌的抑制作用远大于大肠杆菌。其作用机制是(1)抑制DNA聚合酶的活性,导致DNA复制受到影响,从而抑制细菌生长;(2)通过改变细菌细胞膜的通透性,使还原糖、蛋白质等发生渗漏,使细胞代谢受到影响。
3.2 对植物病源真菌的抑制作用
迷迭香精油对黑曲霉和绳状青霉具有一定的抑制作用[18],其机制与其中所含的大量醛类和醇类成分有关。另有研究表明,按1∶1∶1的比例,将苦参、厚朴、迷迭香提取液组成复配液,其对常见致腐酵母菌、灰霉菌、毛霉菌和青霉菌均有较好的抑制作用[19]。姚旭颖等[20]发现,迷迭香的乙醇提取物对水稻稻瘟病菌、番茄霜霉病菌、黄瓜枯萎病菌有较好的抑制作用,且浓度超过5 mg/mL时,抑菌率可以达到100%。
3.3 抗病毒作用
迷迭香酸能够抑制人类免疫缺陷病毒、疱疹病毒、日本脑炎病毒的生长[21]。在不增强细胞毒性的情况下,硝基化后的迷迭香酸对HIV整合酶的抑制作用和抗病毒活性增加;迷迭香酸能够抑制HIV-1逆转录酶活性。此外,迷迭香酸可以抑制疱疹病毒,降低小鼠脑内病毒载量及致炎细胞因子水平,使感染日本脑炎病毒小鼠的死亡率显著降低。
4 对免疫系统的作用
4.1 抗炎作用
研究发现,迷迭香酸具有优于吲哚美辛的抗炎作用,在血小板衍生生长因子-BB(platelet-derived growth factor-BB,PDGF-BB)诱导的肾小球系膜细胞增殖过程中,迷迭香酸能抑制肾小球系膜细胞分泌转化 生 长 因 子 β1(transforming growth factor-β1,TGF-β1)与单核细胞趋化蛋白1(monocyte chemoattractant protein-1,MCP-1),并能抑制肾小球系膜细胞合成纤维连结蛋白[22]。
4.2 对T细胞活化及增殖的作用
Won等[23]发现,迷迭香酸能在细胞膜上的T细胞受体附近的位点抑制相关细胞因子的激活,并能进一步通过抑制脾细胞增殖和一些细胞因子的表达从而达到抑制T细胞受体(T cell receptor,TCR)诱导的T细胞活化和增殖的效应,且该效应具有淋巴细胞特异性蛋白质酪氨酸激酶(p56 lymphocytespecific protein-tyrosine kinase,p56Lck)依赖性。
迷迭香酸对p56Lck的拮抗作用具有明显的结构选择性,实验表明,对比天然提取物迷迭香酸,部分人工合成的迷迭香酸类似物与SH2域(src homology 2 domain,SH2)的结合作用以及对T细胞活性抑制作用更强[24]。
5 对心血管系统的作用
5.1 对心肌细胞缺氧复氧损伤的保护作用
迷迭香酸对大鼠乳鼠原代心肌细胞缺氧复氧损伤具有保护作用,体外培养实验中,25、50、100 mg/L迷迭香酸能明显地抑制缺氧复氧导致的细胞活力下降,乳酸脱氢酶(lactic dehydrogenase,LDH)漏出及活性氧物质(reactive oxygen species,ROS)的过度产生,同时也能维持细胞内的ATP水平。并且,50、100 mg/L迷迭香酸能抑制缺氧复氧诱导的心肌细胞的凋亡,能下调细胞凋亡相关蛋白cleaved-caspase3表达,100 mg/L迷迭香酸能上调磷酸化蛋白激酶 B(phosphorylated protein kinase B,p-Akt)蛋白的表达,其作用机制可能是激活了Akt通路[25]。
5.2 抗血管形成作用
有研究发现,迷迭香酸抑制血管生成的作用很可能与迷迭香酸的抗氧化作用相关,可从迷迭香酸抑制活性氧簇相关的血管内皮因子(vascular endothelial growth factor,VEGF)表达、白介素-8(Interleukin-8,IL-8)释放的实验结果中得到证明。另有实验表明,迷迭香酸可抑制视网膜新血管的形成,其抗增殖作用和引起G2/M期细胞的周期性停滞及促进p21WAF1的表达作用相关,而且其效应呈现剂量依赖性且对视网膜无毒副作用,因此,迷迭香酸有望成为治疗血管增殖相关的视网膜疾病的新型药物[26-27]。
6 对神经系统的作用
6.1 对帕金森病的治疗作用
曲仂[28]研究发现迷迭香酸对帕金森病可能具有一定的治疗作用,迷迭香酸能阻断Fe2+处理后的人神经母细胞瘤细胞SK-N-SH线粒体跨膜电位差的降低,还能拮抗铁诱导的alpha-突触核蛋白的聚集,用迷迭香酸单独处理SK-N-SH细胞,可以上调血红素加氧酶1(heme oxygenase 1,HO-1)mRNA及蛋白水平,这些都能说明,迷迭香酸对帕金森病可能具有一定的治疗作用。
6.2 对阿尔茨海默病的治疗作用
近年来的研究表明,迷迭香酸可能对轻度至中度的阿尔茨海默病患者有一定的疗效。在有β淀粉样蛋白(β-amyloid protein,Aβ)的大鼠嗜铬细胞瘤(pheochromocytoma,PC12)细胞培养皿中,24小时PC12细胞死亡,然而加入迷迭香酸后,细胞死亡的现象得到了缓解,迷迭香酸可能通过抑制Aβ蛋白诱导的脂质过氧化、caspase-3激活、DNA断裂、tau蛋白过度磷酸化等机制,发挥上述作用[29]。
6.3 对血管性痴呆大鼠的影响
血管性痴呆是一种由于脑血管疾病导致的认知功能障碍临床综合征,利用双侧颈总动脉结扎(2-vessel occlusion,2-VO)法,制造血管性痴呆大鼠模型,在给大鼠吸嗅迷迭香提取物后,水迷宫实验中,吸嗅组大鼠逃避潜伏期较短;空间探索实验中,吸嗅组大鼠比模型组大鼠每分钟穿越隐匿平台位置次数多,探索次数也多于模型组。HE染色后,吸嗅组大鼠海马神经细胞层次和排列较整齐、清晰,椎体细胞数量比模型组增多,说明吸嗅迷迭香提取物能够对血管性痴呆有一定的治疗作用[30]。
7 小结
迷迭香活性提取物具有抗氧化、抗癌、抗菌、抗病毒、抗炎、抗血栓、抗抑郁等作用,国内外学者对迷迭香活性提取物的研究不断深入,对迷迭香的临床应用具有重要的指导意义。但关于迷迭香活性提取物仍有一些问题有待进一步探究或证明,例如迷迭香活性提取物的抗癌作用机制等问题,相应的药物也还有待开发,以发挥更大的社会和经济效益。
[1] 王珲.迷迭香化学成分与质量评价研究[D].沈阳:辽宁中医药大学,2011.
[2] 王珲,高慧媛,张振秋,等.中药迷迭香化学成分的分离与鉴定[J].中国现代中药,2011,13(1):23-25.
[3] 贾佳,许璟龙.迷迭香酸的研究现状[J].黑龙江医药,2014,27(2):258-260.
[4] 李霞,杨阳,黄豆豆.甘西鼠尾草药材和提取物中迷迭香酸、丹酚酸B的含量测定[J].中国医院药学杂志,2014,34(19):1635-1638.
[5] 陈頔,张泽生,杨华.迷迭香提取物对D-半乳糖致衰老小鼠氧化损伤的保护作用[J].食品工业科技,2012,14:357-359.
[6] 安晓晶,李雅娟,张红翠,等.迷迭香酸对X射线诱导微血管内皮细胞损伤的保护作用[J].石河子大学学报(自然科学版),2012,30(4):482-487.
[7] 赵云涛,陈绍红,廖艳,等.迷迭香酸对羟自由基所致小鼠肝线粒体损伤的保护作用[J].氨基酸和生物资源,2008,30(4):26-28.
[8] 周建国.迷迭香酸增强5-FU抗肝癌作用研究[D].衡阳:南华大学,2013.
[9] 代海华,宋扬,陈丹丹.刺参酸性黏多糖对5-FU治疗小鼠肝癌的监督增效作用[J].中华肿瘤防治杂志,2015,22(1):23-27.
[10] 杨立芳,雷彩霞,韦玉环,等.田基黄石油醚提取物与5-FU联用对HepG2细胞增殖及凋亡的影响[J].中成药,2014,36(9):1798-1803.
[11] Wust Z.Cytotoxicity of 5-fluorouracil:Effect on endothelial differentiation via cell cycle inhibition in mouse embryonic stem cells[J].Toxicol In Vitro,2007,54(1):22-28.
[12] Jeremy JJ.Carnosol:A promising anti-cancer and anti-inflammatory agent[J].Cancer Lett,2011,305(1):1-7.
[13] 刘英华,何宁,姜淑卿,等.雌激素及雌激素受体拮抗剂对人乳腺癌细胞MCF-7中雌激素相关受体表达的影响[J].环境与健康杂志,2011,28(8):677-680.
[14] 刘睿,赵静,张志,等.雌激素受体亚型ER-α、ER-β 在乳腺癌中的表达[J].中国老年学杂志,2012,32(16):3389-3390.
[15] 王健,徐杰,安雪青,等.雌激素促进ER阴性乳腺癌细胞中IL-6的表达[J].南京医科大学学报(自然科学版),2015,35(3):309-314.
[16] 赵丕文,David Yue-Wei LEE,Zhongze Ma,等.鼠尾草酚抗乳腺癌细胞增殖活性及其雌激素受体亚型介导和调节机制的研究[J].中国中药杂志,2014,39(17):3344-3348.
[17] 孙峋,汪靖超,李洪涛,等.迷迭香酸的抗菌机理研究[J].青岛大学学报(自然科学版),2005,18(4):41-45.
[18] 李文茹,施庆珊,莫翠云,等.几种典型植物精油的化学成分与其抗菌活性[J].微生物学通报,2013,40(11):2128-2137.
[19] 柴梦颖,焦镭.15种中草药提取液抑真菌活性的研究[J].农产品加工·学刊,2012,(5):61-64.
[20] 姚旭颖,乔竹稳,单喜臣,等.迷迭香抗植物病原菌活性研究[J].齐齐哈尔大学学报,2012,28(1):61-62.
[21] Dubois M,Bailly F,Mbemba G,et al.Reaction of rosmarinic acid with nitrite ions in acidic conditions:discovery of nitro and dinitrorosmarinic acids as new anti-HIV-1 agents[J].J Med Chem,2008,51(8):2575-2579.
[22] 李林,黄松明,赵三龙.迷迭香酸对大鼠肾小球系膜细胞增殖中氧化应激及炎症介质分泌的影响[J].实用诊断与治疗杂志,2007,21(12):888-890.
[23] Won J,Hur YG,Hur EM,et al.Rosmarinic acid inhibits TCR-induced T cell activation and proliferation in an Lck-dependent manner[J].Eur JImmunol,2003,(33):870-879.
[24] Park SH,Oh HS,Kang MA,et al.The structure-activity re lationship of the seriesof non-peptide small antagonists for p56lck SH2 domain[J].Bioorg Med Chem,2007,15(11):3938-3950.
[25] 李雪丽,刘建勋,李澎,等.迷迭香酸对心肌细胞缺氧复氧损伤的保护作用研究[J].中国中药杂志,2014,39(10):1897-1901.
[26] Huang SS,Zheng RL.Rosmarinic acid inhibits angiogenesis and its mechanism of action in vitro[J].Cancer Lett,2006,239(2):271-280.
[27] Kim JH,Lee BJ,Kim JH,et al.Rosmarinic acid suppresses retinal neovascularization via cell cycle arrest with increase of P21(WAF1)expression[J].Eur JPharmacology,2009,615(1-3):150-154.
[28] 曲仂.迷迭香酸对铁处理的SK-N-SH细胞的神经保护作用机制研究[D].青岛:青岛大学,2014.
[29] Iuvone T,Defilippis D,Esposito G,et al.The spice sage and its active ingredient reamarinic acid protect PC12 cells from amyloidβ peptide-induced neumtoxicity[J].J Pharmacol Exp Ther,2006,317(3):1143-1149.
[30] 窦云龙.迷迭香吸嗅对血管性痴呆大鼠学习记忆及海马内5-HT和GABA含量的影响[D].合肥:安徽医科大学,2013.
