2D结构V2O5材料的制备与储锂性能
2015-03-26李延伟温胜山姚金环梁晓丽张灵志
李延伟,温胜山,姚金环,梁晓丽,张灵志
(桂林理工大学 化学与生物工程学院 广西矿冶与环境科学实验中心,桂林 541004)
锂离子电池因其较高的能量密度、良好的循环稳定性和低自放电率等优点,已被广泛应用于便携式电子器件中,同时其作为动力电池和储能电源正在被逐渐应用于混合动力车(HEV)、纯电动车(EV)及可再生能源电站等领域[1-2]。电极材料的优劣是决定锂离子电池综合性能的关键因素之一,因此,设计开发高性能、廉价的电极材料一直是锂离子电池的研究热点[3-4]。在诸多的正极材料中,具有层状结构的正交相V2O5以其原料来源广泛、价格相对低廉、容易制备、安全性好等优点受到了广泛关注,被认为是非常有应用前景的新一代锂离子电池正极材料[2,5-7]。然而较差的循环稳定性、较低的锂离子扩散系数和不良的电子导电性一直是制约 V2O5作为锂离子电池正极材料实际应用的关键问题[8-10]。为了改善V2O5正极材料的电化学循环稳定性和嵌/脱锂动力学性能,近年来国内外学者对其进行了大量的研究并发现纳米化是提高 V2O5电化学性能的有效方法之一[11-13]。与其他纳米结构相比,2D纳米结构(纳米片)通常会暴露出更大的比表面积和特定的晶面,非常有利于 Li+的快速脱/嵌,因此在锂离子电池领域受到了越来越广泛的关注[14]。我们在先前的工作中制备并研究了2D结构V2O5纳米片在2.0~4.0 V(vs Li/Li+)电位窗口下的储锂性能,发现该材料具有高的嵌锂活性和优异的大倍率充放电性能[5]。实际上V2O5在2.5~4.0 V(vs Li/Li+)电位窗口下其理论容量仍高达147 mA·h/g,而且在该电位窗口下充放电过程其结构变化相对较小,通常比在2.5~4.0 V(vs Li/Li+)电位窗口下具有更好的循环稳定性[15]。因此,系统地研究2D结构V2O5纳米片在2.5~4.0 V(vs Li/Li+)电位窗口下的储锂性能及其动力学是非常必要的,然而目前关于这方面的研究鲜有报道。本文作者采用溶胶-凝胶法并结合冷冻干燥技术制备了2D结构V2O5前驱体,然后将前驱体在空气中煅烧得到具有 2D片状结构的正交相 V2O5样品,通过循环伏安(CV)、电化学交流阻抗(EIS)和充放电测试研究了V2O5样品在2.5~4.0 V(vs Li/Li+)电位窗口内的Li+扩散系数、电化学反应阻抗、倍率性能和电化学循环稳定性。
1 实验
1.1 样品的制备与结构表征
首先称量0.25 g商业化V2O5粉体,在搅拌条件下将其倒入3.85 mL蒸馏水中,再加入1.15 mL H2O2搅拌反应15 min后,超声振荡10 min,然后加入20 mL蒸馏水,继续超声振荡60 min即得到红棕色的V2O5凝胶。将制备好的V2O5凝胶稀释至0.028 mol/L,搅拌均匀后放入冰箱中冷冻24 h,然后取出放入冷冻干燥机(FD-1B-50,北京博医康实验仪器有限公司)中进行冷冻干燥得到V2O5前驱体。将V2O5前驱体在空气中450 ℃煅烧2 h即得到V2O5样品。
采用荷兰PANalyteica X’Pert Pro多功能X射线衍射仪(Cu靶,40 kV,30 mA)分析样品的晶体结构,测试中扫描速度为5 (°)/min,扫描范围为5°~75°。采用美国 SDTQ600热重分析仪分析样品的热稳定性,测试气氛为空气,温度范围25~600 ℃,升温速度为10℃/min。采用日本日立S-4800型场发射扫描电子显微镜(FESEM)观察样品的表面形貌。
1.2 样品的电化学性能测试
将制备好的V2O5样品、导电剂Super P和粘结剂PVDF按质量比 7:2:1混合研磨均匀后,加入适量的N-甲基吡咯烷酮(NMP),调匀成浆状后均匀涂覆在铝箔上,在80 ℃下干燥至恒重,冲裁后得到V2O5电极片。以V2O5电极片为工作电极,金属锂片为对电极,聚丙烯多孔膜(Celgard 2400)为隔膜,1 mol/L LiPF6的碳酸乙烯酯(EC)、碳酸二甲酯(DMC)和碳酸二乙酯(DEC)的混合液(m(EC):m(DMC):m(DEC)=1:1:1)为电解液,在充满氩气的手套箱中组装成 CR2025型扣式电池。
采用电化学工作站(CHI860D,北京科伟永兴仪器有限公司)对电池进行循环伏安(CV)与交流阻抗(EIS)测试,CV测试的电压扫描范围为2.5~4.0 V,扫描速度为0.02、0.04、0.06、0.08和0.1 mV/s;EIS测试的频率范围为1×10-2~1×105Hz,正弦激励信号振幅为5 mV。使用LAND电池测试系统(CT2001A,武汉蓝电电子设备有限公司)对电池进行恒流充放电测试,电压范围为2.5~4.0 V,其中倍率性能测试的电流密度分别为20、50、200、500、1000和2000 mA/g,循环性能测试的电流密度分别为200 mA/g(循环50圈)和500 mA/g(循环 100 圈)。
2 结果与讨论
2.1 样品的结构分析
图 1所示为冷冻干燥得到的 V2O5前驱体在煅烧前、后的XRD谱。从图1(a)可以看到,V2O5前驱体在 2θ为 7.65°、23.08°、30.92°、38.96°、47.31°处有明显的衍射峰,分别对应 V2O5·1.6H2O 标准 XRD 谱(JCPDS card No. 40-1296)中的(001)、(003)、(004)、(005)、(006)晶面衍射峰[15],这说明 V2O5前驱体为V2O5·nH2O冻干胶。由XRD数据计算可知V2O5前驱体的层间距约为12.34 Å,略高于文献[16]中报道的层间距值(11.50 Å)。从图1(b)可以看到,V2O5前驱体经过煅烧后其XRD衍射峰与正交晶系V2O5的标准XRD谱(JCPDS card No. 41-1426)完全吻合[9,12-13],这说明经煅烧后V2O5前驱体已完全转变为正交晶系V2O5样品。由XRD数据计算可知,V2O5样品的晶格参数为a=11.51 Å、b=3.56 Å、c=4.38 Å,平均晶粒尺寸约为43 nm。
图 2所示为V2O5前驱体在空气气氛下的热重分析(TGA)曲线。从图2可以看到,V2O5前驱体的质量损失主要可分为两个阶段。第一阶段为室温至120 ℃,这部分质量损失主要是样品中的吸附水和弱结晶水失去引起的;第二阶段在120~350 ℃之间,这部分质量损失主要是由样品中层间结晶水失去引起的[17]。两阶段的总质量损失量约为12.6%,计算可知V2O5前驱体的化学式为V2O5·1.5H2O,这与上文的XRD测试结果基本一致(见图1(a))。当温度达到350 ℃,样品已完全失水并转变为正交相V2O5;随着温度继续升高至500℃样品略有增质(约 0.3%),这主要是由正交相 V2O5中氧缺陷去除引起的;当温度高于500 ℃样品的质量几乎不发生变化。
图3所示为V2O5前驱体及其煅烧后的V2O5样品FESEM 像。从图 3(a)可以看出,V2O5前驱体具有大面积的2D片状结构形貌,在片状结构的边缘有纤维状的纳米结构存在(见图3(a)插图),这些纤维状纳米结构是五氧化二钒水化物(V2O5·nH2O)的特征结构[16],由此可推断 2D片状结构 V2O5前驱体是由大量的V2O5·nH2O纳米纤维组装而成,这与上文的XRD测试结果相一致(见图 1(a))。从图 3(b)可以看出,V2O5前驱体经煅烧后破碎为面积较小的2D片状结构V2O5和少量棒状结构 V2O5颗粒,2D片状结构 V2O5实际上是由大量小晶粒构成。
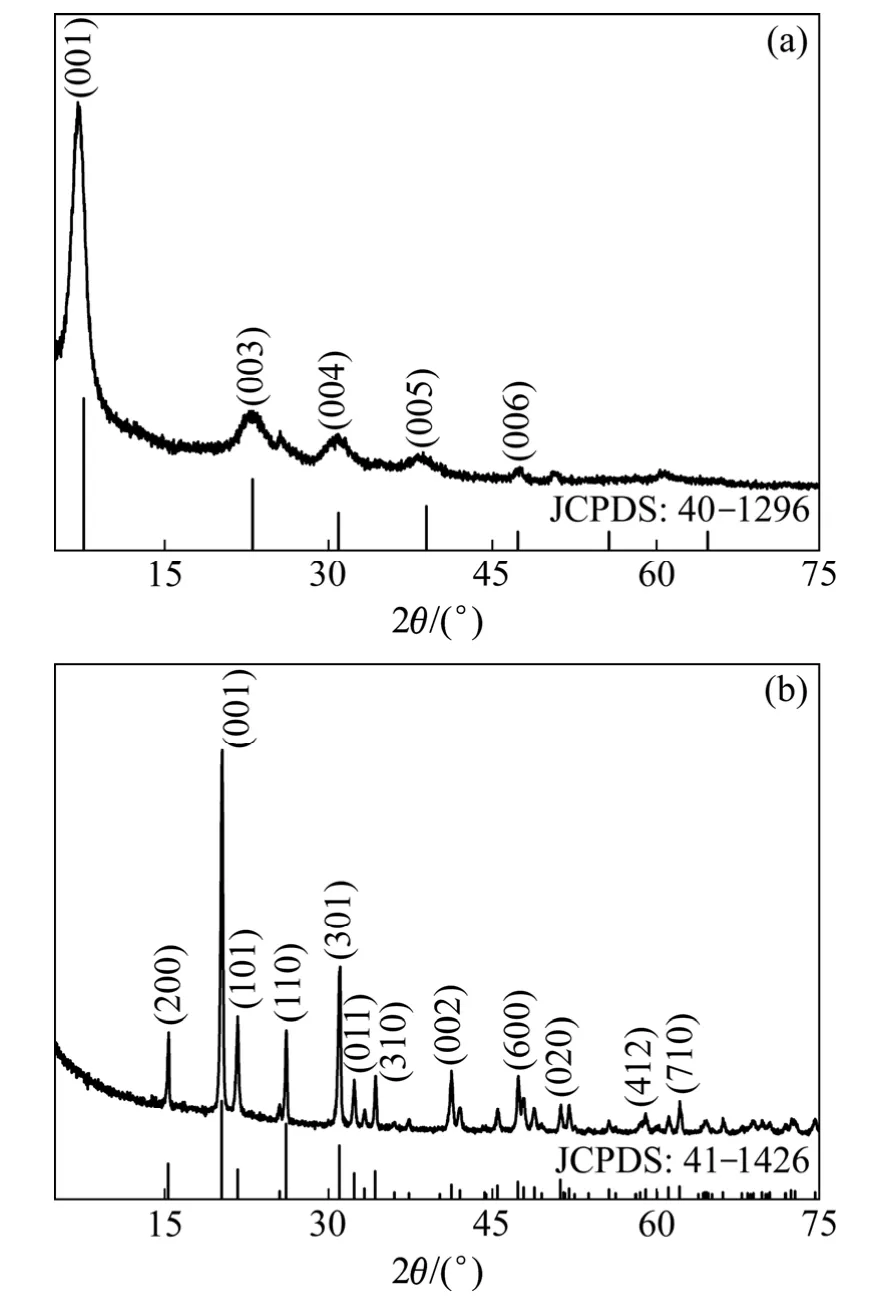
图1 V2O5前驱体在煅烧前和煅烧后的XRD谱Fig. 1 XRD patterns of V2O5 precursor before (a) and after (b)calcining in air
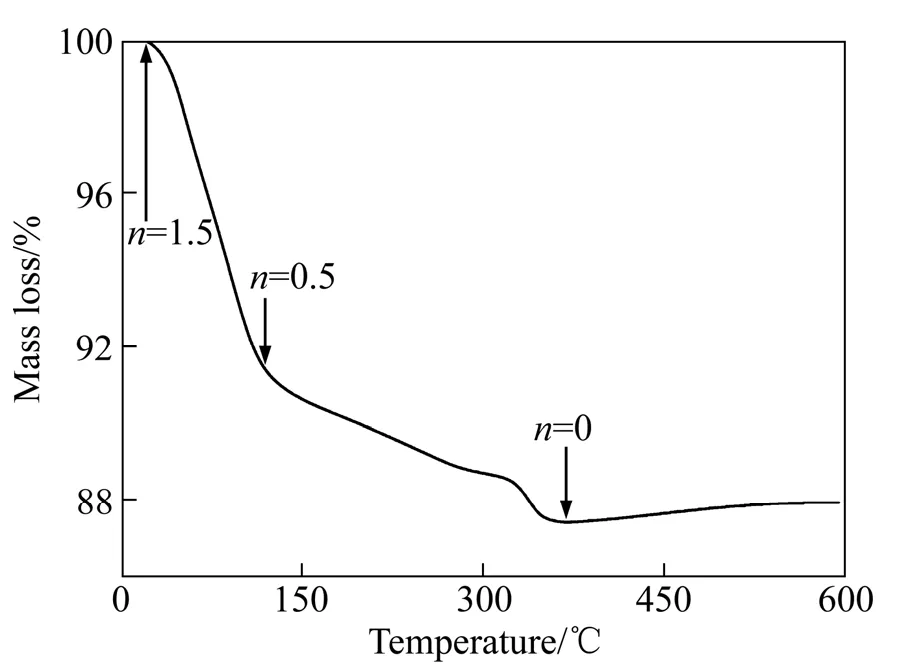
图2 V2O5前驱体的TGA曲线Fig. 2 TGA plot of V2O5 precursor

图3 V2O5前驱体在煅烧前和煅烧后得到的FESEM像Fig. 3 FESEM images of V2O5 precursors before (a) and after (b)calcining in air
2.2 V2O5样品的电化学性能
图 4所示为煅烧后V2O5样品的倍率性能和循环性能曲线。从图4(a)可以看出,在20 mA/g电流密度下 V2O5样品的稳定放电比容量高达 144 mA·h/g,与其理论比容量(147 mA·h/g)非常接近;随着充放电电流密度的增大,样品的放电比容量逐渐降低,在50、200、500、1000和2000 mA/g下的放电比容量分别达到123、101、86、68和 45 mA·h/g。由此可见,V2O5样品具有高的电化学活性和较好的倍率性能,这主要是V2O5样品独特的2D片状纳米结构非常有利于Li+的快速脱/嵌。从图4(b)可以看出,当充放电电流密为20 mA/g时,V2O5样品的放电曲线在3.19和3.39 V附近有两个明显的平台,分别对应α/ε和ε/δ相变反应;充电曲线在3.22、3.30和3.42 V附近有3个明显的平台,其中3.22和3.30 V的平台对应的是δ/ε相变反应,3.42 V的平台对应的是 ε/α相变反应[18]。随着充放电电流密度的增加,样品的充电电压逐渐升高,原来在3.30 V附近的充电平台逐渐消失;样品的放电电压逐渐降低,并且第一个放电平台越来越短直至消失。图4(c)和(d)所示分别为V2O5样品在200和500 mA/g电流密度下的循环性能曲线。从图4(c)可以看出,在200 mA/g电流密度下,其放电比容量稳定在100 mA·h/g,经过50次充放电循环后放电比容量几乎没有衰减;从图4(d)可以看出,在500 mA/g电流密度下,其放电比容量稳定在90 mA·h/g,经过100次充放电循环后放电比容量几乎没有衰减,这明显优于文献中报道的V2O5纳米线(在25 mA/g电流密度下经过50次充放电循环容量保持率仅为70%)[19]、V2O5纳米纤维(在20 mA/g电流密度下经过 30次充放电循环容量保持率为 90%)[20]和V2O5纳米棒(在150 mA/g电流密度下经过50次充放电循环容量保持率约为70%)[21]的循环性能。2D结构V2O5样品具有良好循环稳定性的主要原因是样品特殊的2D片状纳米结构一方面有利于Li+的快速脱/嵌,另一方面还有助于释放 Li+的脱/嵌过程中因体积变化而引起的应力。
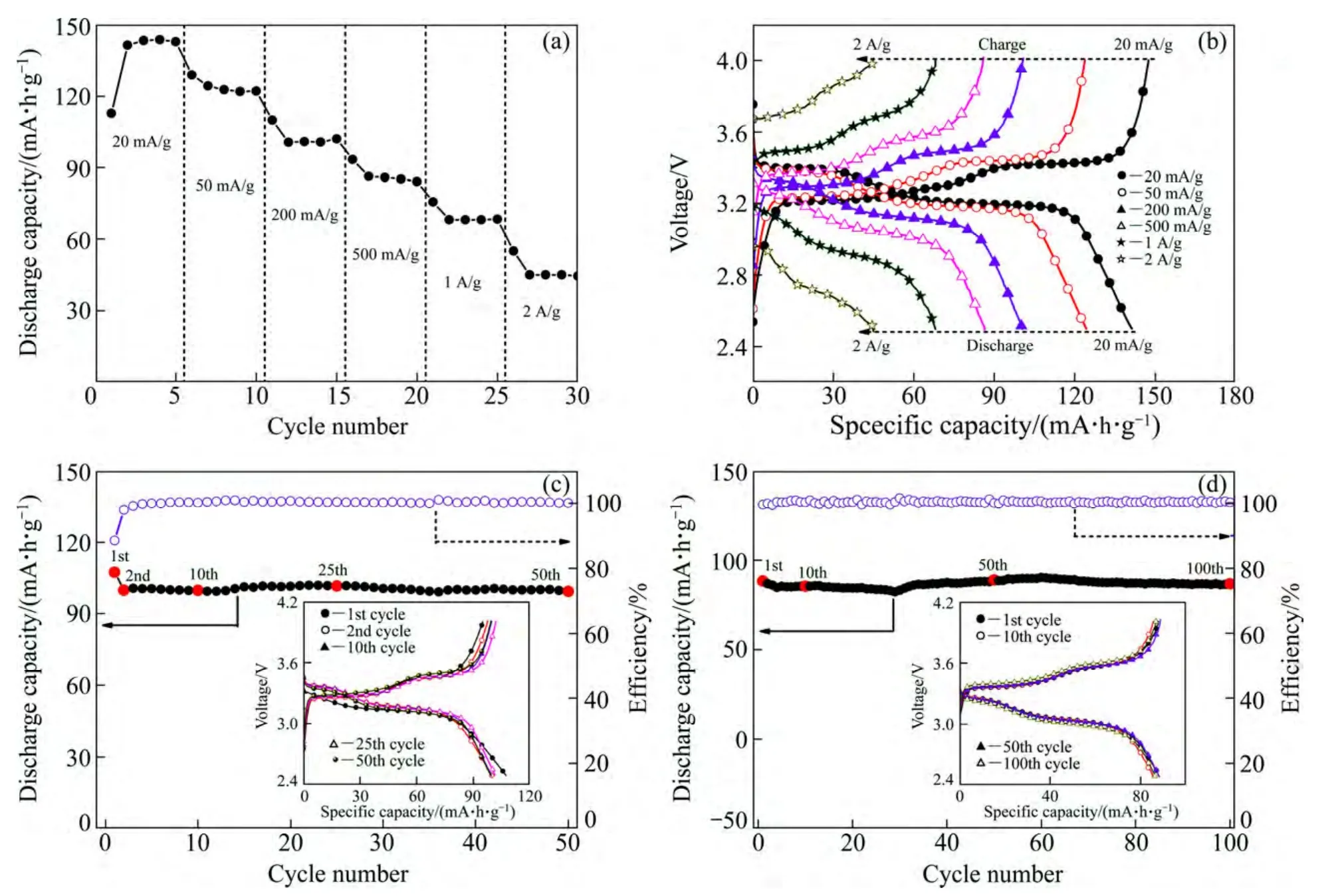
图4 V2O5样品在不同电流密度下的倍率性能曲线和充放电曲线以及在200 mA/g和500 mA/g电流密度下的循环性能曲线(图c、d中插图对应的是不同循环圈数下的充放电曲线)Fig. 4 Rate performance curves (a) and charge/discharge curves (b) of V2O5 samples electrode at various current densities, and cycling performance curves of V2O5 samples electrode at current density of 200 mA/g (c) and 500 mA/g (d), respectively (Inset showing charge/discharge curves at various cycles)
图5(a)所示为V2O5样品在不同扫描速度下的CV曲线。从图 5(a)可以看出,正向扫描时样品有两个非常明显的氧化峰和一个较弱氧化峰,反向扫描时样品有两个非常明显的还原峰,这与上文中的充放电曲线平台特征一致。随着扫描速度的增加,样品的氧化峰向高电位移动、还原峰向低电位移动。同时峰电流随着扫描速度的增加而增大,峰电流(ip)与扫描速度的平方根(v1/2)具有很好的线性关系(如图 5(b)和(c)所示),这是典型的扩散控制过程[22-23]。在半无限扩散条件下,样品的化学扩散系数可通过Randle-Sevick方程[9]计算出:

式中:ip为峰值电流,A;n为反应过程中转移的电子数,S为电极表面积,cm2;DLi为Li+的化学扩散系数,cm2/s;为反应物体相浓度,mol/cm3;v为扫描速率,V/s。根据方程(1)以及图 5(b)和(c)中拟合直线的斜率可计算出各还原峰和氧化峰对应嵌/脱反应的 Li+扩散系数,结果如表1所列。从表1可以看出Peak(O2)和 Peak(R1)对应的 Li+扩散系数相对较小,说明这两个阶段的Li+脱出和嵌入过程动力学性能较差,由此可以推断在大电流充放电时这两阶段的容量衰减会更显著,这与上文中不同电流密度下的充放电测试结果一致(见图 4(b))。
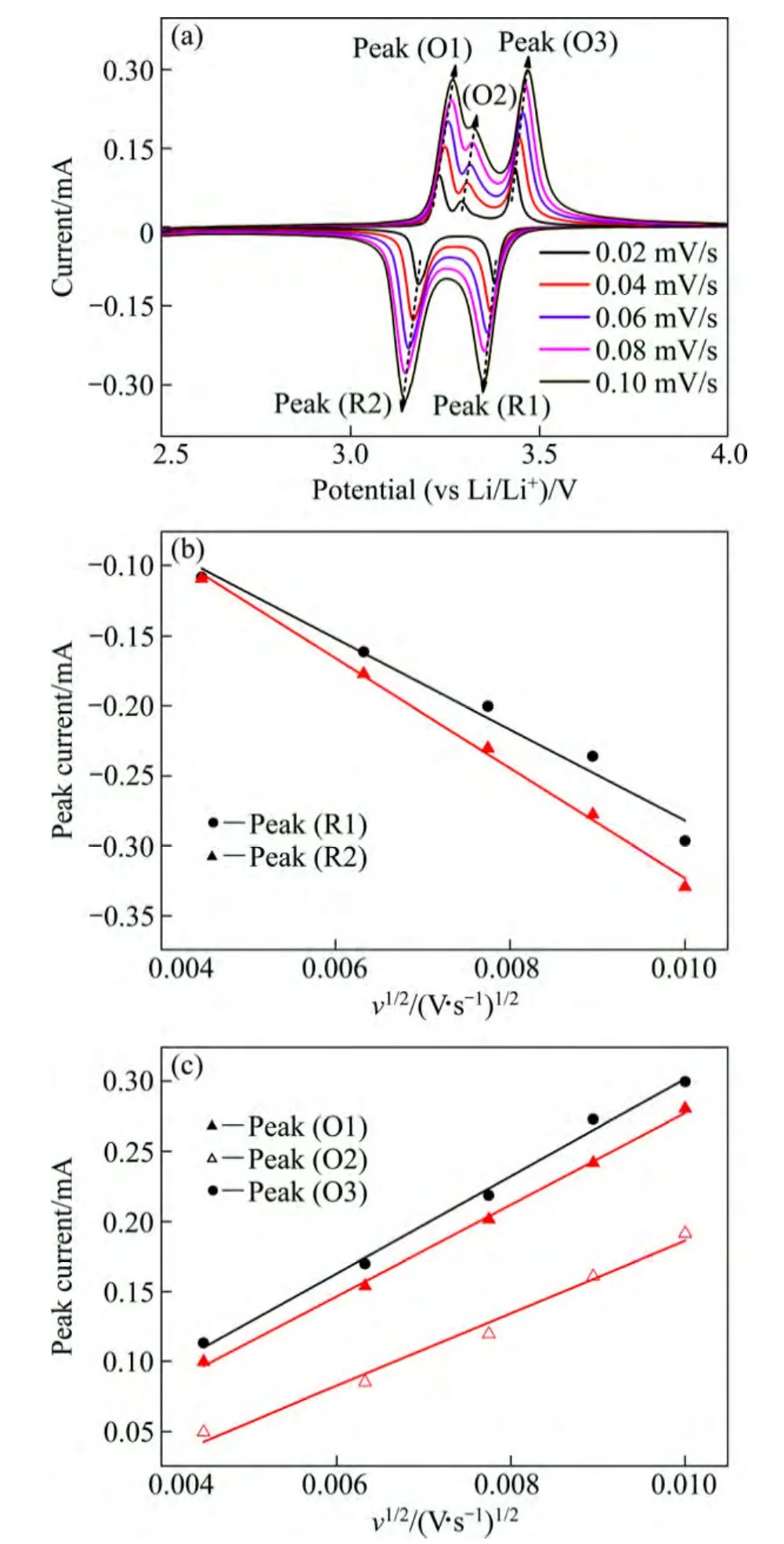
图 5 V2O5样品在不同扫描速度下的循环伏安曲线及还原峰和氧化峰的峰电流与扫描速度平方根的关系拟合直线图(图中点和线分别代表实验数据和拟合直线)Fig. 5 CV curves of V2O5 samples at various scan rates (a),and relationship of peak current (ip) and square root of scan rate(v1/2) for reduction peaks (b) and anodic peaks (c) (Symbols and lines representing experimental data and fitted linear lines,respectively)
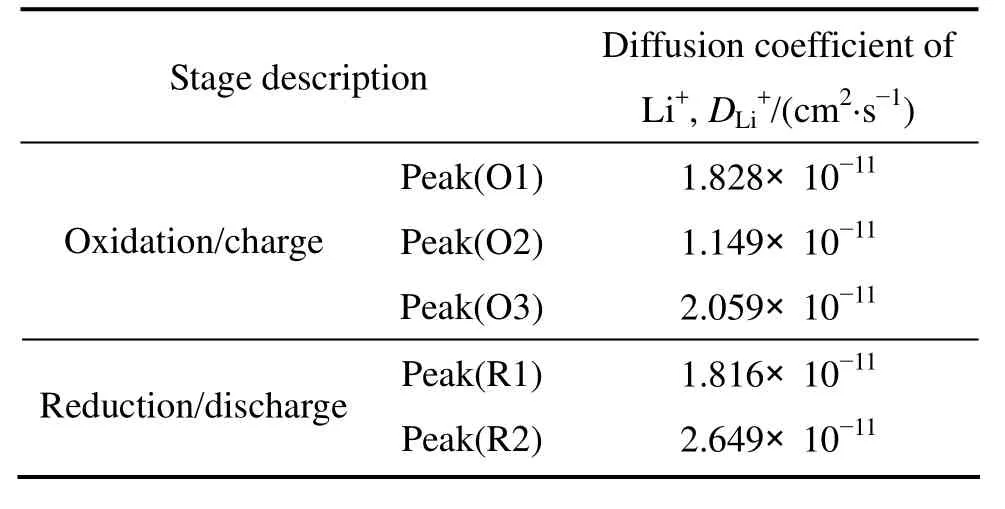
表1 V2O5样品的锂离子扩散系数的计算值Table 1 Calculated values of lithium ion diffusion coefficient for V2O5 sample
图 6(a)所示为 V2O5样品在不同放电深度(DOD)下的交流阻抗谱图。从图 6(a)可以看出,样品的电化学阻抗均由高频区的半圆和低频区的斜线组成,其中高频区的半圆反应的是电荷转移过程的阻抗以及电极和电解液间的界面容抗,低频区的斜线反应的是 Li+在固态活性物质中扩散引起的Warburg阻抗[24-26]。对图6(a)中的数据采用等效电路(如图6(a)中插图所示,其中RΩ表示欧姆阻抗,CPE表示常相角元件,Rct表示电化学反应阻抗,W表示Warburg阻抗)进行拟合可求得各放电深度对应的电化学反应阻抗值(Rct),结果如图6(b)所示。从图6(b)中可以看出,样品的Rct值按DOD为13%、37%、0%、68%、90%和100%的顺序依次增大,其中在3.39 V附近放电平台(13% DOD)对应的电化学反应阻抗值最小(250 Ω);随着放电深度的增加,样品的电化学反应阻抗值也越来越大,当放电深度为90% DOD时样品的电化学反应阻抗值增加至280 Ω;当放电深度为100% DOD时样品的电化学反应阻抗值急剧增加至322 Ω。随着Li+嵌入量的增加,V2O5的电子导电性会逐渐变差[27],这可能是导致材料电化学反应阻抗增加的主要原因。
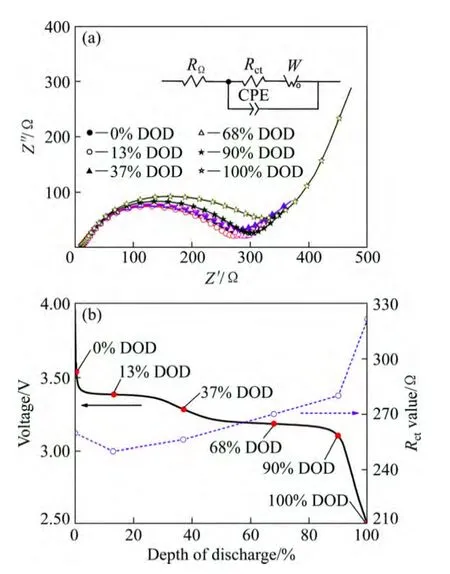
图6 V2O5样品在不同放电深度下的EIS谱(a)和Rct曲线(b)Fig. 6 EIS plots (a) and Rct values (b) of V2O5 samples at various depths of discharge (DOD) states
3 结论
1) 采用溶胶凝胶法制备V2O5凝胶,通过对V2O5凝胶进行冷冻干燥并在空气中 450 ℃煅烧获得了 2D片状结构正交相V2O5样品。
2) 充放电测试发现该样品具有高的电化学活性、良好的倍率性能和优异的电化学循环稳定性。其中在20 mA/g电流密度下,V2O5样品的稳定放电比容量高达144 mA·h/g;在1000和2000 mA/g高电流密度下其放电比容量分别达到68和45 mA·h/g;在200 mA/g下充放电循环50圈和500 mA·h/g下充放电循环100圈,样品的放电容量几乎未见衰减。
3) 循环伏安测试发现样品的充放电过程受扩散控制,样品中的Li+扩散系数随着反应过程的变化而变化,较低的扩散系数是样品在大电流充放电下容量衰减的主要原因之一。
4) 交流阻抗测试发现样品的电化学反应阻抗值与放电深度密切相关,随着放电深度的增加样品的电化学反应阻抗逐渐增大,尤其是当放电深度为 100%DOD时样品的电化学反应阻抗最大。
[1] ETACHERI V, MAROM R, ELAZARI R, SALITRA G,AURBACH D. Challenges in the development of advanced Li-ion batteries: A review[J]. Energy & Environmental Science,2011, 4(9): 3243-3262.
[2] 梁书全, 潘安强, 刘 军, 钟 杰, 陈 涛, 周 江. 锂离子电池纳米钒基正极材料的研究进展[J]. 中国有色金属学报,2011, 21(10): 2448-2464.LIANG Shu-quan, PAN An-qiang, LIU Jun,ZHONG Jie, CHEN Tao, ZHOU Jiang. Research developments of V-based nanomaterials as cathodes for lithium batteries[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(10): 2448-2464.
[3] 王兆翔, 陈立泉, 黄学杰. 锂离子电池正极材料的结构设计与改性[J]. 化学进展, 2011, 23(2/3): 284-301.WANG Zhao-xiang, CHEN Li-quan, HUANG Xue-jie.Structural design and modification of cathode materials for lithium ion batteries[J]. Progress in Chemistry, 2011, 23(2/3):284-301.
[4] PAN Cheng-chi, BANKS C E, SONG Wei-xin, WANG Chi-wei,CHEN Qi-yuan, JI Xiao-bo. Recent development of LiNixCoyMnzO2: Impact of micro/nano structure for imparting improvements in lithium batteries[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(1): 108-119.
[5] YANG J W, HUANG Y X, ZHANG M, CAO G Z. Leaf-like V2O5nanosheets fabricated by a facile green approach as high energy cathode material for lithium-ion batteries[J]. Advanced Energy Materials, 2013, 3(9): 1171-1175.
[6] 司玉昌, 邱景义, 王维坤, 余仲宝, 杨裕生. 锂钒氧系锂离子电池正极材料的研究进展[J]. 稀有金属材料与工程, 2013,42(5): 1096-1100.SI Yu-chang, QIU Jing-yi, Wang WEI-kun, YU Zhong-bao,YANG Yu-sheng. Research progress in lithium vanadium oxides as cathode materials[J]. Rare Metal Materials and Engineering,2013, 42(5): 1096-1100.
[7] 耿 明, 赵宏滨, 徐甲强. 锂离子电池用高性能五氧化二钒[J]. 硅酸盐学报, 2011, 39(7): 1130-1134.GENG Ming, ZHAO Hong-bin, XU Jia-qiang. High performance vanadium pentoxide for lithium battery[J]. Journal of the Chinese Ceramic Society, 2011, 39(7): 1130-1134.
[8] WHITTINGHAM M S. Lithium batteries and cathode materials[J]. Chemical Reviews, 2004, 104(10): 4271-4320.
[9] LI Y W, YAO J H, UCHAKER E, ZHANG M, TIAN J, LIU X Y,CAO G Z. Sn-doped V2O5film with enhanced lithium storage performance[J]. Journal of Physical Chemistry C, 2013, 117(45):23507-23514.
[10] CHAN C K, PENG H L, TWESTEN R D, JARAUSCH K,ZHANG X F, CUI Y. Fast, Completely reversible Li insertion in vanadium pentoxide nanoribbons[J]. Nano Letters, 2007, 7(2):490-495.
[11] WANG Y, TAKAHASHI K, LEE K H, CAO G Z.Nanostructured vanadium oxide electrodes for enhanced lithium-ion intercalation[J]. Advance Functional Materials, 2006,16(9): 1133-1144.
[12] PAN A Q, WU H B, ZHANG L, LOU X W. Uniform V2O5nanosheet-assembled hollow microflowers with excellent lithium storage properties[J]. Energy & Environmental Science, 2013,6(5): 1476-1479.
[13] FANG D, LI L C, XU W L, LI G Z, LUO Z P, LIANG C W, JI Y S, XU J, XIONG C X. Self-assembled hairy ball-like V2O5nanostructures for lithium ion batteries[J]. RSC Advances, 2014,4: 25205-25209.
[14] LIU J H, LIU X W. Two-dimensional nanoarchitectures for lithium storage[J]. Advanced Materials, 2012, 24(30):4097-4111.
[15] PETKOV V, TRIKALITIS P N, BOZIN E S, BILLINGE S J L,VOGT T, KANATZIDIS M G. Structure of V2O5·H2O xerogel solved by the atomic pair distribution function technique[J].Journal of American Chemical Society, 2002, 124(34):10157-10162.
[16] LIVAGE J. Vanadium pentoxide gels[J]. Chemistry of Materials,1991, 3(4): 578-593.
[17] WANG Y. SHANG H M, CHOU T P, CAO G Z. Effects of thermal annealing on Li+intercalation properties of V2O5·nH2O xerogel films[J]. Journal of Physical Chemistry B, 2005, 109(22):11361-11366.
[18] LIN S, SHAO B, TANIGUCHI I. One-step synthesis of dense and spherical nanostructured V2O5particles for cathode of lithium batteries and their electrochemical properties[J].Materials Research Bulletin, 2014, 49: 291-296.
[19] SENG K H, LIU J, GUO Z P, CHEN Z X, JIA D Z, LIU H K.Free-standing V2O5electrode for flexible lithium ion batteries[J].Electrochemistry Communications, 2011, 13(5): 383-386.
[20] CHEAH Y L, ARAVINDAN V, MADHAVI S. Synthesis and enhanced lithium storage properties of electrospun V2O5nanofibers in full-cell assembly with a spinel Li4Ti5O12anode[J].ACS Applied Materials & Interfaces, 2013, 5: 3475-3480.
[21] CHEN D Z, QUAN H Y, LUO S L, LUO X B, DENG F, JIANG H L. Reduced grapheme oxide enwrapped vanadium pentoxide nanorods as cathode materials for lithium-ion batteries[J].Physica E: Low-dimensional Systems and Nanostructures, 2014,56: 231-237.
[22] MARK A J, RAISTRICK I D, HUGGINS R A, The kinetics of the electrochemical insertion of lithium into cubic sodium tungsten bronzes[J]. Journal of the Electrochemical Society,1983, 130 (4): 776-782.
[23] RUI X H, DING N P, LIU J C, LI C G, CHEN C. Analysis of the chemical diffusion coefficient of lithium ions in Li3V2(PO4)3cathode material[J]. Electrochimica Acta, 2010, 55(7):2384-2390.
[24] LIU B, YUAN H T, ZHANG Y S. Impedance of Al-substituted α-nickel hydroxide electrodes[J]. International Journal of Hydrogen Energy, 2004, 29(5): 453-458.
[25] YU R X, ZHANG C F, MENG Q, CHEN Z X, LIU H K, GUO Z P. Facile synthesis of hierarchical networks composed of highly interconnected V2O5nanosheets assembled on carbon nanotubes and their superior lithium storage properties[J]. ACS Applied Materials & Interfaces, 2013, 5(23): 12394-12399.
[26] 宋刘斌, 李新海, 王志兴, 郭华军, 肖忠良, 唐朝辉. Fe3+掺杂Li4Ti5O12的结构及电化学性能[J]. 中国有色金属学报, 2013,23(5): 1351-1355.SONG Liu-bin, LI Xin-hai, WANG Zhi-xing, GUO Hua-jun,XIAO Zhong-liang, TANG Zhao-hui. Structure and electrochemical performance of Fe3+-doped Li4Ti5O12[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(5): 1351-1355.
[27] EI-SAYED A M, MOUSA S M A. Preparation and some properties of lithium vanadium bronzes[J]. Journal of the Chinese Chemical Society, 2006, 53(3): 559-565.
