红土镍矿中MgSiO3在NaOH亚熔盐体系中的浸出反应机理
2015-03-26赵昌明翟玉春王国承艾新港
赵昌明 , 翟玉春, 王国承 艾新港
(1. 辽宁科技大学 材料与冶金学院,鞍山 114051;2. 东北大学 材料与冶金学院,沈阳 110004)
我国硅镁型红土镍矿的特点是品位低、多伴生矿,且矿中镁、硅含量(质量分数)高达 30%以上,易形成镁硅酸盐(如MgSiO3和Mg2SiO4)。矿中各种金属离子相互镶嵌[1-2],不能采用传统选矿的方法富集,给其利用带来很大困难。因此,开发新处理工艺对硅镁型红土镍矿冶炼工艺的改进和创新尤为重要。
目前,处理硅镁型红土镍矿工艺分为火法、湿法和火法-湿法联合工艺。火法工艺产品以镍铁合金为主[3-5],不仅能耗高,而且产生大量含硅废渣,对生态环境造成严重危害;湿法工艺虽然可以使矿中部分有价元素得到利用,但生产成本高,且工艺废液处理困难,环保问题难以解决[6-9];火法-湿法联合工艺目前存在的问题是流程复杂、产品质量难以控制、大规模工业应用尚不成熟[10-12]。近年来,采用亚熔盐法处理硅镁型红土镍矿,因其工艺简单、能耗低、投资少而受到人们的广泛关注。亚熔盐法利用成键的 OH-既可以破坏红土镍矿中稳定的MgSiO3或 Mg2SiO4硅酸盐结构,又可以提高红土镍矿品位,为镍、铁、镁有价元素提取提供创造有利条件,因此,有必要对该处理过程进行深入研究。目前,本文作者的课题组在亚熔盐法处理硅酸盐型红土镍矿开展了许多研究工作,例如处理工艺条件的优化以及宏观动力学等方面[13],并且对矿中Mg2SiO4在NaOH亚熔盐体系中的反应机理进行研究[14]。
本文作者利用XRD和IR对反应后的水浸渣结构进行测试,采用拉曼光谱在线分析 MgSiO3在NaOH亚熔盐体系反应过程,研究硅镁型红土镍矿中MgSiO3在NaOH亚熔盐体系中转化过程和反应机理,为亚熔盐法处理硅酸盐型红土镍矿提供理论依据。
1 实验
1.1 实验原料与仪器
实验所用 NaOH、Na2SiO3·9H2O、Mg(NO3)2·6H2O均为分析纯,水为去离子水。
反应器由不锈钢制成,采用加热套加热,通过KWT型控制器控温,采用镍铬-镍硅热电耦测温,温控精度为±2 ℃,反应釜上装有搅拌装置和回流冷凝管,其接口处、采样口以及釜盖均采取密封措施,实验装置如图1所示。
采用日本理学公司 Rigaku Ultima IV射线衍射仪(XRD)和美国 Nicolet 380型红外光谱仪(IR)分析MgSiO3和水浸渣物相与结构,采用法国 HORIBA JOBIN YVON公司Lab RAM HR-800型拉曼光谱仪在线测试MgSiO3在NaOH亚熔盐体系中的反应过程。
1.2 实验方法
1.2.1 MgSiO3的合成
在室温搅拌条件下,将等摩尔浓度的Na2SiO3·9H2O和Mg(NO3)2·6H2O溶液以相同速率同时滴入2 L烧杯中。反应结束后固液分离,反复水洗,固体产物经150 ℃烘干,得到MgSiO3前躯体。前躯体置于刚玉坩埚内,放入马弗炉中煅烧以备用。
1.2.2 MgSiO3在NaOH亚熔盐体系中浸出
按一定的液固比(NaOH溶液质量与MgSiO3的质量比)加入 MgSiO3,开通冷凝水,搅拌并加热到设定的温度,反应经过一段时间后,降至室温并加水浸出,通过离心分离得到含可溶性硅酸盐的浸出液和水浸渣,浸出液中SiO2含量采用氟化钠滴定法测定。
1.2.3 Raman光谱在线检测MgSiO3在NaOH亚熔盐体系中反应过程
称取一定量NaOH放入玛瑙研钵中,加入去离子水至设定浓度,按一定的液固比(NaOH溶液质量与MgSiO3的质量比)加入MgSiO3,在研钵中研细混合,以确保粉末充分混合均匀。用药品匙取少量样品放入直径为5 mm的铂坩埚中,然后将铂坩埚放入样品池进行拉曼光谱测定。
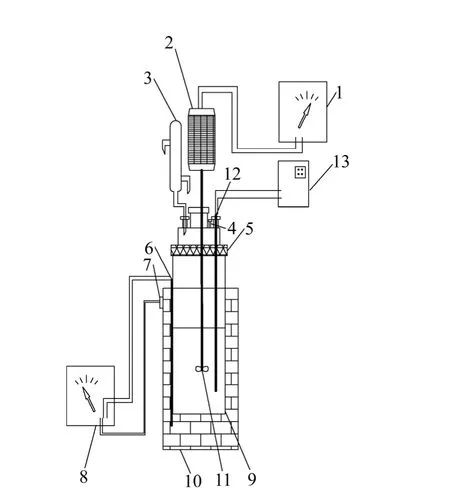
图1 实验装置图Fig. 1 Schematic diagram of experimental apparatus: 1—AC adjustablem speed controller; 2—Agitatro; 3—Reflux condenser; 4—Thief hatch; 5—Nipple; 6—Thermocouple; 7—Set of posts; 8—Temperature controller; 9—Reaction kettle;10—Heating jacket; 11—Stirrer; 12—Thermocouple; 13—Digital display device
2 结果与分析
2.1 MgSiO3的表征
MgSiO3前躯体分别经过800、1000和1200 ℃煅烧3 h所得产物的XRD谱如图2所示。通过比较XRD谱可知,随着煅烧温度的升高,产物衍射峰强度逐渐增强,特别是28.5°和31°位置的衍射峰的强度变化明显。检索发现,800 ℃和1000 ℃焙烧产物的XRD衍射峰位置与顽火辉石(JCPDS No.2-546)或斜顽火辉石(JCPDS No.7-216)一致,由于顽火辉石和斜顽火辉石在衍射角 31°(2θ)、28.5°(2θ)处都有主吸收峰,因此很难辨认[15]。而 1200 ℃焙烧产物的衍射峰位置与原顽火辉石(JCPDS No.11-273)一致,没有顽火辉石相或斜顽火辉石相,是纯净物的晶态物相,物相与硅镁型红土镍矿中MgSiO3物相一致。
MgSiO3在不同温度时的拉曼光谱如图3所示。由图 3可知,MgSiO3拉曼振动谱峰主要集中在 200~1200 cm-1之间。其中1040 cm-1、1063 cm-1属于桥氧键 Si—Obr—Si伸缩振动,880 cm-1、853 cm-1属于非桥氧键Si—Onb的对称伸缩振动;695 cm-1、717 cm-1属于桥氧键Si—Obr—Si的对称伸缩振动;400 cm-1以下振动谱带是由阳离子参与的大骨架振动引起的[16]。谱图中两个最强谱峰1063 cm-1、1040 cm-1处的振动峰是由于硅氧四面体中二聚体状结构(Q1)、链状结构(Q2)、层状结构(Q3)伸缩振动引起的[17],但图中未显示Q1结构的特征峰(900 cm-1)和 Q3结构的特征峰(1100 cm-1),表明MgSiO3是具有Q2结构链状的硅酸盐。从图3还可以看出,随着焙烧温度的升高,由于声子间相互作用增强,致使拉曼谱带逐渐宽化。
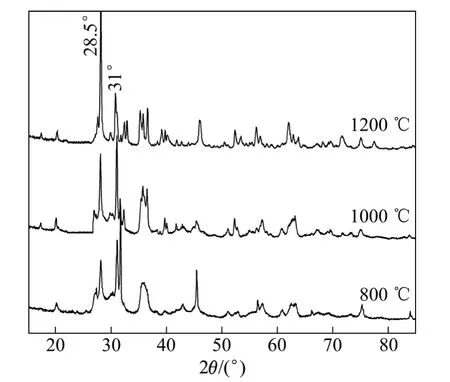
图2 MgSiO3前驱体经不同温度煅烧3 h产物的XRD谱Fig. 2 XRD patterns of MgSiO3 percursor calcined under different reaction temperatures for 3 h
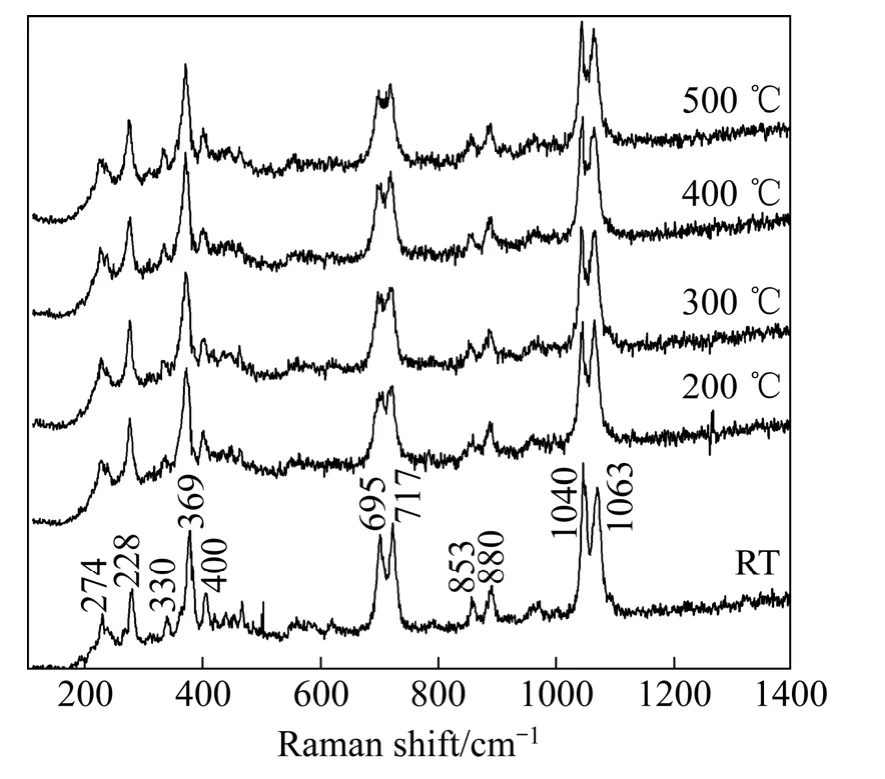
图3 MgSiO3在不同温度下的拉曼光谱Fig. 3 Raman spectra of MgSiO3 at different reaction temperatures
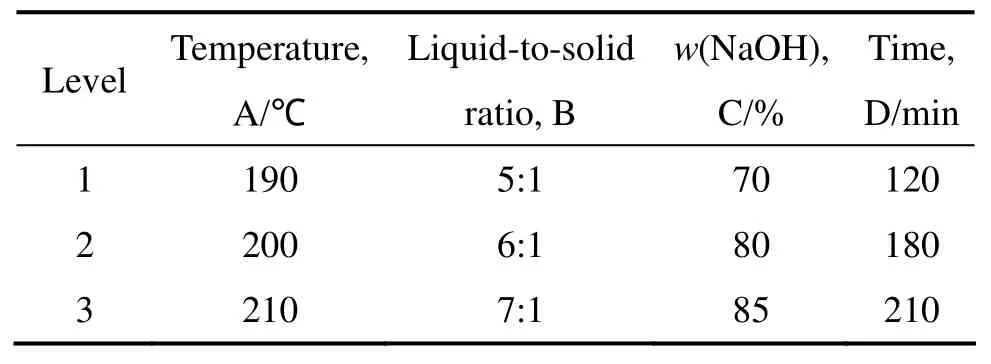
表1 正交因素水平表Table 1 Orthoganal levels factors
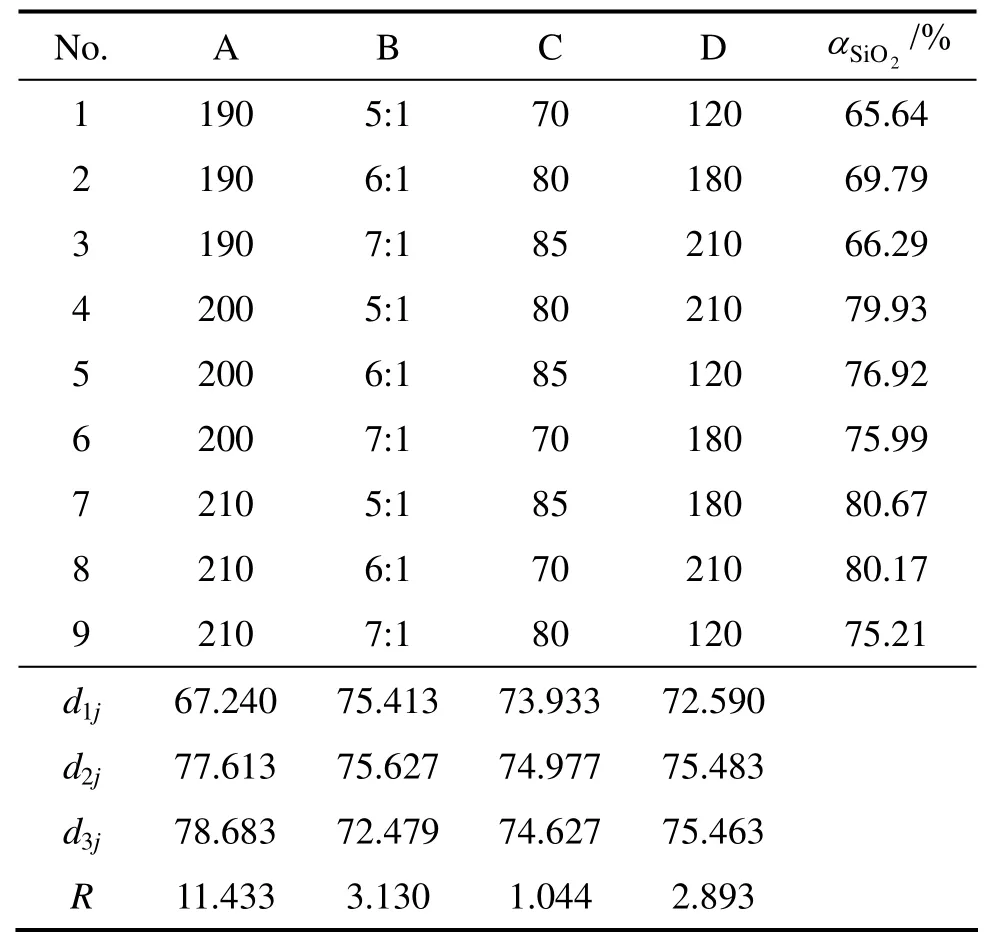
表2 正交实验结果与分析Table 2 Results and analysis of orthogonal experiments
2.2 正交实验结果与分析
在探索性实验研究的基础上,采用正交表 L9(34)设计实验,研究各影响因素同时作用时,确定MgSiO3在NaOH亚熔盐体系中反应过程的优化实验条件。各因素和水平见表1(表中dij(i,j=1,2,3)表示各因素每水平的平均值,R为极差),正交实验结果见表2。
以SiO2浸出率为评价指标进行正交实验,实验结果如表2所列。采取极差法对正交实验结果进行统计分析,由极差R可知:1) 在各因素选定的范围内,影响MgSiO3在NaOH亚熔盐体系中的反应过程因素为反应温度的影响最为显著,其次是液固比、反应时间和NaOH浓度;2) MgSiO3在NaOH亚熔盐体系中优化实验条件:反应温度为210 ℃,反应时间为180 min,液固比为6:1,NaOH浓度为80%。
在优化实验条件下即反应温度为210 ℃、反应时间为180 min、液固比为6:1、NaOH浓度为80%时进行实验,SiO2浸出率为92.2%,在此反应条件进行多次验证,SiO2浸出率稳定在92%左右。
2.3 反应机理分析
2.3.1 MgSiO3在NaOH亚熔盐体系水浸渣的XRD分析
在优化实验条件下,MgSiO3在 NaOH亚熔盐体系中反应不同时间水浸渣的XRD谱如图4所示。由图 4可知,水浸渣的物相组成复杂,主要成分有Mg2SiO4、Na2MgSiO4和 Mg(OH)2。由于水浸渣经过水浸、离心步骤,反应生成的 Na4SiO4或 Na2SiO3易溶于水而进入液相,因此,水浸渣的 XRD谱中不存在Na4SiO4和Na2SiO3的衍射峰。
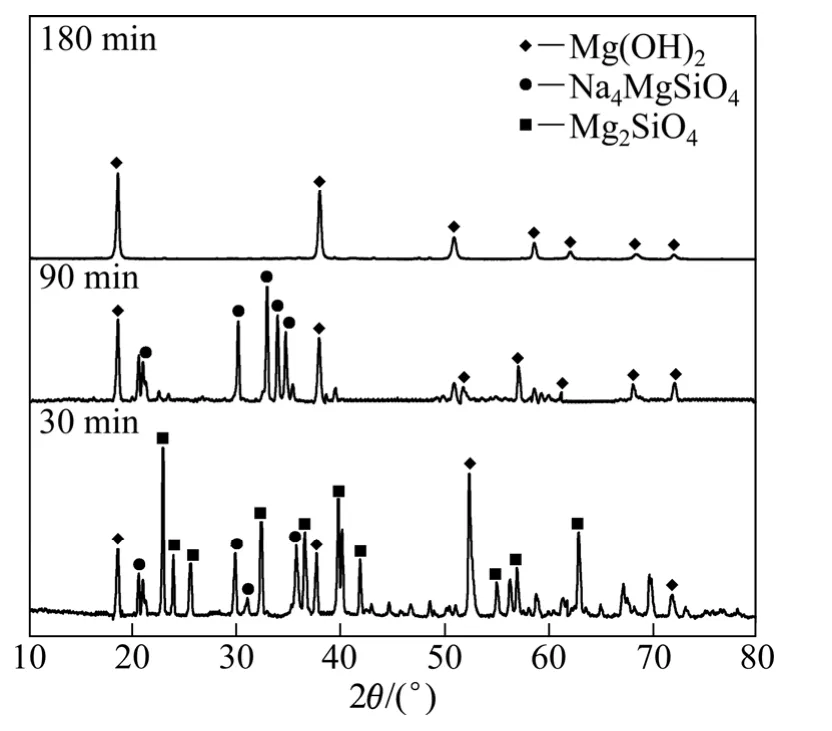
图4 不同反应时间得到浸出反应渣的XRD谱Fig. 4 XRD patterns of residue produced by alkaline leaching under different reaction times
由图4还可以看出,渣中有岛状结构的Mg2SiO4、Na2MgSiO4中间产物,说明在反应过程中硅酸盐结构发生变化,随反应时间的延长,Mg2SiO4、Na2MgSiO4与 NaOH 继续反应,Mg2+完全被 Na+替代,生成Na4SiO4经水洗进入液相,产物 Mg(OH)2不溶于水进入渣相。根据XRD结果可以推测,MgSiO3在NaOH亚熔盐液体系中的浸出过程反应方程式为
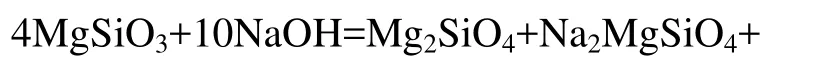
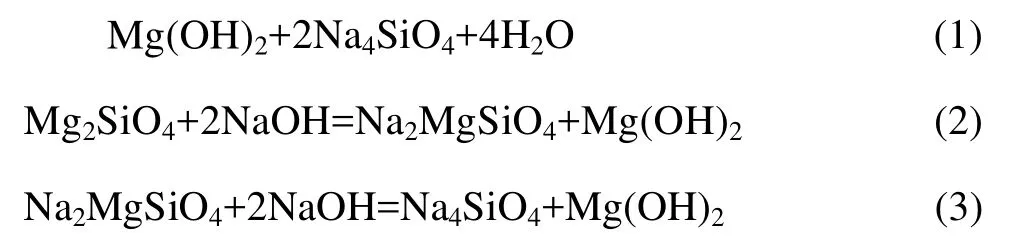
2.3.2 MgSiO3在NaOH亚熔盐体系水浸渣的IR分析
在优化实验条件下,不同碱矿比时 MgSiO3在NaOH亚熔盐体系水浸渣的IR谱以及室温下MgSiO3和Mg(OH)2的IR图如图5所示。由图5可知,MgSiO3反应前后红外谱图发生明显变化,波长范围为1100~800 cm-1、750~550 cm-1和500 cm-1以下3个较强的吸收峰消失。其中 3426 cm-1属于吸附水中的O—H伸缩振动峰,1631 cm-1属于吸附水中的O—H弯曲振动峰[18-19]。3695 cm-1属于Mg(OH)2中OH伸缩振动,1441 cm-1属于Mg—OH键的弯曲振动,与文献[20]中 Mg(OH)2的红外光谱一致。结合 XRD结果,再次确认渣相为Mg(OH)2。
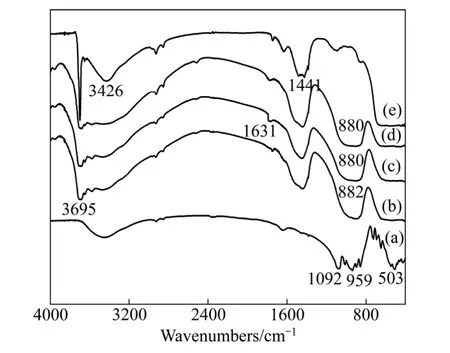
图5 不同液固比时浸出反应渣的IR谱Fig. 5 IR spectra of residue produced by alkaline leaching under different mass ratios of alkali-to-ore: (a) Pure MgSiO3;(b) Liquid-to-solid ratio 4:1; (c) Liquid-to-solid ratio 5:1;(d) Liquid-to-solid ratio 6:1; (e) Pure Mg(OH)2
由图5还可以看出,随着液固比的增加,反应趋于完全,MgSiO3中振动吸收峰向低频 800~900 cm-1方向移动,并且在880 cm-1附近出现的吸收峰,结合XRD结果可知,主要是由非桥氧键Si—Onb的伸缩振动引起的[21],即 MgSiO3中硅氧四面体的链接方式由链状结构向岛状结构转变。另外,水浸渣表现出明显的Mg(OH)2特征,进而推断MgSiO3经过碱浸处理后,结构中的 Mg2+离子可以与 NaOH中 Na+离子进行交换,脱离其原有的硅酸盐阵列。
2.4 MgSiO3在NaOH亚熔盐体系Raman光谱分析
在优化实验条件下,MgSiO3在 NaOH亚熔盐体系反应不同时间时的拉曼光谱图以及室温时NaOH和MgSiO3混合体系拉曼光谱图如图6所示。由图6可知,1074 cm-1、3569 cm-1和3633 cm-1属于NaOH溶液的特征峰[22];1040 cm-1属于MgSiO3的特征峰。体系中NaOH 对MgSiO3中SiO4链状振动峰有明显的遮蔽效应,一些 MgSiO3的特征峰在此温度下无法观测到,为了更直观的分析谱图,把波数在 0~1200 cm-1和3000~4000 cm-1范围局部放大。
由波数在200~1200 cm-1范围局部放大图可见,随着反应时间的延长,MgSiO3在1000~1100 cm-1间链状硅酸盐的特征峰向低频移动且谱峰强度减弱,400 cm-1以下反映固态时长程有序的大骨架振动也逐渐消失,说明与SiO4结合的阳离子发生改变,体系向着无序化转变。反应前15 min时,谱图在965 cm-1处出现Si—O的非桥氧键对称性伸缩振动峰,在 1062 cm-1出现桥氧键伸缩振动峰,说明体系中硅氧四面体结构发生转变。当反应至 30 min时,854 cm-1附近出现Mg2SiO4中岛状结构(Q0)的对称伸缩振动特征谱峰[23],这由于随着反应时间的延长,NaOH破坏 MgSiO3中硅氧四面体结构,使桥氧键(Si—O—Si)断开变成非桥氧(Si—O-),MgSiO3链状结构(Q2)到 Mg2SiO4岛状结构(Q0)的转化。桥氧键在NaOH作用下发生断裂,主要是由于Na—O键的键强比Si—O键弱得多,Si4+能把Na—O上的O2-离子拉在自己周围,O和Si的摩尔比增加,硅氧四面体间的聚合程度降低,由链状变成岛状。同时发现,NaOH在1074 cm-1处OH-振动峰强度随着反应的进行移至低频1070 cm-1处。
由波数在3000~4000 cm-1范围局部放大图可见,3633 cm-1处NaOH溶液OH-的伸缩振动峰逐渐向低频移动至3620 cm-1处,Mg2+经过碱熔融过程可以脱离SiO4阵列,在3640 cm-1处以Mg(OH)2形式从其硅酸盐中得以释放。
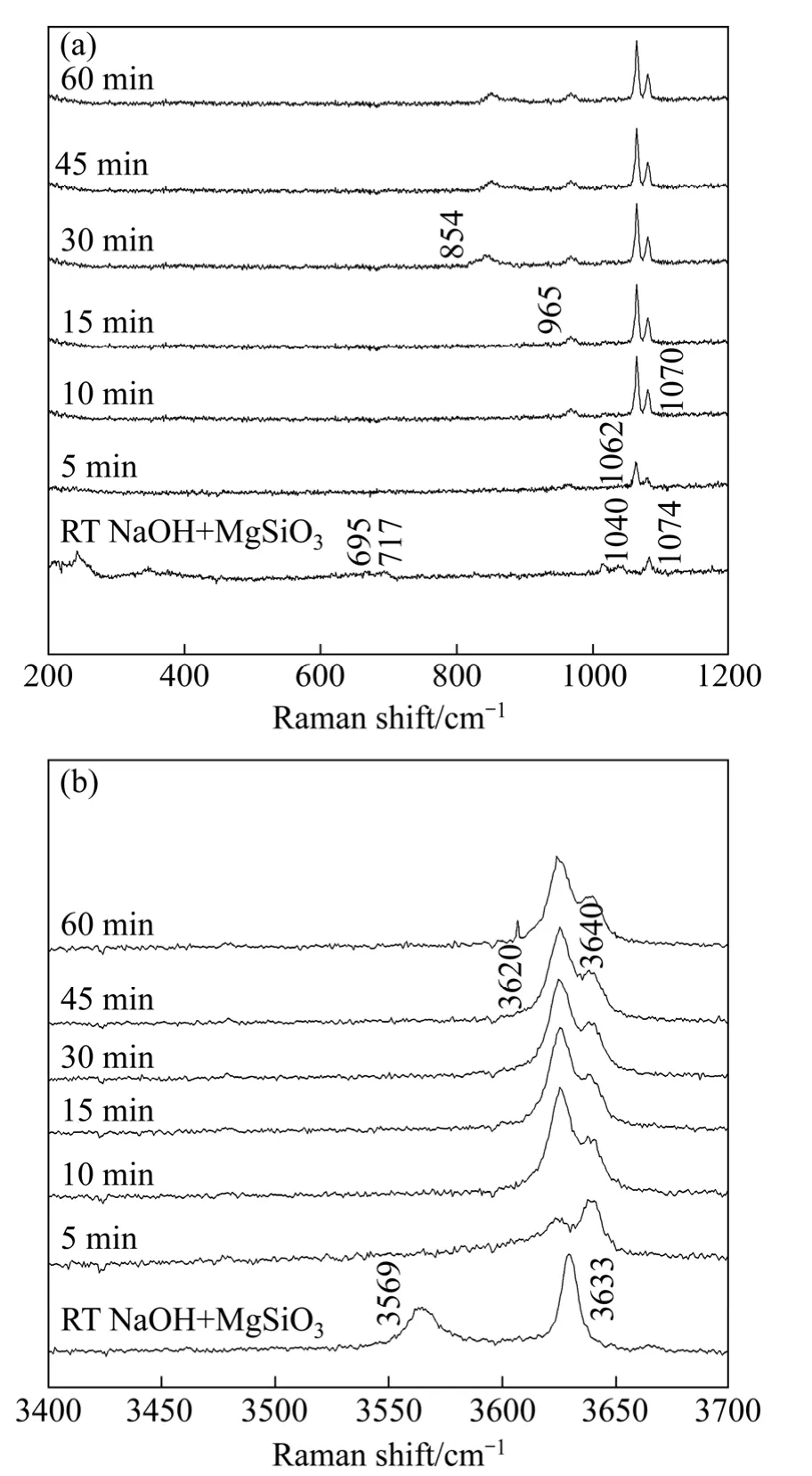
图6 MgSiO3在NaOH亚熔盐体系中随时间变化的Raman光谱Fig. 6 Raman spectra of MgSiO3 in NaOH sub-molten salt system after different reaction times
3 结论
1) 以 Na2SiO3·9H2O 和 Mg(NO3)2·6H2O 为原料,采用化学沉淀法合成的MgSiO3具有Q2结构链状的硅酸盐。通过正交试验得到MgSiO3在NaOH亚熔盐体系中优化实验条件:反应温度210 ℃,反应时间180 min,液固比6:1,NaOH浓度80%。
2) 在优化实验基础上,利用XRD和IR分析反应后的水浸渣结构分析表明:MgSiO3在反应过程中结构发生变化,由链状结构变向岛状结构转变,有中间产物 Mg2SiO4、Na2MgSiO4形成,同时,Na+逐步替代Mg2+与硅氧四面体结合;对反应过程的拉曼光谱在线分析显示:在反应过程中,SiO4中的Si—O被破坏,NaOH介入硅酸盐晶格中,Mg2+经过碱浸过程可以脱离 SiO4阵列,以 Mg(OH)2形式从其硅酸盐中得以释放。
[1] PICKLES C A. Microwave heating behaviour of nickeliferous limonitic laterite ores[J]. Minerals Engineering, 2004, 17(6):775-784.
[2] 赵 艳, 彭 犇, 郭 敏, 张 梅. 红土镍矿微波水热法浸提镍钴[J]. 北京科技大学学报, 2012, 34(6): 632-638.ZHAO Yan, PENG Ben, GUO Min, ZHANG Mei. Extraction of nickel and cobalt from laterite using a microwave assisted hydro-thermal leaching method[J]. Journal of University of Science and Technology Beijing, 2012, 34(6): 632-638.
[3] 冉启胜, 朱淑桢. 红土型镍矿地质特征及分布规律[J]. 矿业工程, 2010, 8(3): 16-17.RAN Qi-sheng, ZHU Shu-zhen. Geological properties and distribution regularity of red-soil type nickel ore[J]. Mining Engineering, 2010, 8(3): 16-17.
[4] KOTZS I J. Pilot plant production of ferronickel from nickel oxide ore sand dusts in a DC are furnace[J]. Minerals Engineering, 2002, 15(11): 1017-1022.
[5] 李光辉, 饶明军, 姜 涛, 史唐明, 黄晴晴. 红土镍矿钠盐还原焙烧-磁选的机理[J]. 中国有色金属学报, 2012, 22(1):274-280.LI Guang-hui, RAO Ming-jun, JIANG Tao, SHI Tang-ming,HUANG Qing-qing. Reduction roasting-magnetic separation mechanisms of nickeliferous laterite ore in presence of sodium salts[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(1):274-280.
[6] PURWANTO T, SHIMADA T, TAKAHASHI R. Recovery of nickel from selectively reduced laterite ore by sulphuric acid leaching[J]. ISIJ International, 2003, 43(2): 181-186.
[7] ZHU De-qing, CUI Yu, SARATH H, KEITH V, PAN Jian.Mineralogy and crystal chemistry of a low grade nickel laterite ore[J]. Transactions of Nonferrous Metals Society of China,2012, 22(4): 907-916.
[8] OLANIPEKUN E O. Kinetics of leaching laterite[J].International Journal of Mineral Processing, 2000, 60(1): 9-14.
[9] ZHU D Q, CUI Y, VINING K, HAPUGODA S, DOUGLAS J,PAN J, ZHENG G L. Upgrading low nickel content laterite ores using selective reduction followed by magnetic separation[J].International Journal of Mineral Processing, 2012, 106/109: 1-7.[10] JUNGAH K, GJERGJ D, HIDEAKT T, KATSUNORI O, SEIJI M, TOYOHISA F. Calcination of low-grade laterite for concentration of Ni by magnetic separation[J]. Minerals Engineering, 2010, 23(4): 282-288.
[11] LIU W W, LI X H, HU Q Y, WANG Z X, GU K Z, LI J H,ZHANG L X. Pretreatment study on chloridizing segregation and magnetic separation of low-grade nickel laterites[J].Transactions of Nonferrous Metals Society of China, 2010, 20(1):82-86.
[12] 李光辉, 饶明军, 姜 涛, 黄晴晴, 史唐明, 张元波. 红土镍矿还原焙烧-磁选制取镍铁合金原料的新工艺[J]. 中国有色金属学报, 2011, 21(12): 3137-3142.LI Guang-hui, RAO Ming-jun, JIANG Tao, HUANG Qing-qing,SHI Tang-ming, ZHANG Yuan-bo. Innovative process for preparing ferronickel materials from laterite ore by reduction roasting-magnetic separation[J]. The Chinese Journal of Nonferrous Metals, 2011, 21(12): 3137-3142.
[13] 刘 岩, 张 霞, 申晓毅, 翟玉春, 徐 冬. 红土镍矿有价元素高附加值利用的绿色冶金工艺(Ⅰ)熔融碱法提硅制备白炭黑[J]. 化工学报, 2008, 59(10): 2687-2691.LIU Yan, ZHANG Xia, SHEN Xiao-yi, ZHAI Yu-chun, XU Dong. Technology research on green metallurgy of high added value utilization of valuable elements in laterite nickel ore (Ⅰ)Preparation of silica white using molten NaOH extracting silicon method[J]. Journal of Chemical Industry and Engineering, 2008,59(10): 2687-2691.
[14] 赵昌明, 翟玉春. 高含量 NaOH体系中 Mg2SiO4的浸出机理[J]. 中国有色金属学报, 2013, 23(5): 1764-1767.ZHAO Chang-ming, ZHAI Yu-chun. Leaching behavior mechanism of Mg2SiO4in high NaOH content system[J]. The Chinese Journal of Nonferrous Metals, 2013, 23(5): 1764-1767.
[15] ANDRÉ D. Aqueous syntheses of forsterite (MgSiO4) and enstatite (MgSiO3)[J]. Journal of Sol-Gel Science and Technology, 2002, 24(3): 221-228.
[16] 尤静林, 蒋国昌, 徐匡迪. 二硅酸钠晶体、玻璃及其熔体结构的拉曼光谱研究[J]. 光谱学与光谱分析, 2000, 20(6): 797-799.YOU Jing-lin, JIANG Guo-chang, XU Kuang-di. High temperature Raman spectroscopic study of the structure of sodium disilicate crystal, glass and its melt[J]. Spectroscopy and Spectral Analysis, 2000, 20(6): 797-799.
[17] MYSEN B O, FRANTZ J D. Raman spectroscopy of silicate melts at magmatic temperatures: Na2O-SiO2, K2O-SiO2and Li2O-1bSiO2binary compositions in the temperature range 25-1475 ℃[J]. Chemical Geology, 1992, 96(3/4): 321-332.
[18] 王 蓉, 张保民. 辉石是拉曼光谱[J]. 光谱学与光谱分析,2010, 30(4): 1529-1538.WANG Rong, ZHANG Bao-min. Raman spectra of pyroxene[J].Spectroscopy and Spectral Analysis, 2010, 30(4):1529-1538.
[19] 张宪玺, 王晓娟, 翟冠杰, 姜建壮. 碱式碳酸锌煅烧制备纳米氧化锌[J]. 无机化学学报, 2002, 18(10): 1037-1041.ZHANG Xian-xi, WANG Xiao-juan, ZHAI Guan-jie, JIANG Jian-zhuang. Nanometer ZnO preparation through basic zinc carbonate calcinations[J]. Chinese Journal of Inorganic Chemistry, 2002, 18(10): 1037-1041.
[20] WU X, HUA G, WANG B. Synthesis and characterization of superf i ne magnesium hydroxide with monodispersity[J]. Journal of Crystal Growth, 2008, 310(2): 457-461.
[21] ŚRODA M, PALUSZKIEWICZ C.The structural role of alkaline earth ions in oxyfluoride aluminosilicate glasses-Infrared spectroscopy[J]. Vibrational Spectroscopy, 2008, 48(2):246-250.
[22] WALRAFEN G E, DOUGLASA R T W. Raman spectra from very concentrated aqueous NaOH and from wet and dry solid and anhydrous molten, LiOH, NaOH, and KOH[J]. The Journal of Chemical Physics, 2006, 124(1): 114504-114518.
[23] 徐 敏, 许 茜, 刘日强, 王子睿, 翟玉春. 熔融 NaOH 分解橄榄石型硅酸盐的反应机理[J]. 中国有色金属学报, 2012,22(4): 1248-1254.XU Min, XU Qian, LIU Ri-qiang, WANG Zi-rui, ZHAI Yu-chun.Reaction mechanisms of decomposition of magnesium nickel silicate by alkali fusion using NaOH[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(4): 1248-1254.
