基于局部一致性方法的高学术成就者脑静息态功能磁共振研究
2015-03-25李文福
李文福
(济宁医学院精神卫生学院,山东 济宁272067)
创造力或者创造性是人类文明的基石和经济社会发展的动力[1]。鉴于创造性对于人类社会发展的极端重要性,创造性思维的神经机制已然成为行为和脑科学研究工作的重要主题之一。随着认知神经科学的发展,静息状态功能核磁共振成像(resting-state functional magnetic resonance ima-ging,rs-fMRI)技术为探索人类行为的认知神经机制提供了技术支持,为揭示创造性的脑机制提供了全新的视角。
研究者借助研究天才人物的大脑特点来探索创造性的神经机制。比如对爱因斯坦的大脑进行的研究[2-5],发现在前额叶皮层、初级感觉运动皮层、运动皮层以及顶叶皮层等区域异于普通对照组。但此类基于单个被试的研究结果的外部效度受到诟病[2,4]。高校中不乏取得卓著学术成就的科研人员,这一群体是科学研究的重要推动者,对于科技创新和社会发展具有重要推动作用,对获得高低不同学术成就高校教师的大脑差异进行研究,或许可以弥补个案研究的不足,从而尽早摸清创造性的本质。静息态脑成像反映的是大脑在静息状态下的自发活动情况,最近该技术已经被应用于创造性脑机制的有关研究中。局部一致性(regional homogeneity,ReHo)是由杭州师范大学臧玉峰团队提出的一种反映大脑自发活动的指标[6]。该参数是指一个体素与其周围相邻体素的时间序列的相关,反映了大脑局部区域内神经元活动的一致性情况。研究表明ReHo可以反映个体认知能力差异的神经基础。比如有研究发现ReHo反映了个体在反应抑制能力上的差异[7],还有研究表明Re-Ho可以预测个体在智力水平上的差异[8]。但到目前为止还缺乏创造性的脑局部活动一致性情况的研究。研究大脑局部脑区的功能活动一致性情况有助于解释创造性的大脑机制,并进一步理解创造性的本质。本文应用静息态功能磁共振成像技术,采用ReHo的分析方法,研究高校获取过不同学术成就的科研人员在大脑自发活动上的差异。
1 资料与方法
1.1 被试
我们首先从西部某高校具有二级教授职称的教师中选取具有较高学术成就者作为研究被试,由于条件限制,先后纳入11名高学术成就被试,平均年龄为(55.5±8.1)岁,平均受教育年限为(20.1±2.4)a。另外随机选取11名在年龄和受教育年限上匹配的控制组被试,平均年龄为(52.1±9.6)岁,平均受教育年限为(18.1±4.0)a。由于参与实验的高学术成就被试均为男性,因此控制组被试也皆为男性。最后共22名被试参加了本次实验,所有被试皆为右利手,无神经心理问题或疾病史,无脑外伤经历。实验前告知所有受试者该研究的研究过程和研究细节,被试知情了解后自愿签订知情同意书。该研究所有试验程序和处理皆通过了学术伦理委员会的审查。
本文高学术成就被试是指那些比其他老师发表了更多的SCI(science citation index)检索论文以及更多的CNKI(Chinese national knowledge infrastructure)检索论文,并获得了更多奖励和荣誉的人。另外这些被试也主持过更多的国家级研究项目和省部级研究项目。控制组被试在发表文章数量、获得的奖励和主持的项目方面都显著少于高学术成就组被试。
1.2 静息态数据采集
静息态数据采用3.0T西门子磁共振成像仪(Siemens Medical,Erlangen,Germany)获得。实验开始前让被试换上实验室专用扫描服装,以避免衣服上的金属物体对被试安全和成像质量的影响,同时取下被试佩戴的金属首饰或假牙等。告知被试在整个扫描过程中头不要动,闭眼休息[9]。采用专用耳塞降低仪器噪音的干扰,并采用块状泡沫固定被试头部以减少头动。数据应用回波平面成像(Echo-Planar Imaging,EPI)序列获得,参数为:层数=32,重复时间(repetition time,TR)=2000毫秒(ms),回波时间(echo time,TE)=30ms,反转角(flip angle)=90°,视野(field of view,FOV)=220mm×220mm,层厚(slice thickness)=3mm,层间距(slice gap)=1mm,矩阵(matrix)=64×64,体素大小为(voxel size)=3.4×3.4×4mm3。扫描总时间为8min4s,共获得242个时间点的连续图像。
1.3 静息态数据预处理
静息态数据使用基于Matlab平台的DPARSF软件(data processing assistant for resting-state fMRI software;http://www.restfmri.net/forum/DPARSF)[10]进行预处理以得到每个体素的ReHo值。具体流程包括:检查每个被试的数据质量,剔除扫描不全或者伪影的被试数据;将原始DICOM数据转换为NIFTI数据格式;为了避免磁共振信号开机时的不稳定和被试刚刚进入扫描仪的不适应带来的影响,删除前十个时间点采集的数据;所有剩余的232个时间点的图像进行时间层校正、头动校正并标准化到MNI标准空间,标准化后的体素大小是3mm×3mm×3mm,删除头动大于3mm和3°的被试数据;对数据进行滤波(0.01~0.08Hz)和去线形漂移;最后计算每个体素的ReHo值,该参数应用肯德尔和谐系数计算一个体素和周围其他体素的时间序列的相似性[6]。
1.4 统计学方法
所有被试的行为数据采用SPSS 13.0进行统计处理和分析。采用SPM8(statistical parametric mapping software;http://www.fil.ion.ucl.ac.uk/spm)中的双样本t检验探索高学术成就组被试和控制组被试在大脑自发活动ReHo上的差异。同时将年龄、受教育年限作为无关变量加以控制。
为了排除数据分析过程中多重比较带来的影响,脑影像数据的结果应用REST软件包(http://www.restfmri.net)[11]中的 AlphaSim 程序进行多重比较校正,该方法使用蒙特卡洛模拟的方法控制多重比较校正中发生错误的概率。将体素水平的阈值设置为P<0.01,平滑核设置为8mm,进行5000次模拟,从而得到P<0.05的校正水平,此时最小团块大于80个体素(2160mm3)。
2 结果
2.1 行为数据结果
首先对年龄、受教育年限、SCI文章数目、CNKI文章数目、国家级项目数目和省部级项目数目进行独立样本t检验,结果发现:在年龄上,高学术成就组被试的平均年龄为(55.5±8.1)岁,控制组被试的平均年龄为(52.1±9.6)岁,两组之间无显著差异(P=0.174);在受教育年限上,高学术成就组被试的平均年限为(20.1±2.4)a,控制组被试的平均年限为(18.1±4.0)a,两组之间无显著差异(P=0.374);在SCI文章发表数量上,高学术成就组被试的平均篇数为(37.8±55.4)篇,控制组被试的平均篇数为(2.0±4.6)篇,高学术成就组被试的SCI文章数量现显著高于控制组被试的SCI文章数量(P=0.007);在CNKI文章发表数量上,高学术成就组被试的平均篇数为(112.5±108.9)篇,控制组被试的平均篇数为(11.8±16.5)篇,高学术成就组被试的CNKI文章数量显著高于控制组被试的CNKI文章数量(P=0.045);在国家级项目申请数量上,高学术成就组被试的平均项目数量为(4.0±2.9)项,控制组被试的平均项目数量为0项,高学术成就组被试获得的国家级项目数显著高于控制组被试获得的国家级项目数(P<0.001);在省部级项目申请数量上,高学术成就组被试的平均项目数量为(3.2±3.1)项,控制组被试的平均项目数量为(0.5±1.2)项,高学术成就组被试获得的省部级项目数显著高于控制组被试获得的省部级项目数(P<0.018)。见表1。
2.2 脑影像数据结果
对高学术成就组和控制组被试进行双样本t检验,同时将被试年龄和受教育年限作为协变量进行控制,以排除可能的影响。结果发现高学术成就组被试比控制组被试ReHo升高的区域有:右侧海马和海马旁回,ReHo降低的区域有:右侧枕上回/楔片/楔前叶、左侧中央前后回和右侧中央前后回。见表2、图1。
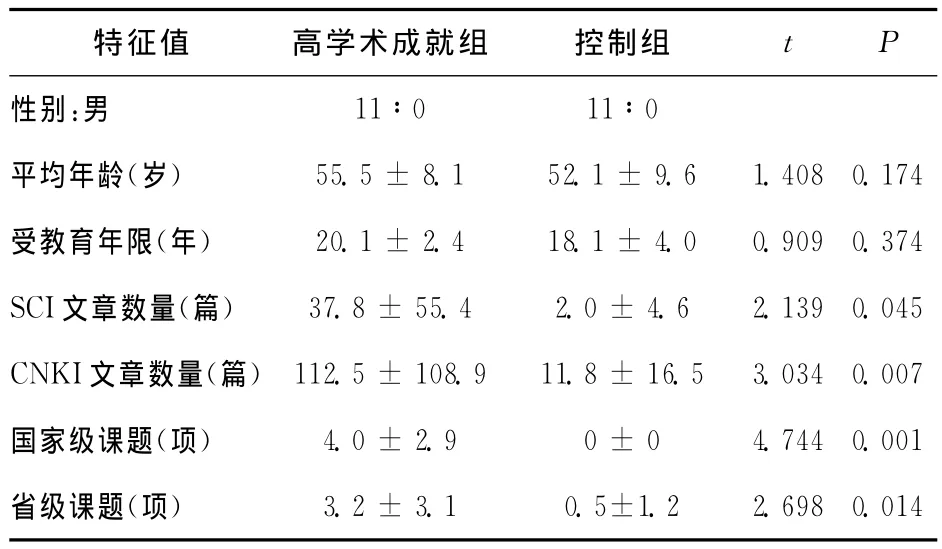
表1 高学术成就组被试和控制组被试的人口统计学特征

表2 高学术成就组与控制组ReHo值差异的脑区
3 讨论
本研究应用静息态功能磁共振成像技术,选取具有较高学术成就的大学教授作为被试,采用反应大脑局部活动一致性的ReHo值作为指标,发现高学术成就组被试与控制组被试相比,在右侧海马和海马旁回区域的ReHo值升高,而在右侧枕上回/楔片/楔前叶、左侧中央前后回和右侧中央前后回区域的ReHo值降低。
有关海马在创造性思维过程中的作用的证据首先来自Luo等[12]的研究,研究者要求被试解决类似“你打死了它却流你自己的血”的谜语,并提供谜底以促发被试的顿悟反应,结果发现顿悟激活了右侧海马。Duff等[13]在研究中使用托兰斯创造性测验的言语和图画分量表测量被试的创造性思维能力,选择海马受到损伤的被试和健康控制组被试作为研究对象,发现海马受损的被试在图画和言语量表上的成绩显著低于控制组被试,表明海马在创造性思维过程中的关键作用。Chavez等[14]在研究中发现当被试在完成图画和言语创造性任务时,右 侧海马旁回的脑血流量和被试的创造性任务上的成绩正相关。本研究中,高学术成就者比普通控制组被试在海马上的ReHo值升高,可能反映了在科学研究过程中,如果想要获得较高学术成就,就必须依赖于创造性的问题发现或者问题解决能力,从而可以达成比其他人更高的学术成就,发表更多的学术论文和受到更多的研究项目的资助,而这种行为上的表现就反映在右侧海马较高的ReHo值上。

图1 高学术成就组与控制组ReHo值差异的脑区
另外,我们发现高学术成就组被试在右侧楔前叶和左右侧中央前回/后回上的ReHo值显著低于控制组被试。左右侧中央前回/后回是顶叶的主要结构,负责触觉的感知,双侧中央前后回降低的ReHo值可能和降低的触觉信息加工敏感度有关,这种敏感度的降低,使个体较少受到外界信息的干扰,更多地专注于对外界信息的内部加工,从而得到更有创造性的想法。高学术成就者在处理外界信息的时候可能更倾向于依赖内部思维而不是外界感觉印象,从而得出独特于他人的创造性结果,获得更高的学术成就。以往研究表明楔前叶和目标导向的信息加工有关[15],并且涉及个体不断收集更新周围世界以及自身的信息[16]。Takeuchi等[17]在研究中发现个体的发散思维能力和楔前叶的局部脑血流量显著负相关。Zhang等[18]在研究中也发现个体感知新颖物体和感知常规物体相比更多地激活了楔前叶,可能表明楔前叶和整合新颖物体的非常规特征有关。本研究中,个体为了获得更高的学术成就,就要摒除外界多余信息的干扰,更多依赖对内部信息的加工,在加工的过程中,将常规事物的某些特征相结合,形成新颖事物并保持对这种新颖物体的敏感性,从而获得高于普通控制组的学术成就,这些成就表现在发表更多的学术论文和获得更多的项目资助上。
由于种种条件限制,研究还存在一定局限性。如样本容量较小,没能纳入更多学校的高学术成就人员作为被试;没能使用创造性问卷测量被试的创造性水平,为研究提供辅助数据支持;研究中的所有被试均为男性,没能纳入女性被试等。由此在结果的推广和解释方面受到限制。
总之,本研究应用局部一致性(ReHo)的分析方法,对高低学术成就者在静息状态下的大脑自发活动进行了研究,发现高学术成就者右侧海马的ReHo值增强,右侧楔前叶和左右侧中央前回/后回的ReHo值降低。研究表明个体获得的学术成就与静息状态下的大脑自发活动有关,研究结果为进一步说明高低不同学术成就者的生理差异提供了数据支持。未来可以开展包含更多被试的纵向跟踪研究,从而回答脑生理变化和学术成就高低之间的先后因果关系,对于提高国家科学研究水平,建设创新型国家具有重要意义。
[1] Dietrich A,Kanso R.A review of EEG,ERP,and neuroimaging studies of creativity and insight[J].Psychol Bull,2010,136(5):822-848.
[2] Anderson B,Harvey T.Alterations in cortical thickness and neuronal density in the frontal cortex of Albert Einstein[J].Neurosci Lett,1996,210(3):161-164.
[3] Witelson S F,Kigar D L,Harvey T.The exceptional brain of Albert Einstein[J].Lancet,1999,353(9170):2149-2153.
[4] Falk D.New Information about Albert Einstein's Brain[J].Front Evol Neurosci,2009,1:3.
[5] Amunts K,Schleicher A,Zilles K .Outstanding language competence and cytoarchitecture in Broca's speech region[J].Brain Lang,2004,89(2):346-353.
[6] Zang Y,Jiang T,Lu Y,et al.Regional homogeneity approach to fMRI data analysis[J].NeuroImage,2004,22(1):394-400.
[7] Tian L,Ren J,Zang Y.Regional homogeneity of resting state fMRI signals predicts Stop signal task performance[J].NeuroImage,2012,60(1):539-544.
[8] Wang L,Song M,Jiang T,et al.Regional homogeneity of the resting-state brain activity correlates with individual intelligence[J].Neurosci Lett,2011,488(3):275-278.
[9] Wang Z,Yan C,Zhao C,et al.Spatial patterns of intrinsic brain activity in mild cognitive impairment and alzheimer's disease:A resting‐state functional MRI study[J].Hum Brain Mapp,2011,32(10):1720-1740.
[10]Chao-Gan Y,Yu-Feng Z.DPARSF:a MATLAB toolbox for“pipeline”data analysis of resting-state fMRI[J].Front Syst Neurosci,2010,4:13.
[11]Song X W,Dong Z Y,Long X Y,et al.REST:a toolkit for resting-state functional magnetic resonance imaging data processing[J].PLoS One,2011,6(9):e25031.
[12]Luo J,Niki K.Function of hippocampus in“insight”of problem solving[J].Hippocampus,2003,13(3):316-323.
[13]Duff M C,Kurczek J,Rubin R,et al.Hippocampal amnesia disrupts creative thinking[J].Hippocampus,2013,23(12):1143-1149.
[14]Chavez R A,Graff Guerrero J C,Garcia Reyna,et al.Neurobiology of creativity:preliminary results from a brain activation study[J].Salud Mental,2004,27(3):38-46.
[15]Cavanna A E,Trimble M R.The precuneus:a review of its functional anatomy and behavioural correlates[J].Brain,2006,129(3):564-583.
[16]Raichle M E,MacLeod A M,Snyder A Z,et al.A default mode of brain function[J].Proc Natl Acad Sci USA,2001,98(2):676-682.
[17]Takeuchi H1,Taki Y,Hashizume H,et al.Cerebral Blood Flow during Rest Associates with General Intelligence and Creativity[J].PLoS One,2011,6(9):e25532.
[18]Zhang H,Liu J,Zhang Q.Neural Correlates of the Perception for Novel Objects[J].PLoS One,2013,8(4):e62979.
