液相色谱法同时测定维药蜀葵花中芦丁、槲皮素和山柰酚
2015-03-24木合塔尔5吐尔洪热萨莱提5伊敏楚刚辉尹学博木尼热5阿不都克里木
木合塔尔5吐尔洪, 热萨莱提5伊敏, 楚刚辉,尹学博, 木尼热5阿不都克里木
(1. 喀什大学化学与环境科学学院, 新疆 喀什 844006;2. 新疆特色药食用植物资源化学实验室, 新疆 喀什 844006)
研究论文
液相色谱法同时测定维药蜀葵花中芦丁、槲皮素和山柰酚
木合塔尔5吐尔洪1,2, 热萨莱提5伊敏1, 楚刚辉1,2,尹学博1,2, 木尼热5阿不都克里木2*
(1. 喀什大学化学与环境科学学院, 新疆 喀什 844006;2. 新疆特色药食用植物资源化学实验室, 新疆 喀什 844006)
维药是祖国医药学不可分割的组成部分。维药现代化,即利用现代技术研究维药的有效成分,是维药科学化、标准化、规范化、商品化和产业化的必经之路。本文建立了维药蜀葵花中有效成分芦丁、槲皮素和山柰酚的选择性提取方法,优化了高效液相色谱法(HPLC)同时测定这3种有效成分的分析条件。采用HC-C18色谱柱(250 mm×4.6 mm, 5 μm)和甲醇-0.4%磷酸(50∶50, v/v)流动相,在柱温30 ℃和流速1.00 mL/min的条件下实现了3种物质之间以及和干扰物之间的基线分离。维药蜀葵花中芦丁、槲皮素及山柰酚的线性范围分别为12.5~150 μg/mL (r=0.999 8), 12.5~125 μg/mL (r=0.999 9)及12.5~125 μg/mL (r=0.998 8),加标回收率(n=5)分别为100.3%(RSD=1.1%)、97.60%(RSD=0.47%)、97.75%(RSD=0.71%)。该方法实现了同时测定维药蜀葵花中芦丁、槲皮素及山柰酚,为其他黄酮类物质的开发应用提供了科学依据,同时也可为其他维药分析提供借鉴。
高效液相色谱法;芦丁;槲皮素;山柰酚;蜀葵花
维药是祖国医药学不可分割的组成部分,也是维吾尔族人民防病治病的物质基础。维吾尔族地区丰富的天然资源是维吾尔药材的丰富来源,而独特的气候条件和地域特点造就了独特的维药特点和品质。蜀葵(Althaearosea(L) Gavan)为锦葵科蜀葵属的植物,别名熟季花、戎葵、吴葵、卫足葵、胡葵、斗蓬花等,全草可入药[1-3]。蜀葵花为蜀葵的干花,是维吾尔族常用药材,《中华人民共和国卫生部药品标准-维吾尔药分册》和《维吾尔医常用药材》记载蜀葵花性质二级湿寒,能润肺止咳、发汗平喘、消肿透疹、安神益心,用于咳喘不止、小儿麻疹、便秘痔疮、汗出不畅[4,5]。蜀葵一次播种多年开花,在新疆广泛种植。蜀葵花资源丰富、在维吾尔族民间自古就有用蜀葵花外敷消肿的习惯。临床上蜀葵花的用途更为广泛,已用于眼皮炎肿、耳底炎、乳腺炎等各种炎症[6]。但目前国内外关于维吾尔药材蜀葵花的研究甚少。
维药现代化,即利用现代技术研究维药的有效成分,是维药科学化、标准化、规范化、商品化和产业化的必经之路,对维药的开发应用有重要的推动作用。蜀葵花中的主要有效化学成分为黄酮类化合物。冯育林等[7]从蜀葵花中分离得到芦丁等9个黄酮类化合物,张祎等[8]从蜀葵花中分离得到14种单体成分,勉强辉等[9,10]用高效液相色谱法测定维药蜀葵花中芦丁和紫云英苷的含量。本文报道了同时测定维药蜀葵花中芦丁、槲皮素、山柰酚的高效液相色谱方法,优化了选择性提取和含量测定的方法,希望为维药蜀葵花的质量控制、开发利用提供科学依据,同时为其他维药分析提供可供借鉴的分析技术和方法。
1 材料与方法
1.1 仪器
岛津LC-20AT高效液相色谱仪(配有SPD-M20A二极管阵列检测器、DGU-20A5在线脱气机、LC-solution工作站); KQ3200DE型超声波清洗器(昆山市超声仪器有限公司); XA-1型多功能粉碎机(江苏姜堰市分析仪器厂); ZK-82B真空干燥箱(上海市实验仪器总厂);赛多利斯BS224S型电子天平(德国)。
1.2 试剂
芦丁(批号:0080-9705,中国食品药品检定研究院);槲皮素(批号:100081,中国药品生物制品检定所);山柰酚对照品(批号:29029,中国药品生物制品检定所);甲醇、乙腈为色谱纯;水为高纯水;其他试剂均为分析纯。维吾尔药材蜀葵花是2013年7月购自喀什地区莎车县维吾尔医院生药库房的干燥花,经本学院生物与地理系司马义教授鉴定为锦葵科蜀葵属植物蜀葵(Althaearosea(L) Gavan)的干燥花。用粉碎机粉碎,过60目筛,装试剂瓶,室温保存备用。
1.3 对照品溶液的制备
分别准确称取真空干燥至恒重的芦丁、槲皮素及山柰酚对照品各5.0 mg于25 mL容量瓶中,用甲醇完全溶解,稀释并定容至刻度,摇匀,得200 μg/mL芦丁、槲皮素及山柰酚对照品标准溶液,在4 ℃冰箱里保存。使用时可以根据所需要的浓度混合并稀释。
混合标准溶液的配制:分别准确吸取不同体积芦丁、槲皮素及山柰酚标准储备液于7个10 mL容量瓶中,加甲醇至刻度,在4 ℃冰箱里保存。7组混合标准溶液的质量浓度范围分别为:芦丁(12.5~200 μg/mL)、槲皮素(12.5~150 μg/mL)、山柰酚(12.5~150 μg/mL)。
1.4 样品前处理
准确称取干燥、粉碎、过筛(60目)的蜀葵花粉末1.0 g,置于50 mL锥形瓶中,加75%(v/v)甲醇(25 mL)浸泡1 h,超声提取30 min,浸泡1 h,再超声30 min,抽滤除渣,50 ℃下旋转蒸发浓缩,放置至室温,用甲醇定容至25 mL,摇匀,用0.45 μm微孔滤膜过滤后进行HPLC分析。
1.5 色谱条件
色谱柱:Agilent HC-C18柱(250 mm×4.6 mm, 5 μm);流动相:甲醇/0.4%(v/v)磷酸(50∶50, v/v);流速:1.0 mL/min;检测波长:360 nm;柱温:30 ℃;进样量:10 μL。
1.6 系统适用性试验
分别吸取对照品混合标准溶液和供试溶液,按2.3节色谱条件进样10 μL,记录色谱图。
2 结果与讨论
2.1 提取方法及溶液的选择
根据参考文献[11-16]考察了75%(v/v)甲醇(或乙醇)索氏提取法、75%(v/v)甲醇(或乙醇)超声提取法、75%(v/v)甲醇(或乙醇)浸泡法(24 h)。结果表明,用75%(v/v)甲醇超声提取30 min,浸泡1 h,再超声提取30 min的方法,芦丁、槲皮素及山柰酚的提取率达到最高,而且超声提取操作简单易行,能耗较低,快速高效提取有助于保持3种目标物稳定。故选择这种方法提取蜀葵花中芦丁、槲皮素及山柰酚等有效成分。
2.2 色谱峰的确定
图1为标准品和提取液的色谱图。标准混合溶液中芦丁、槲皮素及山柰酚的保留时间分别为5.923、13.314、22.592 min,提取溶液中芦丁、槲皮素及山柰酚的保留时间分别为5.949、13.374、22.703 min。通过保留时间初步确定3个色谱峰的归属。为进一步验证色谱峰的归属,用二极管阵列检测器采集分析物的吸收光谱图。我们将3个物质对应色谱峰的光谱图和标准品的光谱图进行对比,各物质的特征吸收光谱峰的峰位基本吻合,两种光谱图的差异可能是由于溶剂及杂质的干扰以及二极管阵列检测器采样精度不足造成的(见图2)。因此,根据混合标准溶液和样品溶液中3个峰的保留时间,以及3个组分光谱峰位的吻合程度,可以证明色谱图中3个物质的归属。

图 2 (a)提取色谱峰和(b)对照品的紫外-可见吸收光谱图Fig. 2 UV-Vis absorption spectra of (a) chromatographic peaks and (b) standard samples

图 1 (a)混合对照品和(b)供试品的色谱图Fig. 1 Chromatograms of (a) mixed reference substances and (b) sample
2.3 检测波长的确定
二极管阵列检测器能够在一次运行中同时采集分析物的吸收光谱图和色谱图,为分析物的直接定性以及选择最佳波长奠定基础。采集200~400 nm的吸收光谱图,发现芦丁在255 nm和350 nm处、槲皮素在254 nm和370 nm处、山柰酚266 nm和366 nm处有最大吸收。兼顾芦丁、槲皮素、山柰酚的最大吸收波长,最终确定360 nm作为检测波长[17,18],保证每种分析物都有较高的灵敏度和较少的干扰,满足定量分析的要求。
2.4 流动相的选择
根据参考文献[19-24],我们考察了不同体积比的甲醇-乙酸、甲醇-0.1%(v/v)磷酸、甲醇-0.4%(v/v)磷酸、乙腈-磷酸溶液为流动相时,样品中各个有效成分的分离情况。如图1a所示,当体积比为50∶50的甲醇-0.4%(v/v)磷酸溶液作为流动相时,芦丁、槲皮素及山柰酚峰形良好,且达到基线分离。图1b是在优化的提取条件下提取液的色谱图,在此流动相条件下,3种分析物与其他杂质峰很好地分离。芦丁、槲皮素、山柰酚与相邻杂峰之间的分离度可分别达到1.438、1.244、4.11。因此,确定甲醇-0.4%磷酸(50∶50, v/v)为流动相。二极管阵列检测器检测到的吸收光谱信号也与标准物质基本一致,确认图1b中3种物质的出峰时间。同时,我们也根据保留时间判定提取液中是否含有3种分析物。图3为提取液的加标色谱图,进一步证明了3种物质的存在,并确认了它们的保留时间。
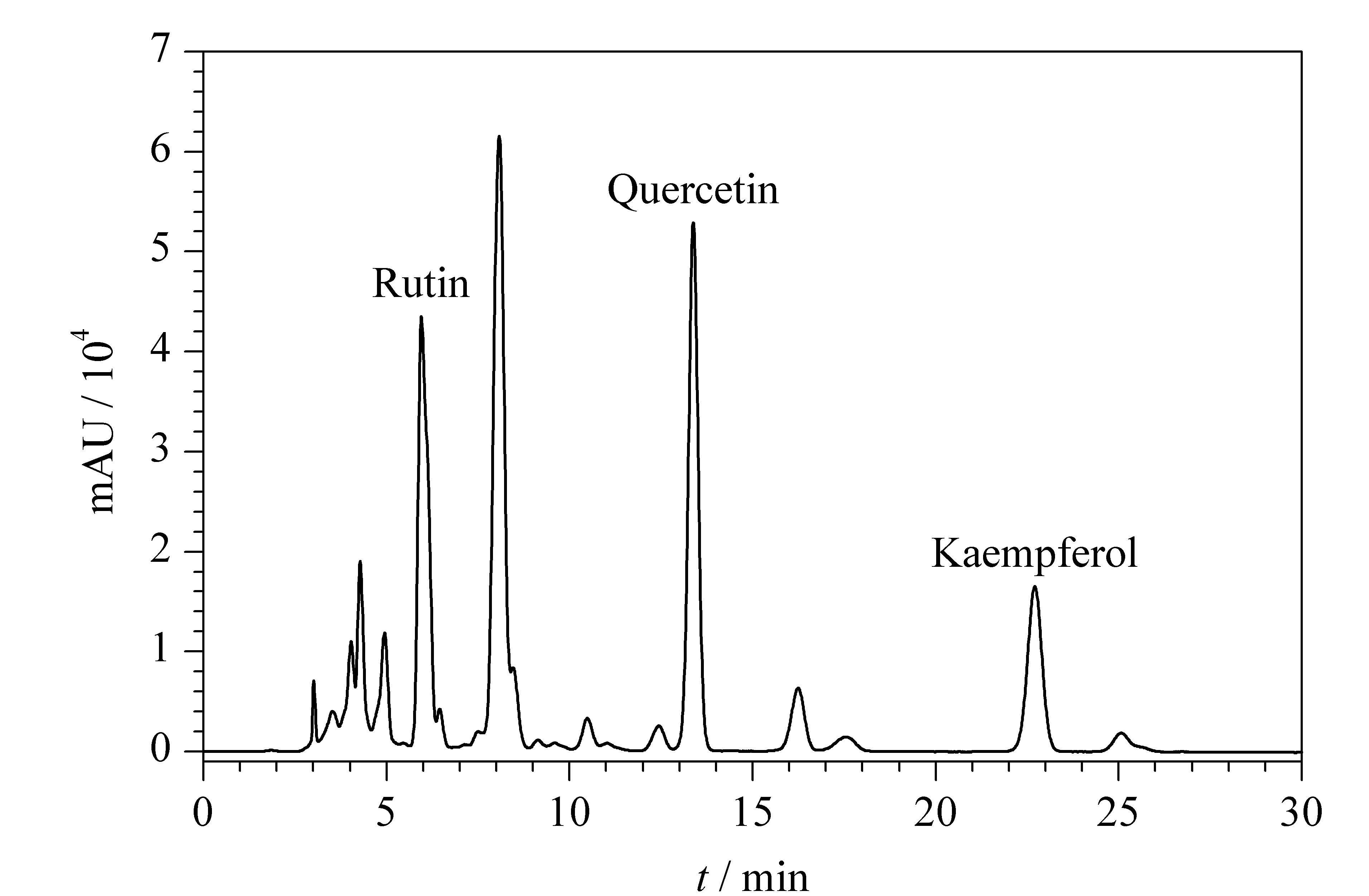
图 3 蜀葵花样品加标色谱图Fig. 3 Chromatogram of the spiked Althaea rosea (L) Gavan sample
2.5 标准曲线的绘制
取12.5、25、50、100、125、150 μg/mL的对照品溶液,重复进样(n=6),记录优化的色谱条件下的峰面积。以对照品的质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到芦丁、槲皮素、山柰酚的回归方程、相关系数(见表1)。
2.6 精密度试验
取混合对照品溶液,在优化的色谱条件下连续进样5次,芦丁、槲皮素、山柰酚峰面积的RSD分别为1.2%、1.4%、1.3% (n=5)。
2.7 重现性试验
准确称取蜀葵花样品5份,每份约1.0 g,按优化的条件提取和测定,计算样品中芦丁、槲皮素、山柰酚峰面积RSD的平均值,分别为1.2%、2.2%、2.0%。实验结果表明重现性良好。

表 1 3种分析物的线性回归方程、相关系数和线性范围Table 1 Linear regression equations, correlation coefficients and linear ranges of the three analytes
y: peak area;x: mass concentration, μg/mL.
2.8 稳定性试验
取同一样品溶液,分别放置0、3、6、9、12 h后,在优化的色谱条件下进行分析。芦丁、槲皮素、山柰酚峰面积的RSD分别为2.2%、1.9%、1.8%,表明蜀葵花提取液在12 h内稳定性良好。
2.9 加样回收率试验
准确称取已知芦丁、槲皮素和山柰酚含量的蜀葵花样品3份,每份约0.5 g,分别添加不同量的芦丁、槲皮素和山柰酚标准溶液,按照2.2节方法制备加标样品溶液,按1.5节色谱条件进行测定,结果见表2。
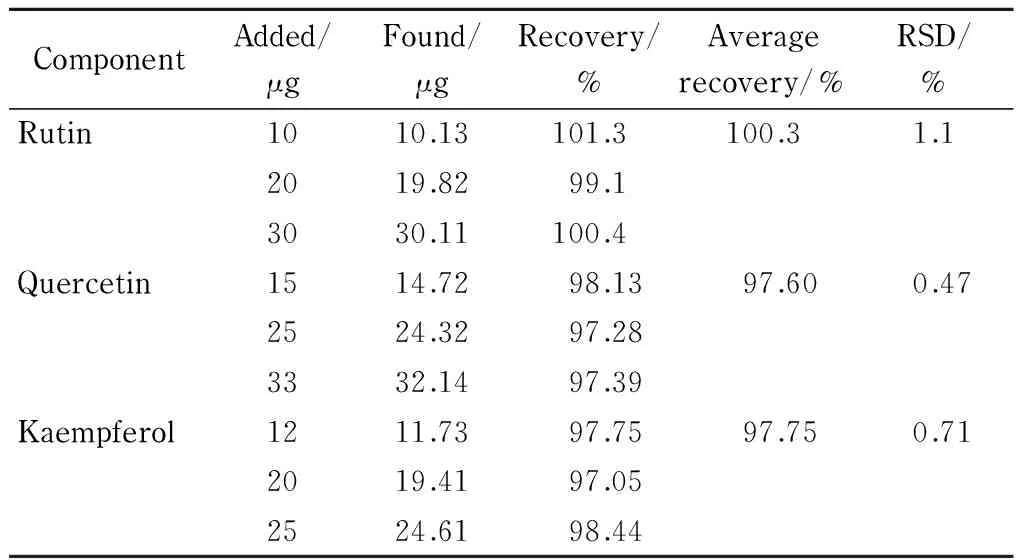
表 2 样品的加标回收率(n=5)Table 2 Recoveries of the spiked samples (n=5)
2.10 样品含量的测定
准确吸取蜀葵花样品提取液,进样10 μL,在优化的色谱条件下平行测定5次。样品中芦丁、槲皮素、山柰酚的含量分别为595.7 μg/g(RSD=1.1%)、77.60 μg/g(RSD=0.53%)、88.69 μg/g(RSD=0.69%)。
3 结论
本文建立了维药蜀葵花中芦丁、槲皮素及山柰酚3种物质的优化提取方法。以75%(v/v)甲醇为提取剂,通过超声实现高效提取。同时优化了液相色谱分析3种物质的实验条件,3种物质在25 min内实现基线分离。该方法简便快速、重现性好、准确可靠、精密度较高,可以用于同时测定蜀葵花中芦丁、槲皮素及山柰酚的含量。本文不但可以为蜀葵花资源的深度开发利用、药用价值研究以及质量评价提供科学依据,样品提取和分析过程也可为其他维药的分析提供借鉴。
[1] Compiling Group of Glossary of Chinese Traditional and Herbal Drugs. Glossary of Chinese Traditional and Herbal Drugs. 2nd ed. Beijing: People’s Medical Publishing House (PMPH)(《全国中草药汇编》编写组. 全国中草药汇编. 第2版. 北京: 人民卫生出版社), 1996: 648
[2] Alpna J. Advances in Plant Sciences, 2013, 26(1): 153
[3] Eskandari M, Samavati V. Int J Biol Macromol, 2015, 72: 347
[4] Yinayetula, Hailiqiemu. Uighur Medicinal Materials. Urumqi: Xinjiang Science and Technology Press (伊那耶吐拉, 海力且木. 维吾尔常用药材. 乌鲁木齐: 新疆科技卫生出版社), 1991: 156
[5] Jiangsu New Medical College. Dictionary of Chinese Medicinal Herb. Shanghai: Shanghai Science and Technology Press (江苏新医学院. 中药大辞典. 上海: 上海科学技术出版社), 1986: 2488
[6] Feng Y L, Xu L Z, Yang S L, et al. Chinese Traditional and Herbal Drugs (冯育林, 徐丽珍, 杨世林, 等. 中草药), 2005, 36(11): 1610
[7] Feng Y L, Li Y Q, Xu L Z, et al. Chinese Traditional and Herbal Drugs (冯育林, 李云秋, 徐丽珍, 等. 中草药), 2006, 37(11): 1622
[8] Zhang W, Chen Q, Liu L L, et al. Journal of Shenyang Pharmaceutical University (张祎, 陈秋, 刘丽丽, 等. 沈阳药科大学学报), 2013, 30(5): 335
[9] Mian Q H, Zheng D C, Sun L. Journal of Xinjiang Medical University (勉强辉, 郑大成, 孙莲. 新疆医科大学学报), 2014, 37(2): 160
[10] Shang Z C, Wang B C, Zhang W W, et al. China Pharmacy (尚志春, 王宝昌, 张微微, 等. 中国药房), 2013, 24(27): 2526
[11] Xu J Y, Li S. Chinese Journal of Experimental Traditional Medical Formulae (许继艳, 李硕. 中国实验方剂学杂志), 2014, 20(12): 69
[12] Zhang J C, Wei J, Zhong H M, et al. Chinese Journal of Chromatography (张敬彩, 魏杰, 钟虹敏, 等. 色谱), 2013, 31(1): 79
[13] Mao X Q, Bian H T, Qu B C. Chinese Journal of Chromatography (毛希琴, 边海涛, 曲宝成. 色谱), 2013, 31(8): 775
[14] Qi L, Zhang J, Zhang Z Q. Chinese Journal of Chromatography (亓亮, 张婧, 张志琪. 色谱), 2013, 31(3): 249
[15] Zhao F, Gao G H, Na H Q, et al. Chinese Journal of Chromatography (赵飞, 高广慧, 那海秋, 等. 色谱), 2013, 31(5): 490
[16] National Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China, Part 1. Beijing: Chemical Industry Press (国家药典委员会编. 中华人民共和国药典, 一部. 北京: 中国医药科技出版社), 2010: 1081
[17] Zhou R, Cao Z Y, Mou R X, et al. Chinese Journal of Chromatography (周蓉, 曹赵云, 牟仁祥, 等. 色谱), 2015, 33(1): 35
[18] Chen H, Huang Y, Zhai J L. Chinese Journal of Pharmaceutical Analysis (陈晖, 黄燕, 瞿继兰. 药物分析杂志), 2012, 32(9): 1574
[19] Zhou N, Yang Q, Yang M, et al. Chinese Journal of Pharmaceutical Analysis (周浓, 杨勤, 杨敏, 等. 药物分析杂志), 2013, 33(2): 225
[20] Zhang Y, Xue K P, Zhou A, et al. Chinese Journal of Chromatography (张勇, 薛昆鹏, 周安, 等. 色谱), 2014, 32(1): 47
[21] Li Z C, Chen L Y, Guo S H. Journal of Analytical Science (林珠灿, 陈丽云, 郭素华. 分析科学学报), 2013, 29(6): 819
[22] Huang W, Gao J, Cheng W M, et al. Asian J Chem, 2014, 26(11): 3134
[23] Xie Z S, Lam S C, Wu J W, et al. Anal Methods, 2014, 6 (12): 4328
[24] Parvu M, Toiu A, Vlase L, et al. Nat Prod Res, 2010, 24(14): 1318
Determination of rutin, quercetin and kaempferol inalthaearosea(L) Gavan for Uyghur medicine by high performance liquid chromatography
MUHETAER5Tu’erhong1,2, RESALAT5Yimin1, CHU Ganghui1,2,YIN Xuebo1,2, MUNIRA5Abudukeremu2*
(1.CollegeofChemistryandEnvironmentalSciences,KashgarUniversity,Kashgar844006,China;2.XinjiangLaboratoryofNativeMedicinalandEdiblePlantResourcesChemistry,Kashgar844006,China)
Uyghur medicine is one important part of the national medicine system. Uyghur medicine modernization, namely the study of effective components with modern technologies, is the only way for the scientification, standardization, and industrialization of Uyghur medicine. Here we developed a selective extraction method for rutin, quercetin and kaempferol inAlthaearosea(L) Gavan. The three active species were determined by high performance liquid chromatography (HPLC) with HC-C18 column (250 mm×4.6 mm, 5 μm) and the mobile phase of CH3OH-0.4% H3PO4(50∶50, v/v). Rutin, quercetin and kaempferol were baseline separated with each other and the interference species with flow rate of 1.0 mL/min and column temperature of 30 ℃. Under the optimal conditions, linear correlation were obtained in the mass concentration range of 12.5-150 μg/mL (r=0.999 8) for rutin, 12.5-125 μg/mL (r=0.999 9) for quercetin, and 12.5-125 μg/mL (r=0.998 8) for kaempferol. The recoveries (n=5) of rutin, quercetin and kaempferol were 100.25% (RSD=1.1%), 97.60% (RSD=0.47%) and 97.75% (RSD=0.71%), respectively. The method can be used to determine the contents of rutin, quercetin and kaempferol inAlthaearosea(L) Gavan and provide the guidance for the analysis of the flavonoids in other Uyghur medicines.
high performance liquid chromatography (HPLC); rutin; quercetin; kaempferol;Althaearosea(L) Gavan
10.3724/SP.J.1123.2015.05008
新疆维吾尔自治区高校科研计划重点课题项目(XJEDU2011147).
2015-05-08
O658
A
1000-8713(2015)12-1269-05
* 通讯联系人.E-mail:munira818@163.com.
