免疫磁珠富集净化-超高效液相色谱法同时测定陈皮中4种黄曲霉毒素
2015-03-24邢言言于治国赵云丽
邢言言, 佟 玲, 陈 楠, 于治国, 赵云丽*
(1. 沈阳药科大学药学院, 辽宁 沈阳 110016; 2. 天士力控股集团研究院药物分析所, 天津 300402)
技术与应用
免疫磁珠富集净化-超高效液相色谱法同时测定陈皮中4种黄曲霉毒素
邢言言1, 佟 玲2, 陈 楠2, 于治国1, 赵云丽1*
(1. 沈阳药科大学药学院, 辽宁 沈阳 110016; 2. 天士力控股集团研究院药物分析所, 天津 300402)
将ProtElut NHS(N-羟基丁二酰亚胺)偶联磁珠与抗黄曲霉毒素总量单克隆抗体偶联得到黄曲霉毒素总量免疫磁珠,其具有较好的分散性,良好的磁性能和特异的选择性。本文建立了陈皮中4种黄曲霉毒素的免疫磁珠富集净化,超高效液相色谱(UPLC)检测方法。样品经甲醇-PBS缓冲溶液(2∶8, v/v)提取后用免疫磁珠富集净化,1 mL甲醇洗脱;经ACQUITY UPLC HSS T3 C18色谱柱(100 mm×2.1 mm, 1.8 μm)分离,以水和甲醇为流动相梯度洗脱,采用汞/氙灯荧光检测器测定。实验结果表明,4种黄曲霉毒素在各自的线性范围内峰面积与其质量浓度线性关系良好,相关系数(r2)大于0.999;检出限(信噪比为3)为0.013~0.038 μg/kg,定量限(信噪比为10)为0.044~1.2 μg/kg;平均回收率为63.9%~115.0%,相对标准偏差为0.4%~14.2%,均符合痕量分析的要求。该方法简单快速、准确可靠,可用于陈皮中4种黄曲霉毒素的测定。
免疫磁珠;超高效液相色谱法;黄曲霉毒素;陈皮
黄曲霉毒素(aflatoxins, AFs)是由黄曲霉和寄生曲霉在繁殖过程中产生的一类分子结构相似的次级代谢产物,被世界卫生组织(WHO)的癌症研究机构(IARC)划定为I类致癌物[1]。目前报道的AFs有20多种[2],中药材在采收、贮存、加工和炮制过程中处理不当易被AFs污染,较常见的有黄曲霉毒素B1(AFB1)、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2),其中AFB1的毒性最强。《中国药典》2010年版一部规定陈皮、桃仁、酸枣仁、僵蚕和胖大海5味药材需进行AFs检测,其中AFB1限量为5 μg/kg, AFB1+AFB2+AFG1+AFG2限量为10 μg/kg[3]。
对于痕量分析而言,样品的前处理对整个分析过程显得至关重要。目前,AFs的前处理方法主要包括有机溶剂萃取法和免疫亲和色谱法等。有机溶剂萃取法存在过程复杂、毒性大、耗时等缺点,且最终提取物中易存在其他荧光物质、色素、结构类似物,会对检测结果产生干扰[4,5]。与有机溶剂萃取法相比,免疫亲和色谱法提高了试样的净化效率,且减少了有毒有害试剂的使用,但样品前处理较复杂,对操作人员的技术要求较高。免疫磁珠分离技术是20世纪70年代后期发展起来的一项与磁载体结合的免疫学技术,它同时具备了免疫学反应的高度专一性以及固相化试剂所特有的优点,已广泛应用于分离及浓缩特定细胞、微生物、蛋白质和核酸片段等肉眼难以观察或样品中含量不高的物质[6,7]。免疫磁珠分离技术的原理是内含Fe3O4的纳米磁珠的表面修饰官能团与抗体结合构成免疫磁珠(immunomagnetic beads, IMBs),免疫磁珠富集净化体系的作用力是外界磁场,磁性纳米颗粒在磁场中可定向运动,从而在反应结束后能利用磁铁实现反应体系和未反应体系的快速分离,避免了繁琐的过滤或离心过程,且消耗溶剂少,操作简单,大大缩短了前处理时间。
关于AFs的检测方法有酶联免疫法[8]、薄层色谱法[9]、荧光分光光度计法[10,11]、HPLC法[12-14]、UPLC法[15]及LC-MS联用法[16,17]等。酶联免疫法适用于AFs的快速筛查,但重复性差,假阳性出现率较高;薄层色谱法由于灵敏度低及重复性差,目前应用较少;HPLC法是目前应用最多的定量检测方法,但由于AFB1和AFG1与水接触后会产生荧光淬灭现象,原有较强的荧光特性基本消失,分析时一般需要柱前或柱后衍生,检测步骤增加,造成分析速度较慢,耗费有机溶剂较多,费时费力。LC-MS联用法能够同时进行定性和定量分析,能有效排除假阳性结果,但仪器昂贵,不易推广。UPLC法借助于HPLC法的理论及原理,涵盖了小颗粒填料、低系统体积及快速检测手段等全新技术,与传统的HPLC法相比,增加了分析的通量、灵敏度及色谱峰容量,缩短了分析时间,同时减少了溶剂用量,降低了分析成本。此外,本文选用的荧光检测器使用了汞/氙灯,而汞在365 nm下发射强度比氙灯高10倍。这种超强的发射强度实现了AFB1和AFG1在不衍生的情况下依然保持较强的信号。加上小容量荧光检测池的高灵敏度,省去了衍生的步骤,大大缩短了检出周期,提高了检测速度和重复性。
本研究将免疫磁珠用于陈皮中AFs的富集净化,同时结合UPLC法进行定量分析。通过优化前处理和色谱分析条件,建立了对陈皮中AFs具有高选择性的高灵敏度分析方法。
1 实验部分
1.1 仪器与试剂
ACQUITY UPLC H-CLASS超高效液相色谱仪(美国Waters公司); ACQUITY UPLC FLR荧光检测器(美国Waters公司); KQ-500DE超声仪(昆山市超声仪器有限公司);日立CF16RN高速冷冻离心机(天美科学仪器有限公司); Vortex-Genie2多功能涡旋混合器(美国Scientific Industries公司); S-4800型扫描电子显微镜(日本Hitachi公司); Nicolet Nexus 470型傅里叶红外光谱仪(美国Nicolet公司); K5500超微量分光光度计(北京凯奥科技发展有限公司)。
黄曲霉毒素B1、B2、G1、G2混合标准溶液(质量浓度:B1, 1.0 μg/mL; B2, 0.3 μg/mL; G1, 1.0 μg/mL; G2, 0.3 μg/mL;美国Supelco公司);抗黄曲霉毒素总量单克隆抗体(anti-total aflatoxins monoclonal antibody, AFT;华安麦科生物技术有限公司); ProtElut NHS(N-羟基丁二酰亚胺)偶联磁珠(英芮诚生化科技有限公司);牛血清白蛋白(BSA) (生化试剂,国药试剂有限公司);考马斯亮蓝G-250染料试剂(生化试剂,上海远慕生物科技有限公司);甲醇为色谱纯;其他试剂均为分析纯。实验用水为美国Millipore公司Milli-Q纯水系统制备的超纯水。
陈皮药材购于河北省安国中药材市场,产地为四川省。
1.2 实验方法
1.2.1 溶液的配制
PBS稀释液:称取氯化钠4.0 g,磷酸氢二钠0.71 g,磷酸二氢钾0.135 g,氯化钾0.10 g,用490 mL水溶解,饱和氢氧化钠调节pH值至7.4,加水稀释至500 mL,混匀,即得。
对照品溶液:精密量取黄曲霉毒素混合标准溶液0.5 mL,置于10 mL量瓶中,用甲醇稀释至刻度,摇匀,作为储备液(AFB1、AFB2、AFG1、AFG2的质量浓度分别为50、15、50、15 ng/mL)。精密量取储备液1 mL,置于25 mL量瓶中,用甲醇稀释至刻度,摇匀,即得。
1.2.2 免疫磁珠的制备
将1 mg AFT与60 mg ProtElut NHS磁珠混合,加入含0.02%(质量分数)叠氮钠的PBS溶液1 mL。4 ℃下孵育8 h后磁性分离,弃去上清液;加乙醇胺封闭缓冲液,室温孵育1 h后用PBS清洗3次,加入含0.02%(质量分数)叠氮钠的PBS溶液混悬,于4 ℃下保存,待用。利用Bradford蛋白定量法测定AFT和NHS磁珠的偶联效率。
1.2.3 供试品溶液的制备
将陈皮样品粉碎,过3号筛。精密称取1.0 g,加氯化钠0.2 g,置于50 mL离心管中,精密加入20%(体积分数)甲醇-PBS缓冲溶液(pH 7.4)10 mL,超声10 min,离心3 min(转速10 000 r/min);精密量取3 mL上清液加入到洗涤好的免疫磁珠(3 mg)中,涡旋富集10 min。用磁铁将免疫磁珠快速吸附到离心管一侧,吸取上清液,再加入20%(体积分数)甲醇-PBS缓冲溶液(pH 7.4)洗涤1次。移除洗涤液后,用1 000 μL纯甲醇洗脱吸附AFs后的免疫磁珠3次(前两次每次用400 μL,最后1次用200 μL),收集洗脱液,过0.22 μm滤膜。
1.2.4 色谱条件
色谱柱:ACQUITY UPLC HSS T3 C18色谱柱(100 mm×2.1 mm, 1.8 μm)。流动相:A为水,B为甲醇;梯度洗脱程序:0~9.0 min, 70%A~38%A; 9.0~10.0 min, 38%A~0%A; 10.0~10.1 min, 0%A~70%A; 10.1~12.0 min, 70%A。流速:0.3 mL/min。柱温:30 ℃。进样量:5 μL。荧光检测器激发波长:365 nm;发射波长:450 nm。
2 结果与讨论
2.1 免疫磁珠的表征与分析
2.1.1 免疫磁珠的表征
用扫描电子显微镜和傅里叶红外光谱仪观察偶联AFT前后的NHS纳米磁珠的晶体形态、大小及红外吸收情况(见图1和图2)。从图1a和图1b中可以看到修饰有NHS基团的Fe3O4粒径分布均匀,约120 nm,分散性良好,无聚团现象。单个NHS纳米磁珠的表面仍由很多细小颗粒构成,说明NHS基团对Fe3O4的修饰过程并未影响Fe3O4核,而且较大的表面积利于AFT的偶联。图1c和图1d表明偶联了AFT的NHS磁珠分散性依然很好,无聚团现象,具有较好的形貌。从图2a中可以看到572 cm-1处为Fe3O4的红外吸收峰,图2b中569 cm-1处也有Fe3O4的红外吸收峰,说明AFT的修饰对Fe3O4自身无影响。此外,图2b中也有偶联AFT后的一些基团的红外吸收峰,3 416 cm-1处为AFT的O-H的吸收峰;1 542 cm-1为N-H键的变形振动峰,是偶联后的AFT的N-H键所致;1 636 cm-1是AFT分子内C=O双键的吸收峰;1 076 cm-1是AFT分子内C-O单键的吸收峰。说明AFT成功修饰在NHS磁珠表面。
2.1.2 NHS磁珠与AFT的偶联
NHS磁珠外表面的NHS基团与AFT的伯氨基团反应,形成C-N共价键,实现AFT与磁珠的共价偶联。利用此原理,本实验成功将AFT偶联到NHS磁珠表面。采用Bradford蛋白定量法测定抗黄曲霉毒素总量单克隆抗体和NHS磁珠的偶联效率(以BSA为标准物绘制Bradford标准曲线),平均偶联率为99%,由此说明1 mg AFT基本全部被60 mg ProtElut NHS磁珠偶联。
2.2 免疫磁珠富集净化条件的优化
2.2.1 免疫磁珠富集净化的温度与pH值
免疫磁珠富集净化使用的抗原、抗体多在15~40 ℃范围内反应,过高的温度会使抗原、抗体失活。参考商品化的黄曲霉毒素总量免疫亲和柱使用前需恢复至室温(22~25 ℃),本文也选择将制备好的免疫磁珠恢复至室温进行实验。
抗原和抗体的结合反应必须在合适的pH值环境中进行,一般pH值为6~8。pH值过高或过低都将影响抗原与抗体的理化性质,pH值达到或接近抗原的等电点时,即使无相应的抗体存在,也会引起颗粒性抗原非特异性的凝集,造成假阳性反应。常用的抗原、抗体反应pH值为7.4[18],而保存AFT的PBS缓冲溶液pH值也为7.4,因此免疫磁珠净化体系的pH值定为7.4。

图 1 偶联AFT(a, b)前和(c, d)后的NHS磁珠扫描电镜图Fig. 1 Photographs of scanning electron microscope (SEM) of ProtElut NHS magnetic beads (a, b) before and (c, d) after coupling AFT
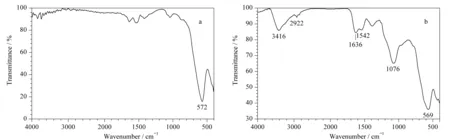
图 2 偶联AFT(a)前和(b)后的ProtElut NHS磁珠红外光谱图Fig. 2 Photographs of Fourier transform infrared spectroscopy of ProtElut NHS magnetic beads (a) before and (b) after coupling AFT
2.2.2 免疫磁珠的使用量
免疫磁珠富集净化样品时,吸附是关键步骤,为更好地控制免疫磁珠对AFs的吸附量,本文对免疫磁珠的使用量进行了优化。分别称取0.5、1、3、5、7 mg免疫磁珠,加入含黄曲霉毒素(AFB1: 3 ng/mL; AFB2: 0.9 ng/mL; AFG1: 3 ng/mL; AFG2: 0.9 ng/mL)的甲醇-PBS缓冲溶液(2∶8, v/v)溶液3 mL,使免疫磁珠与样品溶液充分混合,不同质量的免疫磁珠对4种AFs回收率的影响如图3a所示。在0.5~3 mg范围内,随磁珠量的增大,AFs的回收率显著增大;当磁珠量增至3 mg后,4种AFs的回收率不再增加,基本趋于饱和。因此最终选择免疫磁珠的加入量为3 mg。
2.2.3 免疫磁珠富集净化的时间
在pH 7.4及室温条件下,考察了不同富集吸附时间下免疫磁珠对4种AFs的富集净化效果。结果(见图3b)表明,10 min后免疫磁珠对4种AFs的富集量基本达到饱和。故最终确定富集净化时间为10 min。
2.2.4 免疫磁珠的洗脱体积与洗脱时间
为了确定洗脱液甲醇对免疫磁珠的洗脱体积与洗脱时间,分别使用400、800、1 000、1 200 μL甲醇对免疫磁珠进行洗脱,实验结果(见图3c)表明,当洗脱体积为1 000 μL时,4种AFs的回收率均较高,洗脱效果较好。洗脱时将甲醇加入反应体系内,分别振摇1、2、3、4、5 min,结果(见图3d)表明,振摇至3 min时洗脱已基本完成。故最终确定甲醇的洗脱体积为1 000 μL,洗脱时间为3 min。

图 3 (a)免疫磁珠的加入量、(b)富集时间、(c)洗脱液的体积和(d)洗脱时间对AFs回收率的影响Fig. 3 Effects of (a) the amount of immune magnetic beads, (b) enrichment time, (c) elution volume and (d) elution time on the recoveries of AFs Extraction conditions: sample, 3.0 mL AFs mixed standard solution (AFB1: 3 ng/mL; AFB2: 0.9 ng/mL; AFG1: 3 ng/mL; AFG2: 0.9 ng/mL); 20%(v/v) methanol-PBS buffer solution (pH7.4); room temperature.
2.3 色谱条件的优化
本文采用不同比例的甲醇-水系统等度和梯度洗脱分离陈皮样品中的4种AFs,并考察了ACQUITY UPLC HSS T3 C18色谱柱(100 mm×2.1 mm, 1.8 μm)、ACQUITY UPLC BEH C18色谱柱(100 mm×2.1 mm, 1.7 μm)及ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm, 1.7 μm)对陈皮样品中4种AFs的分离情况。结果表明,在1.2.4节所述的色谱条件下,基本无杂质峰出现且样品和标准样品的峰形较好,分离效果最佳,色谱图见图4。由于黄曲霉毒素B1和G1接触水后易发生荧光淬灭现象,因此常规分析时需柱前或者柱后衍生,费时费力。本文使用FLR荧光检测器,其汞/氙灯的汞在365 nm下发射强度比氙灯高10倍,因此黄曲霉毒素B1和G1不经过衍生响应信号依然较强。在本文选择的激发光波长为365 nm、发射波长为450 nm时荧光检测器的检测灵敏度最高。
2.4 方法学考察
2.4.1 专属性
从图4可以看出方法的专属性良好,陈皮中的其他物质不干扰4种AFs的测定。
2.4.2 线性范围和相关系数
取黄曲霉毒素混合对照品储备液,用甲醇稀释成系列浓度的混合对照溶液,分别进样5 μL,记录色谱图,以质量浓度x(ng/mL)为横坐标,峰面积y为纵坐标,绘制标准曲线,得到线性方程、线性范围和相关系数(见表1)。
2.4.3 检出限和定量限
在阴性样品中加入不同量的黄曲霉毒素混合对照品储备溶液,按建立的方法进行样品前处理和测定。以信噪比为3(S/N=3)确定检出限,4种AFs的检出限为0.013~0.038 μg/kg;以S/N=10确定定量限,4种AFs的定量限为0.044~1.2 μg/kg。
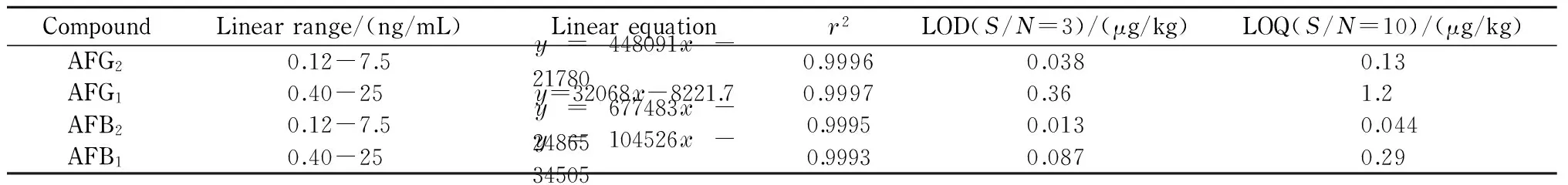
表 1 4种黄曲霉毒素的线性范围、线性方程、相关系数(r2)、检出限和定量限Table 1 Linear ranges, linear equations, correlation coefficients (r2), limits of detection (LODs) and limits of quantification (LOQs) of the four aflatoxins
y: peak area;x: mass concentration, ng/mL.

图 4 AFs的超高效液相色谱图Fig. 4 UPLC chromatograms of AFs a. mixed standard solution (AFB1: 2 ng/mL; AFB2: 0.6 ng/mL; AFG1: 2 ng/mL; AFG2: 0.6 ng/mL); b. Citrus reticulatablanco spiked with AFs (as 2 μg/kg of AFB1); c. blank Citrus reticulatablanco sample.
2.4.4 仪器精密度
取黄曲霉毒素混合对照溶液(AFB1: 2 ng/mL; AFB2: 0.6 ng/mL; AFG1: 2 ng/mL; AFG2: 0.6 ng/mL),连续进样6次,记录峰面积,计算4种AFs的RSD。AFB1、AFB2、AFG1、AFG2的RSD分别为0.6%、0.6%、1.6%、1.0%,表明仪器精密度良好。
2.4.5 稳定性
精密称取1.0 g阴性样品,以AFB1计为5 μg/kg的水平添加黄曲霉毒素混合对照品储备溶液,按建立的方法制备供试品溶液,于制备后0、2、4、6、8、12 h进样分析,记录峰面积,AFB1、AFB2、AFG1、AFG2峰面积的RSD分别为1.0%、0.8%、0.9%、0.9%。表明陈皮加标提取液在12 h内稳定。
2.4.6 加标回收率和重复性
以陈皮的空白样品进行3个水平的添加回收试验,每个加标水平重复6次,计算回收率和相对标准偏差。结果(见表2)表明,平均回收率介于63.9%和115.0%之间,RSD为0.4%~14.2%。回收率和重复性数据均满足国际食品法典委员会对痕量物质分析的方法学要求[19]。

表 2 4种黄曲霉毒素的加标回收率及其相对标准偏差(n=6)Table 2 Spiked recoveries and the RSDs of the four aflatoxins (n=6)
2.5 样品测定
采用本文建立的方法分别测定6批陈皮样品,均未检出黄曲霉毒素。为了排除假阴性结果,采用高效液相色谱-串联质谱法对该6批陈皮样品进行结果复核实验。结果表明6批陈皮样品均不含4种AFs。同时也证明了本文建立的方法准确可靠。
3 结论
本文制备的一种黄曲霉毒素总量(AFB1+AFB2+AFG1+AFG2)免疫磁珠分散性好。将其用于富集净化黄曲霉毒素,操作简单,净化富集效果好。建立的新型免疫磁珠富集净化-超高效液相色谱检测中药材陈皮中黄曲霉毒素(AFB1、AFB2、AFG1、AFG2)的方法,无需衍生化,灵敏度高,结果准确可靠。
[1] World Health Organization International Agency for Research on Cancer. IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Some Naturally Occurring Substances: Food Items and Constituents, Heterocyclic Aromatic Amines and Mycotoxins, Vol 56. Lyon: World Health Organization, 1993: 489
[2] Tian R H, Sun J P. Food Research and Development (田瑞红, 孙健平. 食品研究与开发), 2015, 36(6): 149
[3] Pharmacopoeia Commission of People’s Republic of China. Pharmacopoeia of People’s Republic of China, Part 1. Beijing: China Medical Science Press (国家药典委员会. 中华人民共和国药典, 一部. 北京: 中国医药科技出版社), 2010: 177
[4] Xie F, Lai W H, Shi A W, et al. Food Science (谢芳, 赖卫华, 史爱武, 等. 食品科学), 2013, 34(18): 165
[5] Sun X L, Zhao X L, Tang J. Food Science (孙秀兰, 赵晓联, 汤坚. 食品科学), 2004, 25(7): 128
[6] Wen Y M, Xu J T, Xiang J J. Chinese Journal of Immunology (闻一鸣, 徐金亭, 向军俭. 中国免疫学杂志), 2013, 29(1): 88
[7] Xie F. [MS Dissertation]. Nanchang: Nanchang University (谢芳. [硕士学位论文]. 南昌: 南昌大学), 2013
[8] Li Y S, Chen J M. Chinese Traditonal and Herbal Drugs (李延生, 陈建民. 中草药), 2000, 31(8): 586
[9] Lu Z Y, Ye J W, Yuan W P, et al. Traditional Chinese Medicine (卢志雁, 叶锦文, 苑文平, 等. 中医药学刊), 2001, 19(5): 527
[10] Zhang X H, Chen J M. Acta Pharmaceutica Sinica (张雪辉, 陈建民. 药学学报), 2004, 39(12): 997
[11] Chen J M, Zhang X H, Yang M H, et al. Chinese Traditonal and Herbal Drugs (陈建民, 张雪辉, 杨美华, 等. 中草药), 2006, 37(3): 463
[12] Zheng R, Mao D, Wang K, et al. Chinese Journal of Pharmaceutical Analysis (郑荣, 毛丹, 王柯, 等. 药物分析杂志), 2005, 25(6): 610
[13] Liu L N, Wang Y, Jin H Y, et al. Chinese Journal of Pharmaceutical Analysis (刘丽娜, 王莹, 金红宇, 等. 药物分析杂志), 2011, 31(7): 1256
[14] Hao A Y, Zhao L Y, Liu Y H, et al. Chinese Journal of Pharmaceutical Analysis (郝爱鱼, 赵丽元, 刘英慧, 等. 药物分析杂志), 2012, 32(12): 2203
[15] Cai Z B, Zhang Y, Zheng Z W, et al. Chinese Journal of Frontier Health and Quarantine (蔡志斌, 张英, 郑志伟, 等. 中国卫生检疫杂志), 2013, 23(2): 312
[16] Yang X L, Qiu F, Wei R W, et al. Chinese Journal of Pharmaceutical Analysis (杨小丽, 仇峰, 韦日伟, 等. 药物分析杂志), 2012, 32(4): 627
[17] Hu W Y, Xu L, Yang J, et al. Chinese Journal of Chromatography (胡文彦, 许磊, 杨军, 等. 色谱), 2014, 32(2): 133
[18] Liu W W, Sun X L, Zhang Y Z, et al. Journal of Instrumental Analysis (刘伟伟, 孙秀兰, 张银志, 等. 分析测试学报), 2011, 30(12): 1345
[19] World Health Organization and Food Agriculture Organization of the United Nation. Codex Alimentarius Commission: Procedural Manual. 23rd ed. Rome: FAO, 2015: 76
Simultaneous determination of four aflatoxins inCitrusreticulatablancoby ultra performance liquid chromatography coupled with immunomagnetic beads for enrichment and purification
XING Yanyan1, TONG Ling2, CHEN Nan2, YU Zhiguo1, ZHAO Yunli1*
(1.SchoolofPharmacy,ShenyangPharmaceuticalUniversity,Shenyang110016,China;2.PharmaceuticalAnalysisInstituteofTaslyHoldingGroup,Tianjin300402,China)
Immunomagnetic beads (IMBs) were formed by coupling the ProtElut NHS (N-hydroxysuccinimide) magnetic beads and anti-aflatoxins monoclonal antibody. The synthesized IMBs presented uniform size, good magnetic property and specific selectivity. In this work, a novel and facile pretreatment method of sample enrichment and purification based on the IMBs for the determination of aflatoxins (AFs) (AFB1, AFB2, AFG1, AFG2) inCitrusreticulatablancosamples by ultra performance liquid chromatography (UPLC) were developed. The sample was extracted with 20%(v/v) methanol-PBS buffer solution (pH 7.4), followed by a cleanup procedure with the IMBs. The target compounds were eluted using 1 mL methanol. The four afatoxins were separated on an ACQUITY UPLC HSS T3 C18column (100 mm×2.1 mm, 1.8 μm) adopting a gradient program within 12 min. The UPLC equipped with a fluorescence detector with a special mercury/xenon lamp was used to detect the aflatoxins. The satisfactory correlation coefficients (r2>0.999) of the four aflatoxins were obtained within their respective linear ranges. The limits of detection (S/N=3) were between 0.013 μg/kg and 0.038 μg/kg, and the limits of quantification (S/N=10) were between 0.044 μg/kg and 1.2 μg/kg. The recoveries were in the range of 63.9%-115.0% with the relative standard deviations (RSDs) of 0.4%-14.2%. The validation results meet the requirements of trace assay. It’s indicated that the IMBs were good pretreatment alternatives and the developed method is simple, fast, accurate, and can be applied for the simultaneous determination of the four aflatoxins inCitrusreticulatablanco.
immunomagnetic beads (IMBs); ultra performance liquid chromatography (UPLC); aflatoxins (AFs);Citrusreticulatablanco
10.3724/SP.J.1123.2015.06001
国家“重大新药创制”科技重大专项(2013ZX09402202).
2015-06-01
O658
A
1000-8713(2015)12-1320-07
* 通讯联系人.Tel:(024)23986295,E-mail:yunli76@163.com.
